江西省赣州市赣县第三中学2020-2021年高二上册9月入学考试化学免费试卷完整版
| 1. 选择题 | 详细信息 |
|
“绿水青山就是金山银山”。下列做法不利于保护环境的是( ) A.推广使用电动汽车等低碳交通工具 B.推广垃圾分类,电子设备以旧换新 C.用生物方法脱除生活污水中的氮和磷 D.加大铅酸蓄电池、含汞锌锰等电池的生产 |
|
| 2. 选择题 | 详细信息 |
|
重水(D2O)是重要的核工业原料,下列说法错误的是 A. 氘(D)原子核外有1个电子 B. 1H与D互称同位素 C. H2O与D2O互称同素异形体 D. 1H218O与D216O的相对分子质量相同 |
|
| 3. 选择题 | 详细信息 |
|
利用下列反应不能制得括号中的纯净物质的是 ( ) A. 乙烯与氯气加成(1,2-二氯乙烷) B. 乙烯与水加成(乙醇) C. 等物质的量的氯气与乙烷在光照的条件下反应(氯乙烷) D. 氯气与苯用氯化铁作催化剂反应(氯苯) |
|
| 4. 选择题 | 详细信息 |
|
对 A.v(A)= 0.002mol/(L·s) B.v(B)= 0.01mol/(L·s) C.v(C)= 0.4 mol/(L·min) D.v(D)= 0.45 mol/(L·min) |
|
| 5. 选择题 | 详细信息 | ||||||||||||||||||
|
根据表1信息,判断以下叙述正确的是( ) 表1 部分短周期元素的原子半径及主要化合价
|
|||||||||||||||||||
| 6. 选择题 | 详细信息 | ||||||||
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6 的分子结构如图所示: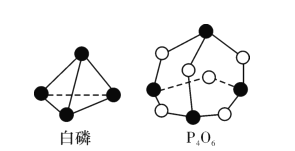 现提供以下化学键的键能,则反应P4(白磷)+3O2 = P4O6 中,消耗1mol P4的能量变化为
|
|||||||||
| 7. 选择题 | 详细信息 |
|
下列化学用语表示正确的是 A.氢氧根离子式: C.氯离子结构示意图: |
|
| 8. 选择题 | 详细信息 |
|
下列反应中前者属于取代反应,后者属于加成反应的是 A. 甲烷与氯气混和后光照反应:乙烯使酸性高锰酸钾溶液褪色 B. 乙烯使溴的四氯化碳溶液:苯与氢气在一定条件下反应生成环己烷 C. 苯滴入浓硝酸和浓硫酸的混合液中,有油状生成:乙烯与水生成乙醇的反应 D. 在苯中滴入溴水,溴水褪色; 乙烯使溴水褪色 |
|
| 9. 选择题 | 详细信息 |
|
阿伏加德罗常数的值为NA。下列说法不正确的是 A.常温常压下,2 g D2O 中含中子数为NA B.1mol苯乙烯( C.0.5mol羟基中所含电子数为4.5NA D.28g乙烯和丙烯(C3H6)的混合气体含有的碳原子数目为2NA |
|
| 10. 选择题 | 详细信息 |
Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如图所示。下列说法不正确的是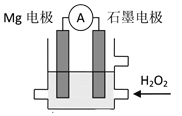 A.该电池正极的电极反应式:2H++H2O2+2e-=2H2O B.石墨电极上发生还原反应 C.溶液中H+向石墨电极移动 D.电池工作时,电子从Mg电极经导线流向石墨电极,再由石墨电极经电解质溶液流向Mg电极 |
|
| 11. 选择题 | 详细信息 |
某有机物的结构简式如图所示,下列说法中错误的是( )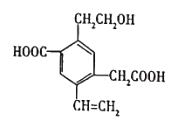 A.该有机物能够在催化剂作用下发生加成反应 B.该有机物能与NaHCO3溶液反应放出CO2 C.可用酸性KMnO4溶液检验其中的羟基 D.2mol该有机物和过量的金属钠反应最多可以生成3mol H2 |
|
| 12. 选择题 | 详细信息 |
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程,下列说法正确的是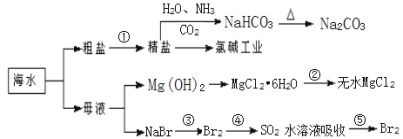 A. ①粗盐提纯中除去杂质离子Mg2+、Ca2+、SO42-时,必须先除SO42-后除Ca2+ B. 过程中②是将MgCl2·6H2O在空气中受热脱水得到无水MgCl2 C. 在③、④、⑤中,溴元素均被氧化 D. 可用澄清石灰水检验Na2CO3和NaHCO3 |
|
| 13. 选择题 | 详细信息 |
|
已知25ºC、101kPa下,石墨、金刚石燃烧的热化学方程式分别为 ①C(石墨)+O2(g)=CO2(g)释放393.51kJ能量 ②C(金刚石)+O2(g)=CO2(g)释放395.41kJ能量 据此判断,下列说法正确的是( ) A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石低 B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石高 C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石低 D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石高 |
|
| 14. 选择题 | 详细信息 | ||||||
分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是
|
|||||||
| 15. 选择题 | 详细信息 |
下列反应过程中的能量变化符合图示的是( ) ①酸碱中和反应 ②镁与盐酸反应 ③生石灰与水反应 ④铝热反应 ⑤石灰石分解 ⑥甲烷燃烧 A.①②③⑤ B.④⑤ C.③④ D.⑤ |
|
| 16. 选择题 | 详细信息 |
|
含NaOH 20.0g的稀溶液与足量稀盐酸反应,放出28.7 kJ的热量,表示该反应的热化学方程式正确的是( ) A.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= +28.7 kJ·mol-1 B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= _28.7 kJ·mol-1 C.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H=+57.4 kJ·mol-1 D.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= _57.4 kJ·mol-1 |
|
| 17. | 详细信息 |
|
有A、B、C、D、E、F、G 7种元素,试按下述所给的条件推断: ①A、B、C是同一周期的金属元素,已知原子核外均有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C; ②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体; ③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体; ④G是除氢外原子半径最小的主族元素 (1)A的名称是____,B位于周期表中位置 _________,C的原子结构示意图是________________。 (2)A元素与D元素形成的化合物的电子式是_________。 (3)G的单质与水反应的化学方程式是________。 (4)在上述七种元素中,最高价氧化物对应的水化物碱性最强的是_____(填化学式,下同),气态氢化物最稳定的是__________。 (5)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是_______________。 |
|
| 18. | 详细信息 |
I.依据A~E几种烃分子的示意图或结构填空。 (1)分子中所有原子共平面的是______(填序号)。 (2)等物质的量的上述烃完全燃烧时消耗O2 最多的是______(填序号);等质量的上述烃完全燃烧时消耗O2最多的是_________(填序号)。 (3)在120℃,1.01× l05 Pa 下,取气态的上述分烃别与足O2量混合点燃,完全燃烧后恢复至初始状态,气体体积没有变化的是______(填序号)。 II.现有以下几种有机物: ① CH4 ②CH3CH2CH2OH ③  ④癸烷 ⑤CH3COOH ⑥ ④癸烷 ⑤CH3COOH ⑥请根据上述给出的物质按要求回答下列问题: (4)与⑧互为同分异构体的是__________( 填序号); (5)用 “>” 表示 ①③④⑨密度从高到低排列顺序:__________; (6)具有特殊气味, 常作萃取剂的有机物在铁作催化剂的条件下与液溴发生一取代反应的化学方程式___________; (7)有机物②在加热条件下和CuO反应的化学方程式__________; |
|
| 19. | 详细信息 | ||||||||||||
Ⅰ.化学反应中的焓变(Δ H)与反应物和生成物的键能(E)有关。下表给出了一些化学键的键能:
|
|||||||||||||
| 20. | 详细信息 |
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取Al2O3的两种工艺流程如下: 请回答下列问题: (1)流程甲加入盐酸后生成Fe3+的离子方程式为________________; (2)铝土矿中固体A 是__________(填化学式),写出沉淀F转化为氧化铝的化学方程式_____________; (3)流程乙中,写出滤液Y 与过量CO2反应生成沉淀Z的离子方程式为________________________; (4)固体X 是__________________(填化学式) (5)利用铝热反应原理,写出有Cr2O3制备Cr的化学方程式_________________________________。 |
|
| 21. | 详细信息 |
丙烯酸乙酯存在于菠萝等水果中,可以用乙烯、丙烯等石油化工产品为原料合成,合成路线如图: 根据以上材料和所学的化学知识回答下列问题: (1)过程①是石油分馏,是石油炼制的重要坏节。工业上通常使用的分馏石油的方法有常压分馏和________。 (2)反应②的反应方程式为C10H22 → 2C3H6 + X,其中X的一氯代物同分异构体有____种。 (3)写出由C与丙烯酸制得丙烯酸乙酯的化学方程式____________,该反应的类型是_______。 (4)鉴别C和D常用试剂有__________、___________(写两种)。 (5)下列有关说法不正确的是______(填字母序号)。 a.E与丙烯酸乙酯互为同系物 b.C→D的转化是氧化反应 c.聚丙烯酸的结构简式为 d.分液不能分离C和E的混合物 |
|