ж–°з–Ҷй«ҳдәҢдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—зү©иҙЁзҡ„ж°ҙжә¶ж¶ІиғҪеҜјз”өпјҢдҪҶеұһдәҺйқһз”өи§ЈиҙЁзҡ„жҳҜпјҲ В В В пјү AпјҺCH3COOHВ В В В BпјҺSO2 В В В В В CпјҺC2H5OH В В В В В DпјҺ Cl2
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖе®ҡйҮҸзҡ„зӣҗй…ёи·ҹиҝҮйҮҸй”ҢзІүеҸҚеә”ж—¶пјҢдёәдәҶеҮҸзј“еҸҚеә”йҖҹзҺҮдҪҶеҸҲдёҚеҪұе“Қз”ҹжҲҗ В AпјҺеҠ е…Ҙе°‘йҮҸ CпјҺеҠ е…Ҙе°‘йҮҸ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷж°Ёж°ҙзј“зј“ең°ж»ҙе…Ҙзӣҗй…ёдёӯиҮідёӯжҖ§пјҢдёӢеҲ—жңүе…ізҡ„иҜҙжі•пјҡв‘ зӣҗй…ёиҝҮйҮҸВ В в‘Ўж°Ёж°ҙиҝҮйҮҸВ В в‘ўжҒ°еҘҪе®Ңе…ЁеҸҚеә” в‘Јc (NH4+) = c(ClпјҚ)В в‘Өc (NH4+) AпјҺв‘ в‘Ө В В В В В В BпјҺв‘ўв‘ЈВ В В В В В В В CпјҺв‘Ўв‘ӨВ В В В В В В DпјҺв‘Ўв‘Ј
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҺЁи®әжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү A.S(g)+O2(g)=SO2(g)В в–іH1пјҢS(s)+O2(g)=SO2(g)В в–іH2пјӣеҲҷпјҡв–іH1>в–і B.C(зҹіеўЁпјҢs)=C(йҮ‘еҲҡзҹіпјҢs)В в–іH=+1.9kJ/molпјҢеҲҷпјҡз”ұзҹіеўЁеҲ¶еҸ–йҮ‘еҲҡзҹізҡ„еҸҚеә”жҳҜеҗёзғӯеҸҚеә”пјҢйҮ‘еҲҡзҹіжҜ”зҹіеўЁзЁіе®ҡ C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)В в–іH=-57.4kJ/molпјҢеҲҷпјҡеҗ«20gNaOHзҡ„жә¶ж¶ІдёҺзЁҖзӣҗй…ёе®Ңе…ЁеҸҚеә”пјҢж”ҫеҮәзҡ„зғӯйҮҸдёә28.7kJ D. CaCO3(s)=CaO(s)+CO2(g)в–іH>0пјҢв–іS>0пјҢеҲҷиҜҘеҸҚеә”д»»дҪ•жё©еәҰдёӢйғҪиғҪиҮӘеҸ‘иҝӣиЎҢ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁжә¶и§ЈдәҺж°ҙдёӯпјҢиғҪдҝғиҝӣж°ҙзҡ„з”өзҰ»зҡ„жҳҜ(В В В В ) В AпјҺ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҜ№еҢ–еӯҰ平衡移еҠЁзҡ„еҲҶжһҗдёӯпјҢдёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү
В В В в‘ўжңүж°”дҪ“еҸӮеҠ зҡ„еҸҚеә”е№іиЎЎж—¶пјҢиӢҘеҮҸе°ҸеҸҚеә”еҷЁе®№з§Ҝж—¶пјҢе№іиЎЎдёҖе®ҡеҗ‘ж°”дҪ“дҪ“з§ҜеўһеӨ§зҡ„ж–№еҗ‘移еҠЁ В В В в‘Јжңүж°”дҪ“еҸӮеҠ зҡ„еҸҚеә”иҫҫе№іиЎЎж—¶пјҢеңЁжҒ’еҺӢеҸҚеә”еҷЁдёӯе……е…ҘзЁҖжңүж°”дҪ“пјҢе№іиЎЎдёҖе®ҡдёҚ移еҠЁ В В AпјҺв‘ в‘ЈВ В В В В В В В В В В BпјҺв‘ в‘Ўв‘ўВ В В В В В В CпјҺв‘Ўв‘ўв‘ЈВ В В В В В В В В DпјҺв‘ в‘Ўв‘ўв‘Ј
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ёж°ҙзЁҖйҮҠ0.1mol/Lж°Ёж°ҙж—¶пјҢжә¶ж¶ІдёӯйҡҸзқҖж°ҙйҮҸзҡ„еўһеҠ иҖҢеҮҸе°Ҹзҡ„жҳҜВ (В В В В ) AпјҺc(OHвҖ”)/c(NH3В·H2O) В В В В В BпјҺc(NH3В·H2O)/ c(OHвҖ”) В В CпјҺc(OHвҖ”)В В В В В В В В В В В В В В В В В В В В В В DпјҺn(NH4+)
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
100в„ғж—¶пјҢе°Ҷ0.1 mol N2O4зҪ®дәҺ1LеҜҶй—ӯзҡ„зғ§з“¶дёӯпјҢ然еҗҺе°Ҷзғ§з“¶ж”ҫе…Ҙ100в„ғ зҡ„жҒ’жё©ж§ҪдёӯпјҢзғ§з“¶еҶ…зҡ„ж°”дҪ“йҖҗжёҗеҸҳдёәзәўжЈ•иүІпјҡN2O4(g) В В В В в‘ N2O4зҡ„ж¶ҲиҖ—йҖҹзҺҮдёҺNO2зҡ„з”ҹжҲҗйҖҹзҺҮд№ӢжҜ”дёә1:2В В в‘ЎNO2з”ҹжҲҗйҖҹзҺҮдёҺNO2ж¶ҲиҖ—йҖҹзҺҮзӣёзӯүВ В В В В В В в‘ўзғ§з“¶еҶ…ж°”дҪ“зҡ„еҺӢејәдёҚеҶҚеҸҳеҢ–В В В В В В В В В В В В В В В В В В В В В В в‘Јзғ§з“¶еҶ…ж°”дҪ“зҡ„иҙЁйҮҸдёҚеҶҚеҸҳеҢ–В В В В В В В В В В В в‘ӨNO2зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёҚеҶҚж”№еҸҳВ В В В В В В В В В В В В В В В В в‘Ҙзғ§з“¶еҶ…ж°”дҪ“зҡ„йўңиүІдёҚеҶҚеҠ ж·ұ В В В В В в‘Ұзғ§з“¶еҶ…ж°”дҪ“зҡ„е№іеқҮзӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёҚеҶҚеҸҳеҢ–       ⑧зғ§з“¶еҶ…ж°”дҪ“зҡ„еҜҶеәҰдёҚеҶҚеҸҳеҢ–гҖӮ AпјҺв‘Ўв‘ўв‘Ҙв‘ҰВ В В В В BпјҺ①④⑧     CпјҺеҸӘжңүв‘ в‘ЈВ В В В В DпјҺеҸӘжңүв‘Ұ⑧
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
еҰӮеӣҫпјҲв… пјүиЎЁзӨәеҸҚеә”пјҡmA(g)+nB(g) AгҖҒm+nпјһp+q, BгҖҒm+nпјһp+q, CгҖҒm+nпјңp+q, DгҖҒm+nпјңp+q,
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—дәӢе®һдёҚиғҪз”ЁеӢ’еӨҸзү№еҲ—еҺҹзҗҶи§ЈйҮҠзҡ„жҳҜ(гҖҖгҖҖ) AпјҺз”ұNO2е’ҢN2O4з»„жҲҗзҡ„е№іиЎЎдҪ“зі»еҠ еҺӢеҗҺйўңиүІе…ҲеҸҳж·ұеҗҺеҸҳжө… BпјҺеўһеӨ§еҺӢејәеҸҜеҠ еҝ«SO2иҪ¬еҢ–дёәSO3зҡ„йҖҹзҺҮ CпјҺй»„з»ҝиүІзҡ„ж°Ҝж°ҙе…үз…§еҗҺйўңиүІеҸҳжө… DпјҺеңЁеҗ«жңүFe(SCN)3зҡ„зәўиүІжә¶ж¶ІдёӯеҠ й“ҒзІүпјҢжҢҜиҚЎйқҷзҪ®пјҢжә¶ж¶ІйўңиүІеҸҳжө…жҲ–иӨӘеҺ»
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
жҠҠдёӢеҲ—жә¶ж¶ІеҠ ж°ҙзЁҖйҮҠпјҢжә¶ж¶ІдёӯжҜҸз§ҚзҰ»еӯҗзҡ„жө“еәҰйғҪдёҚдјҡеўһеҠ зҡ„жҳҜ(гҖҖгҖҖ)оҖғ A.CH3COOHжә¶ж¶ІВ В В B.NaClжә¶ж¶ІоҖғВ В В В C.
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
жҠҠCa(OH)2еӣәдҪ“ж”ҫе…ҘдёҖе®ҡйҮҸзҡ„и’ёйҰҸж°ҙдёӯпјҢдёҖе®ҡжё©еәҰдёӢиҫҫеҲ°е№іиЎЎпјҡ Ca(OH)2пјҲsпјү AпјҺжә¶ж¶ІдёӯCa2+ж•°зӣ®еҮҸе°‘В В В В В В В В В BпјҺжә¶ж¶Ідёӯc(Ca2+)еўһеӨ§В CпјҺжә¶ж¶ІpHеҖјдёҚеҸҳВ В В В В В В В В В В В В В DпјҺжә¶ж¶ІpHеҖјеўһеӨ§
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘпјҡFe2O3(s) + C(s)+ O2(g)==CO2(g)В В В О”О—2=-393.5 kJВ·mol-1оҖү, еҲҷ2Fe(s) + AпјҺ-824.4 kJВ·mol-1оҖғBпјҺ-627.6 kJВ·mol-1оҖғCпјҺ-744.7 kJВ·mol-1оҖғDпјҺ-169.4 kJВ·mol-1
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
дёӢеҲ—йҷӨеҺ»жқӮиҙЁдёӯпјҢжүҖжңүзҡ„йҷӨжқӮиҜ•еүӮдёҚжӯЈзЎ®зҡ„жҳҜ(В В В В )
|
|||||||||||||||||||||
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁеҜҶй—ӯе®№еҷЁдёӯзҡ„дёҖе®ҡйҮҸж··еҗҲж°”дҪ“еҸ‘з”ҹеҸҚеә”пјҡ В AпјҺX+Y<ZВ В В В В В В В В В В В В В В В В В В В В В В В В В BпјҺе№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁ CпјҺBзҡ„иҪ¬еҢ–зҺҮйҷҚдҪҺдәҶВ В В В В В В В В В В В В В В В В DпјҺCзҡ„дҪ“з§ҜеҲҶж•°еўһеӨ§дәҶ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ёж ҮеҮҶзҡ„NaOHжә¶ж¶Іж»ҙе®ҡжңӘзҹҘжө“еәҰзҡ„зӣҗй…ёпјҢиӢҘжөӢе®ҡз»“жһңеҒҸдҪҺпјҢе…¶еҺҹеӣ еҸҜиғҪжҳҜ( гҖҖгҖҖ) AгҖҒй…ҚеҲ¶ж ҮеҮҶжә¶ж¶Ізҡ„еӣәдҪ“NaOHдёӯж··жңүжқӮиҙЁKOH BгҖҒзӣӣиЈ…жңӘзҹҘж¶Ізҡ„й”ҘеҪўз“¶з”Ёи’ёйҰҸж°ҙжҙ—иҝҮеҗҺеҶҚз”ЁжңӘзҹҘж¶Іж¶Ұжҙ— CгҖҒж»ҙе®ҡз»ҲзӮ№иҜ»ж•°ж—¶пјҢдҝҜи§Ҷж»ҙе®ҡз®Ўзҡ„еҲ»еәҰпјҢе…¶д»–ж“ҚдҪңжӯЈзЎ® DгҖҒж»ҙе®ҡеҲ°з»ҲзӮ№иҜ»ж•°ж—¶пјҢеҸ‘зҺ°ж»ҙе®ҡз®Ўе°–еҳҙеӨ„жӮ¬жҢӮдёҖж»ҙжә¶ж¶І
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
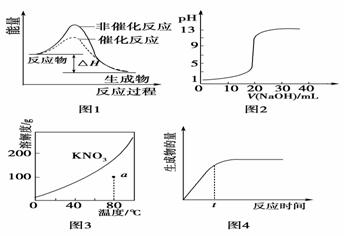
дёӢеҲ—еӣҫзӨәдёҺеҜ№еә”зҡ„еҸҷиҝ°зӣёз¬Ұзҡ„жҳҜ(гҖҖгҖҖ)оҖғ
A.еӣҫ1иЎЁзӨәжҹҗеҗёзғӯеҸҚеә”еҲҶеҲ«еңЁжңүгҖҒж— еӮ¬еҢ–еүӮзҡ„жғ…еҶөдёӢеҸҚеә”иҝҮзЁӢдёӯзҡ„иғҪйҮҸеҸҳеҢ–оҖғ B.еӣҫ2иЎЁзӨә0.1000 molВ·LпјҚ1NaOHжә¶ж¶Іж»ҙе®ҡ20.00 mL 0.1000 molВ·LпјҚ1CH3COOHжә¶ж¶ІжүҖеҫ—еҲ°зҡ„ж»ҙе®ҡжӣІзәҝоҖғ C.еӣҫ3иЎЁзӨәKNO3зҡ„жә¶и§ЈеәҰжӣІзәҝпјҢеӣҫдёӯaзӮ№жүҖзӨәзҡ„жә¶ж¶ІжҳҜ80в„ғж—¶KNO3зҡ„дёҚйҘұе’Ңжә¶ж¶ІоҖғ D.еӣҫ4иЎЁзӨәжҹҗеҸҜйҖҶеҸҚеә”з”ҹжҲҗзү©зҡ„йҮҸйҡҸеҸҚеә”ж—¶й—ҙеҸҳеҢ–зҡ„жӣІзәҝпјҢз”ұеӣҫзҹҘtж—¶еҸҚеә”зү©иҪ¬еҢ–зҺҮжңҖеӨ§
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
еңЁ25 в„ғж—¶пјҢеҜҶй—ӯе®№еҷЁдёӯXгҖҒYгҖҒZдёүз§Қж°”дҪ“зҡ„еҲқе§Ӣжө“еәҰе’Ңе№іиЎЎжө“еәҰеҰӮдёӢиЎЁпјҡоҖғ
дёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ(гҖҖгҖҖ)оҖғ A.еҸҚеә”иҫҫеҲ°е№іиЎЎж—¶пјҢXзҡ„иҪ¬еҢ–зҺҮдёә50пј…оҖғ B.еҸҚеә”еҸҜиЎЁзӨәдёәX+3Y C.еўһеӨ§еҺӢејәдҪҝе№іиЎЎеҗ‘з”ҹжҲҗZзҡ„ж–№еҗ‘移еҠЁпјҢе№іиЎЎеёёж•°еўһеӨ§оҖүоҖғ D. ж”№еҸҳжё©еәҰеҸҜд»Ҙж”№еҸҳжӯӨеҸҚеә”зҡ„е№іиЎЎеёёж•°оҖғ
|
|||||||||||||
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
еҜ№дәҺеҸҚеә”2NO2(g) A.е№іиЎЎйҖҶеҗ‘移еҠЁоҖғВ В В В В В В В В В В В B.ж··еҗҲж°”дҪ“йўңиүІжҜ”еҺҹжқҘж·ұоҖғ C.ж··еҗҲж°”дҪ“йўңиүІжҜ”еҺҹжқҘжө…оҖғВ В В В D.ж··еҗҲж°”дҪ“зҡ„е№іеқҮзӣёеҜ№еҲҶеӯҗиҙЁйҮҸеҸҳе°Ҹ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүдёӨдёӘжһҒжҳ“еҜјзғӯзҡ„еҜҶй—ӯе®№еҷЁaе’ҢbпјҲеҰӮеӣҫжүҖзӨәпјүпјҢaе®№еҷЁдҪ“з§ҜжҒ’е®ҡпјҢbе®№еҷЁдҪ“з§ҜеҸҜеҸҳпјҢеҺӢејәдёҚеҸҳгҖӮеңЁеҗҢжё©еҗҢеҺӢе’ҢзӯүдҪ“з§ҜжқЎд»¶дёӢпјҢеҗ‘aе’ҢbдёӨе®№еҷЁдёӯйҖҡе…Ҙзӯүзү©иҙЁзҡ„йҮҸзҡ„N
B.еҸҚеә”иҝҮзЁӢдёӯеҸҚеә”йҖҹзҺҮзҡ„е…ізі»пјҡva<vbоҖғ C.дёӨе®№еҷЁеҶ…еҸҚеә”иҫҫеҲ°е№іиЎЎжүҖйңҖж—¶й—ҙдёҖе®ҡзӣёеҗҢоҖғ D.еҸҚеә”иҫҫеҲ°е№іиЎЎпјҢдёӨе®№еҷЁдёӯзҡ„NO2зҡ„иҪ¬еҢ–зҺҮзӣёеҗҢ
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ёзү©иҙЁзҡ„йҮҸйғҪжҳҜ0.1 molзҡ„CH3COOHе’ҢCH3COONaй…ҚеҲ¶жҲҗ1 Lж··еҗҲжә¶ж¶ІпјҢе·ІзҹҘе…¶дёӯc(CH3COOпјҚ) > c(NaпјӢ)пјҢдёӢеҲ—еҜ№иҜҘж··еҗҲжә¶ж¶Ізҡ„еҲӨж–ӯжӯЈзЎ®зҡ„жҳҜВ В (гҖҖгҖҖ) AпјҺc(HпјӢ) < c(OHпјҚ) BпјҺc(CH3COOH)пјӢc(CH3COOпјҚ)пјқ0.2 molВ·LпјҚ1 CпјҺc(CH3COOH) > c(CH3COOпјҚ) DпјҺc(CH3COOпјҚ)пјӢc(OHпјҚ)пјқ0.2 molВ·LпјҚ1
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
Cu(OH)2еңЁж°ҙдёӯеӯҳеңЁзқҖеҰӮдёӢжІүж·Җжә¶и§Је№іиЎЎпјҡCu(OH)2(s) AгҖҒ2В В В В В В В BгҖҒ3В В В В В В В В В В CгҖҒ4В В В В В В В В В В В DгҖҒ5
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
иҚүй…ёжҳҜдәҢе…ғејұй…ёпјҢиҚүй…ёж°ўй’ҫжә¶ж¶Іе‘Ҳй…ёжҖ§гҖӮеңЁO.1molВ·LпјҚ1 KHC2O4жә¶ж¶ІдёӯпјҢдёӢеҲ—е…ізі»жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү В В В AпјҺc(K+)+c(H+) = c(HC2O4пјҚ)+c(OHпјҚ)+c(C2O42пјҚ)В В В BпјҺc(HC2O4пјҚ)+c(C2O42пјҚ) = 0.1 molВ·LпјҚ1 CпјҺc(C2O42пјҚ) < c(H2C2O4) DпјҺc(K+) = c(H2C2O4)+c(HC2O4пјҚ)+c(C2O42пјҚ)
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©дёӢ0.1 molВ·LпјҚ1жҹҗдёҖе…ғй…ёпјҲHAпјүжә¶ж¶Ідёӯ зЎ®зҡ„жҳҜпјҲВ В В пјү AпјҺиҜҘжә¶ж¶Ідёӯз”ұж°ҙз”өзҰ»еҮәзҡ„c(H+)пјқ1Г—10пјҚ11 molВ·LпјҚ1 BпјҺжө“еәҰеқҮдёә0.1mol/Lзҡ„HAе’ҢNaAжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲеҗҺпјҢиӢҘжә¶ж¶Іе‘Ҳй…ёжҖ§пјҢ еҲҷc(AвҖ”)пјһc(HA)пјһc(Na+)пјһc(H+)пјһc(OHвҖ”) CпјҺ0.1 molВ·LпјҚ1HAжә¶ж¶ІдёҺ0.05 molВ·LпјҚ1 NaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲеҗҺжүҖеҫ—жә¶ж¶Ідёӯ 2c(H+)+ c(HA) пјқ c(AвҖ”) + 2c(OHвҖ”) DпјҺ0.1 molВ·LпјҚ1HAжә¶ж¶ІдёҺ0.05 molВ·LпјҚ1 NaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲеҗҺжүҖеҫ—жә¶ж¶Ідёӯ c(AвҖ”) + c(HA) пјқ c(Na+)
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүеӣӣз§ҚдёҖе…ғй…ёHAгҖҒHBгҖҒHCгҖҒHDпјҢзӣёеҗҢзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„NaDе’ҢNaBжә¶ж¶Ізҡ„pHпјҢеүҚиҖ…жҜ”еҗҺиҖ…еӨ§пјҢNaAжә¶ж¶Іе‘ҲдёӯжҖ§пјҢ1mol/Lзҡ„KCжә¶ж¶ІйҒҮй…ҡй…һиҜ•ж¶Іе‘ҲзәўиүІпјӣ
|
|
| 26. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||
|
е·ІзҹҘ25в„ғгҖҒ101kPaж—¶пјҢдёҖдәӣзү©иҙЁзҡ„зҮғзғ§зғӯдёәпјҡоҖғ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡоҖғ пјҲ1пјүж №жҚ®зӣ–ж–Ҝе®ҡеҫӢе®ҢжҲҗдёӢеҲ—еҸҚеә”зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸпјҡоҖғ CO(g)+2H2(g)==CH3OH(l)В О”H=В В В В В В В В В В В В В В В В В В В В В В гҖӮоҖғ пјҲ2пјүзҺ°жңүH2е’ҢCH4зҡ„ж··еҗҲж°”дҪ“112 LпјҲж ҮеҮҶзҠ¶еҶөпјүпјҢдҪҝе…¶е®Ңе…ЁзҮғзғ§з”ҹжҲҗCO2(g)е’ҢH2O(l)пјҢе…ұж”ҫеҮәзғӯйҮҸ3 242.5 kJпјҢеҲҷеҺҹж··еҗҲж°”дҪ“дёӯH2е’ҢCH4зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”жҳҜпјҡВ В В В В В В В В В В гҖӮоҖғ A.1:1В В В В В В В В В В B.1:3оҖғВ В В В В В В В В В C.1:4В В В В В В В В В В В D.2:3
|
|||||||||||
| 27. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁжҹҗжё©еәҰдёӢпјҢе°Ҷ В (1)еҸҚеә”еңЁиҫҫеҲ°е№іиЎЎиҝҮзЁӢдёӯпјҢ В (2)еҸҚеә”зҡ„е№іиЎЎеёёж•°зҡ„иЎЁиҫҫејҸжҳҜ В (3)жӯӨжё©еәҰдёӢпјҢе№іиЎЎеёёж•°еҖјдёәВ В В В В В В В В В В В В В В В В пјӣ В (4)иӢҘеңЁжӯӨжё©еәҰдёӢпјҢеңЁ10Lзҡ„еҜҶй—ӯеҷЁе……е…Ҙ0.2molHIж°”дҪ“пјҢиҫҫеҲ°е№іиЎЎж—¶пјҢHIзҡ„иҪ¬еҢ–зҺҮдёәВ В В В В В В гҖӮ
|
|
| 28. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘеҸҜйҖҶеҸҚеә”CO(g)+H2O(g) пјҲ1пјү830Kж—¶пјҢиӢҘиө·е§Ӣж—¶cпјҲCOпјү=2 molВ·L-1пјҢоҖҲcпјҲH2Oпјү=3 molВ·L-1пјҢе№іиЎЎж—¶COзҡ„иҪ¬еҢ–зҺҮдёә60%пјҢж°ҙи’ёж°”зҡ„иҪ¬еҢ–зҺҮдёәВ В В В В В В В В В В пјӣKеҖјдёәВ В В В В В В В В В В В гҖӮ пјҲ2пјү830 Kж—¶пјҢиӢҘеҸӘе°Ҷиө·е§Ӣж—¶cпјҲH2Oпјүж”№дёә6 molВ·L-1пјҢеҲҷж°ҙи’ёж°”зҡ„иҪ¬еҢ–зҺҮдёәВ В В В В В В гҖӮ пјҲ3пјүиӢҘ830 Kж—¶пјҢиө·е§Ӣжө“еәҰcпјҲCOпјү=a molВ·L-1пјҢ cпјҲH2Oпјү=b molВ·L-1пјҢH2зҡ„е№іиЎЎжө“еәҰcпјҲH2пјү=c molВ·L-1оҖүоҖүоҖғ в‘ aгҖҒbгҖҒcд№Ӣй—ҙзҡ„е…ізі»ејҸжҳҜВ В В В В В В В В В В В пјӣв‘ЎеҪ“a=bж—¶пјҢa=В В В В В В В В В В cгҖӮ
|
|
| 29. | иҜҰз»ҶдҝЎжҒҜ | ||||
|
еӣӣз§Қжҳ“жә¶дәҺж°ҙзҡ„ејәз”өи§ЈиҙЁAгҖҒBгҖҒCгҖҒDз”ұд»ҘдёӢ7з§ҚзҰ»еӯҗз»„жҲҗпјҲз”өи§ЈиҙЁдёӯйҳҙзҰ»еӯҗеҗ„дёҚзӣёеҗҢпјүгҖӮ
В е·ІзҹҘпјҡв‘ AгҖҒCжә¶ж¶ІжҳҫзўұжҖ§пјҢAгҖҒBзҡ„жә¶ж¶Ідёӯж°ҙзҡ„з”өзҰ»зЁӢеәҰзӣёеҗҢпјӣв‘ЎCе’ҢDзҡ„жә¶ж¶Іж··еҗҲеҸҚеә”зҡ„зҺ°иұЎеҸӘжҳҜжңүзҷҪиүІжІүж·Җз”ҹжҲҗпјҢBе’ҢCзҡ„жә¶ж¶Іж··еҗҲеҸҚеә”зҡ„зҺ°иұЎеҸӘжҳҜжңүеҲәжҝҖжҖ§ж°”е‘ізҡ„ж°”дҪ“з”ҹжҲҗпјҢAе’ҢDзҡ„жә¶ж¶Іж··еҗҲж— жҳҺжҳҫзҺ°иұЎгҖӮ пјҲ1пјүAжҳҜ___В В В В В _пјҢBжҳҜ__В В В В В В В В __гҖӮ В пјҲ2пјүеҶҷеҮәCдёҺDзҡ„жә¶ж¶ІеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ_____В В В В В В В В В В В В В В ___гҖӮ В пјҲ3пјү25в„ғж—¶пјҢ0.1mol/LBжә¶ж¶Ізҡ„pHпјқaпјҢеҲҷBжә¶ж¶Ідёӯc(H+)вҖ”c(NH3В·H2O)пјқВ В В В В В В В В В В В В В пјҲз”Ёеҗ«жңүaзҡ„е…ізі»ејҸиЎЁзӨәпјүгҖӮ В пјҲ4пјүе°ҶзӯүдҪ“з§ҜгҖҒзӯүзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„Bжә¶ж¶Іе’ҢCжә¶ж¶Іж··еҗҲеҸҚеә”еҗҺжә¶ж¶Ідёӯеҗ„з§ҚзҰ»еӯҗжө“еәҰз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜВ В В В В В В В В В В В В В В В В В ___гҖӮ В В пјҲ5пјүеҗ‘з”Ёзӣҗй…ёдёӯе’ҢеҗҺзҡ„Cжә¶ж¶ІдёӯеҠ е…ҘAgNO3е’ҢKBrпјҢеҪ“дёӨз§ҚжІүж·Җе…ұеӯҳж—¶пјҢ c(BrвҖ”)/c(ClвҖ”) пјқ_________гҖӮпјҲе·ІзҹҘKsp(AgCl) пјқ2.0Г—10пјҚ10пјҢKsp(AgBr) пјқ5.4Г—10пјҚ13пјү
|
|||||
| 30. | иҜҰз»ҶдҝЎжҒҜ |
|
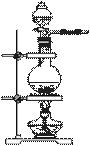
е®һйӘҢе®Өеёёз”ЁMnO2дёҺжө“зӣҗй…ёеҸҚеә”еҲ¶еӨҮCl2(еҸ‘з”ҹиЈ…зҪ®еҰӮеӣҫжүҖзӨә)гҖӮ пјҲ1пјүеҲ¶еӨҮе®һйӘҢејҖе§Ӣж—¶пјҢе…ҲжЈҖжҹҘиЈ…зҪ®ж°”еҜҶжҖ§пјҢжҺҘдёӢжқҘзҡ„ж“ҚдҪңдҫқж¬ЎжҳҜ______________(еЎ«еәҸеҸ·)гҖӮ
CпјҺеҫҖзғ§з“¶дёӯеҠ е…Ҙжө“зӣҗй…ё пјҲ2пјүеҲ¶еӨҮеҸҚеә”дјҡеӣ зӣҗй…ёжө“еәҰдёӢйҷҚиҖҢеҒңжӯўгҖӮдёәжөӢе®ҡеҸҚеә”ж®ӢдҪҷж¶Ідёӯзӣҗй…ёзҡ„жө“еәҰпјҢжҺўз©¶е°Ҹз»„еҗҢеӯҰжҸҗеҮәдёӢеҲ—е®һйӘҢж–№жЎҲпјҡ з”Іж–№жЎҲпјҡдёҺи¶ійҮҸAgNO3жә¶ж¶ІеҸҚеә”пјҢз§°йҮҸз”ҹжҲҗзҡ„AgClиҙЁйҮҸгҖӮ д№ҷж–№жЎҲпјҡйҮҮз”Ёй…ёзўұдёӯе’Ңж»ҙе®ҡжі•жөӢе®ҡгҖӮ дёҷж–№жЎҲпјҡдёҺе·ІзҹҘйҮҸCaCO3 дёҒж–№жЎҲпјҡдёҺи¶ійҮҸZnеҸҚеә”пјҢжөӢйҮҸз”ҹжҲҗзҡ„H2дҪ“з§ҜгҖӮ 继иҖҢиҝӣиЎҢдёӢеҲ—еҲӨж–ӯе’Ңе®һйӘҢпјҡ в‘ еҲӨе®ҡз”Іж–№жЎҲдёҚеҸҜиЎҢпјҢзҗҶз”ұжҳҜ________________________________________гҖӮ в‘ЎиҝӣиЎҢд№ҷж–№жЎҲе®һйӘҢпјҡеҮҶзЎ®йҮҸеҸ–ж®ӢдҪҷжё…ж¶ІзЁҖйҮҠдёҖе®ҡеҖҚж•°еҗҺдҪңдёәиҜ•ж ·гҖӮ
bпјҺе№іиЎҢж»ҙе®ҡеҗҺиҺ·еҫ—е®һйӘҢз»“жһңгҖӮ в‘ўеҲӨж–ӯдёҷж–№жЎҲзҡ„е®һйӘҢз»“жһң________(еЎ«вҖңеҒҸеӨ§вҖқгҖҒвҖңеҒҸе°ҸвҖқжҲ–вҖңеҮҶзЎ®вҖқ)гҖӮ [е·ІзҹҘпјҡKsp(CaCO3)пјқ2.8Г—10пјҚ9гҖҒKsp(MnCO3)пјқ2.3Г— 10пјҚ11] в‘ЈиҝӣиЎҢдёҒж–№жЎҲе®һйӘҢпјҡиЈ…зҪ®еҰӮеӣҫжүҖзӨә(еӨ№жҢҒеҷЁе…·е·Із•ҘеҺ»)гҖӮ (в…°)дҪҝYеҪўз®Ўдёӯзҡ„ж®ӢдҪҷжё…ж¶ІдёҺй”ҢзІ’еҸҚеә”зҡ„жӯЈзЎ®ж“ҚдҪңжҳҜе°Ҷ_______иҪ¬з§»еҲ°______дёӯгҖӮ (в…ұ)еҸҚеә”е®ҢжҜ•пјҢжҜҸй—ҙйҡ”1еҲҶй’ҹиҜ»еҸ–ж°”дҪ“дҪ“з§ҜпјҢж°”дҪ“дҪ“з§ҜйҖҗж¬ЎеҮҸе°ҸпјҢзӣҙиҮідёҚеҸҳгҖӮж°”дҪ“дҪ“з§ҜйҖҗж¬ЎеҮҸе°Ҹзҡ„еҺҹеӣ жҳҜ__________________________ (жҺ’йҷӨд»ӘеҷЁе’Ңе®һйӘҢж“ҚдҪңзҡ„еҪұе“Қеӣ зҙ )гҖӮ
|
|
- дёҠи”ЎеҺҝ第дәҢй«ҳзә§дёӯеӯҰй«ҳдәҢеҢ–еӯҰ2018е№ҙдёҠеҚҠе№ҙжңҹдёӯиҖғиҜ•иҜ•еҚ·еёҰи§ЈжһҗеҸҠзӯ”жЎҲ
- 2020еұҠй«ҳдёүеҢ–еӯҰдәҢиҪ®жҜҸе‘ЁеӨ§йўҳеҝ…з»ғ - -- ж— жңәе·ҘдёҡжөҒзЁӢйўҳ
- еҗүжһ—2019е№ҙй«ҳдёҖеҢ–еӯҰдёӢжңҹжңҲиҖғжөӢйӘҢзҪ‘дёҠеңЁзәҝеҒҡйўҳ
- йӮөйҳіеёӮй«ҳдёҖеҢ–еӯҰ2019е№ҙдёӢеҚҠе№ҙжңҲиҖғжөӢйӘҢеҗҢжӯҘз»ғд№
- жІіеҚ—2019е№ҙй«ҳдёҖеҢ–еӯҰдёҠеҚҠе№ҙжңҲиҖғжөӢйӘҢиҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- еҢ—дә¬еёӮй«ҳдёүеҢ–еӯҰ2020е№ҙдёҠеҚҠжңҹжңҲиҖғжөӢйӘҢйҷ„зӯ”жЎҲдёҺи§Јжһҗ
- е®үеҫҪ2019е№ҙй«ҳдәҢеҢ–еӯҰдёҠеҚҠжңҹжңҲиҖғжөӢйӘҢе®Ңж•ҙиҜ•еҚ·
- 2018иҮі2019е№ҙй«ҳдёҖдёӢеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲзҰҸе»әзңҒжіүе·һеёӮж°ёжҳҘеҺҝ第дёҖдёӯеӯҰпјү