上蔡县第二高级中学高二化学2018年上半年期中考试试卷带解析及答案
| 1. 选择题 | 详细信息 |
|
京津冀地区的 大气污染问题已成影响华北环境的重要因素,有人想利用下列反应:2CO(g)+SO2(g) A. 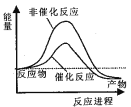 B. B. 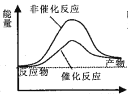 C. C.  D. D.  D D |
|
| 2. 选择题 | 详细信息 |
|
1.0 mol.L-1 的氨水中存在下列平衡:NH3·H2O A. 适当升高温度 B. 加入NaOH固体 C. 通入NH3 D. 加入NH4Cl固体 |
|
| 3. 选择题 | 详细信息 |
|
以下事实不能用勒夏特利原理来解释的是: ( ) A. 用排饱和食盐水的方法收集氯气 B. 增大压强,有利于N2和H2反应生成NH3 C. 合成氨工业选择高温(合成氨反应为放热反应) D. 在Fe3++3SCN - |
|
| 4. 选择题 | 详细信息 |
|
下列说法正确的是 ( ) A. 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 B. NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) △H=+185.57 kJ·mol-1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 C. 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 D. 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
|
| 5. 选择题 | 详细信息 |
|
反应 H2(g) + I2(g) A. K1=2K2 B. K1=K22 C. K1= |
|
| 6. 选择题 | 详细信息 |
|
一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g) ①容器中气体的密度不再发生变化 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成2n mol Z,同时消耗2n mol Y A. ①② B. ②③ C. ③④ D. ①④ |
|
| 7. 选择题 | 详细信息 |
|
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e-+ H2O = CH3COOH + 4H+。下列有关说法正确的是 A. 检测时,电解质溶液中的H+向负极移动 B. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 C. 电池反应的化学方程式为:CH3CH2OH + O2= CH3COOH + H2O D. 正极上发生的反应为:O2+ 4e-+ 2H2O = 4OH- |
|
| 8. 选择题 | 详细信息 |
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+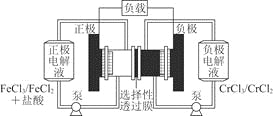 A.充电时,阴极的电极反应式为Cr3++e-=Cr2+ B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ C.电池放电时,Cl-从负极室穿过选择性透过膜移向正极室 D.放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1 mol·L-1 |
|
| 9. 选择题 | 详细信息 |
|
将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性;①1×10-3mol·L-1的氨水b L;②c(OH-)=1×10-3mol·L-1的氨水c L;③c(OH-)=1×10-3mol·L-1Ba(OH)2的溶液d L;则a、b、c、d的关系正确的是 A. b>a=d>c B. a=b>c>d C. a=b>d>c D. c>a=d>b |
|
| 10. 选择题 | 详细信息 |
|
A、B的混合气体在密闭容器中发生如下反应:xA(g)+yB(g) A. x+y<z B. 平衡向正反应方向移动了 C. B的转化率下降 D. C的体积分数减小 |
|
| 11. 选择题 | 详细信息 |
|
将1 mol SO2和1 mol O2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2SO2(g)+O2(g) A. 等于0.3 mol B. 等于0.15 mol C. 小于0.15 mol D. 大于0.15 mol,小于0.3 mol |
|
| 12. 选择题 | 详细信息 |
|
已知:HCN(aq)+ NaOH(aq) ==NaCN(aq)+H2O(l) ΔH=-12.1 kJ·mol-1; HCl(aq)+NaOH(aq) ==NaCl (aq)+H2O(l) ΔH=-55.6 kJ·mol-1 则HCN在水溶液中电离的ΔH等于 A.+43.5 kJ·mol-1 B .+67.7 kJ·mol-1 C.-43.5 kJ·mol-1 D.-67.7 kJ·mol-1 |
|
| 13. 选择题 | 详细信息 |
|
某无色透明溶液含有下列离子中的几种: Mg2+、 Cu2+、 Ba2+、 H+、 SO42-、OH-、 NO3-、 HCO3-,在其中加入金属铁,发生反应放出气体只有H2, 试 判断上述离子中 一定不能 大量存在于此溶液中的有 A. 2种 B. 5种 C. 4种 D. 6种 |
|
| 14. 选择题 | 详细信息 | ||||||||
部分弱酸的电离平衡常数如下表:
|
|||||||||
| 15. 选择题 | 详细信息 |
|
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42× 10-11。下列说法正确的是( ) A. 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 B. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 C. 25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01mol/L NH4Cl溶液中的Ksp小 D. 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后, Mg(OH)2不可能转化为MgF2 |
|
| 16. 填空题 | 详细信息 |
|
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。 (1)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量CuSO4溶液可加快氢气 的生成速率。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。 请分析氢气生成速率下降的主要原因___________________________。 (2)用甲烷制取氢气的两步反应的能量变化如下图所示,则甲烷和水蒸气反 应生成二 氧化碳和氢气的热化学方程式是___________________________。  (3)科学家最近研究出一种环保,安全的储氢方法,其原理可表示为:NaHCO3 A.储氢、释氢过程均无能量变化 B.NaHCO3、HCOONa均具有离子键和共价键 C.储氢过程中,NaHCO3被氧化 D.释氢过程中,每消耗0.1 mol H2O放出2.24 L的H2 (4)Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2 和仅含一种 金属元素的氢化物(该氢化物中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为______________。 |
|
| 17. 填空题 | 详细信息 |
|
常温下,某溶液M中存在的离子有Na+、A2、HA、H+、OH,存在的分子有 H2O、H2A。根据题意回答下列问题: (1)写出酸H2A的电离方程式:_____________________________________; (2)若溶液M是由10 mL 2 mol/L NaHA溶液与2 mol/L NaOH溶液等体积混合而得到 的,则溶液M的pH__________7(填“>”、“<”或“=”),溶液中离子浓度由大到小的顺序为_____________________________。已知Ksp(BaA)= 1.8×1010,向该混合溶液中加入10 mL 1 mol/L BaCl2溶液,混合后溶液中Ba2+ 浓度为________________mol/L。 |
|
| 18. 填空题 | 详细信息 |
|
氨气是重要的化工原料 (1)已知:N2(g)+O2(g)= 2NO(g) △H= +180.5kJ·mol-1 4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H= - 905kJ·mol-1 2H2(g)+O2(g)= H2O(g) △H= - 483.6kJ·mol-1 写出氨气在高温高压催化剂条件下生成氮气和氢气的热化学方程式:_____________________, (2)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:______________________,科学家利用此原理,设计成氨气和氧气燃料电池, 则通入氨气的电极是_________ (填“正极”或“负极”);碱 性条件下,该电极发生反应的电极反应式为_______________________。 (3)一定条件下,某密闭容器中发生反应 4NH3(g)+5O2(g) a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂 (4)如果某氨水的电离程度为1%,浓度为0.01 mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),溶液中的NH3·H2O的浓度为_______{已知Ksp[Mg(OH)2]=4.0×10-12]} |
|
| 19. 填空题 | 详细信息 | |||||||
|
运用相关原理,回答下列各小题: (1)25℃时,某FeCl3溶液的pH=2,则此溶液中由水电离产生的c(OH-)=___________;用离子方程式表示FeCl3溶液用于净水的原因:______________________。 (2)已知NaHSO4在水中的电离方程式 NaHSO4 = Na++H++SO42-。在NaHSO4溶液中c(H+)______c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢 钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH______7 (3)分析下表提供的数据:
|
||||||||
| 20. 填空题 | 详细信息 | ||||||||
|
一氧化碳与氢气可以合成甲醇,反应为CO(g)+2H2(g) (1)某温度下,将2 mol CO和6 mol H2充人2 L的密闭容器中,充分反应达到平衡, 测 得c(H2) =2.2 mol·L-1,则CO的转化率为___________。 (2)T1℃时,此反应的平衡常数为K(T1)=50。此温度下,在一个2 L的密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
|
|||||||||




