高二上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列说法正确的是( ) A、焓变是指1mol物质参加反应时的能量变化 B、当反应放热时△H>0,当反应吸热时△H<0 C、在加热条件下发生的反应均为吸热反应 D、一个化学反应中,当反应物的能量大于生成物的能量时,反应热△H为负值
|
|
| 2. | 详细信息 |
|
下列热化学方程式中△H代表燃烧热的是( ) A、CH4(g)+3/2O2(g)=2H2O(g)+CO(g) △H1 B、S(s)+3/2O2(g)=SO3(s) △H2 C、C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H3 D、2CO(g)+O2(g)=2CO2(g) △H4
|
|
| 3. | 详细信息 |
|
关于溶液酸碱性的说法正确的是( ) A、c(H+)很小的溶液一定是中性 B、pH=7的溶液一定呈中性 C、c(H+)=c(OH-)溶液一定呈中性 D、不能使酚酞试液变红的溶液一定呈酸性
|
|
| 4. | 详细信息 |
|
在一个活塞式的反应容器中,通入2 mol SO2和1 mol O2,于500 ℃下发生化合反应并达到平衡,在保持恒温、恒压的条件下,再通入2 mol SO2和1 mol O2,下列叙述的内容完全正确的是( ) A.v(正)增大,v(逆)减小,平衡向正反应方向移动,SO3的百分含量增加 B.v(正)增大,v(逆)不变,平衡向正反应方向移动,SO3的百分含量增加 C.v(正)增大,v(逆)增大,平衡向正反应方向移动,SO3的百分含量增加 D.开始时v(正)增大,v(逆)减小,平衡向正反应方向移动;随后又逐渐恢复到原反应速率,SO3的百分含量保持不变
|
|
| 5. | 详细信息 |
|
下列电离方程式中,正确的是( ) A、CH3COOH = CH3COO- + H+ B、NaOH = Na+ + OH- C、KClO3
|
|
| 6. | 详细信息 |
|
下列说法不正确的是 ( ) A、体系有序性越高,熵值就越低 B、自发过程将导致体系的熵增大 C、吸热反应一定不可以自发进行 D、同种物质气态时熵值最大
|
|
| 7. | 详细信息 |
|
下列各方程式中,属于水解反应的是 A. C.
|
|
| 8. | 详细信息 |
|
下列事实一定能说明HF是弱酸的是 ①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗; ③HF与NaCl不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3 ⑤HF能与Na2CO3溶液反应,产生CO2气体⑥HF与水能以任意比混溶 ⑦1mol/L的HF水溶液能使紫色石蕊试液变红 A.①②⑦ B.②③⑤ C.③④⑥ D.①④
|
|
| 9. | 详细信息 |
|
某化学反应其△H= —122 kJ·mol-1,∆S=+231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行( ) A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行 C.仅在高温下自发进行 D.仅在低温下自发进行
|
|
| 10. | 详细信息 |
|
将pH=2盐酸和pH=11的氢氧化钠,以体积比1:9混合后,溶液的pH是 ( ) A、 3 B、 4 C、 9 D、 10
|
|
| 11. | 详细信息 |
|
某温度下,体积一定的密闭容器中进行如下可逆反应: X(g)+Y(g) A.加入少量W,逆反应速率增大 B.升高温度,平衡逆向移动 C.当容器中气体压强不变时,反应达到平衡 D.平衡后加入X,上述反应的ΔH增大
|
|
| 12. | 详细信息 |
|
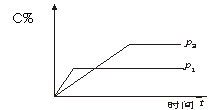
下图为可逆反应A(g)+2B(g)
B、 p2>p1 ,n>3 C、 p1>p2 ,n<3 D、 p1>p2 ,n>3
|
|
| 13. | 详细信息 |
|
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) A.2.5mol C B.2 mol A、1 mol B和10 mol He(不参加反应) C.1.5 mol B和1.5 mol C D.2 mol A、3 mol B和3 mol C
|
|
| 14. | 详细信息 |
|
体积相同的盐酸和醋酸两种溶液中c(C1-)=c(CH3COO-),则下列说法中正确的是 A. 两种溶液中的粒子种数一样多 B. 醋酸溶液的pH大于盐酸的pH C.两种溶液分别与足量锌粉反应,醋酸产生的H2多 D.两种溶液分别稀释10倍后,c(C1-)=c(CH3COO-)
|
|
| 15. | 详细信息 |
|
.25℃时,在浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2,三种溶液,若测得其中[NH4+]分别为a、b、c(单位:mol/L),则下列判断正确的是 A.a=b=c B.c>a>b C.b>a>c D.a>c>b
|
|
| 16. | 详细信息 |
|
对反应4A+5B == 4C+6D,以下化学反应速率的表示中,所表示反应速率最快的是( ) A. v (A)=0.40mol•L-1•s-1 B. v (B)=0.48mol•L-1•s-1 C. v (C)=0.36mol•L-1•s-1 D.v(D)=0.55mol•L-1•s-1
|
|
| 17. | 详细信息 |
|
(1)已知: C2H6O(g) + 3O2(g) == 2CO2(g) + 3H2O(g) △H1 H2O(g)==H2O(l) △H2 C2H6O(g)==C2H6O(l) △H3 若使1mol C2H6O(l)完全燃烧生成液态水,则放出的热量为 (用符号表示) (2)对于可逆反应CO(g)+H2O (g) ①恒温恒压时,向容器中充入0.5mol的He,这时反应速率 (填“加快”、“减慢”或 “不变”),原因是 。 ②恒温恒容时,加入0.3mol的CO,这时反应速率 (填“加快”、“减慢”或 “不变”),原因是 。
|
|
| 18. | 详细信息 |
|
(1)25℃,101kPa时,14gCO在足量的O2中充分燃烧,放出141.3 kJ的热,则CO的燃烧热为 ,其燃烧的热化学方程式是 ; (2) 0.50L 2.00mol/L H2SO4溶液与2.00L 1.00mol/L KOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为 ,表示其中和热的热化学方程式为 。 (3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是 。
|
|
| 19. | 详细信息 |
|
(1)25℃时, 0.05mol/LH2SO4溶液的PH = _____, 0.01mol/L NaOH溶液的PH = _______; (2)某温度下纯水中的C(H+)= 2×10-7 mol/L,则此时溶液中的C(OH-)= ;若温度不变,滴入稀盐酸,使C(H+)= 5×10-4 mol/L,则此时溶液中由水电离产生的C(H+)= 。 (3)判断下列物质能导电的是_______________,属于强电解质的是______________,属于弱电解质的是______________,属于非电解质的是______________。 a.铜丝 b.NaCl c.冰醋酸 d.HCl的水溶液 e.蔗糖 f.CO2 g. BaSO4 h.Fe(OH)3
|
|
| 20. | 详细信息 |
|
化学平衡原理在工农业生产中发挥着重要的指导作用。 (1)反应C(s)+CO2(g) 已知C(s) + H2O(g) H2(g)+CO2(g) (2)已知某温度下,反应2SO2+O2 在该温度下的体积固定的密闭容器中,c0(SO2)=1mol·L-1,c0(O2)=1 mol·L-1,当反应在该温度下SO2转化率为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向 (填“正反应”或“逆反应”) 方向进行。 (3)对于可逆反应:aA(g) +bB(g) 若a+b>c+d,增大压强平衡向_______(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a_______0(填“>”或“<”)
|
|
| 21. | 详细信息 | |||||||||
|
用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000mol·L -1的氢氧化钠溶液(指示剂为酚酞)滴定得结果如下:
(1)达到滴定终点的时溶液颜色的变化为 色到 色; (2)根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1; (3)以下操作造成测定结果偏高的原因可能是 和 。 A、 滴定终点读数时,俯视滴定管的刻度,其它操作均正确 B、 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 C、 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 D、 未用标准液润洗碱式滴定管
|
||||||||||
| 22. | 详细信息 |
|
在一定条件下的密闭容器中进行的如下反应:2SO2(g)+O2(g)
|
|