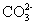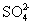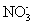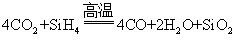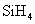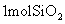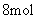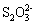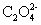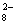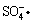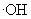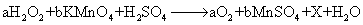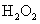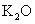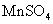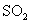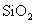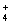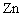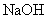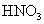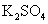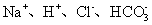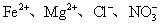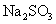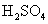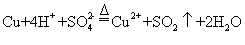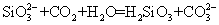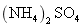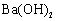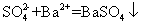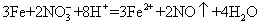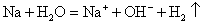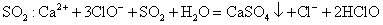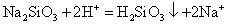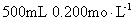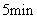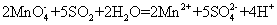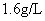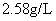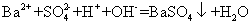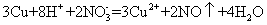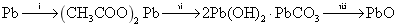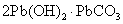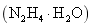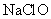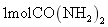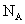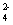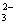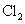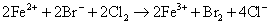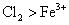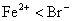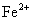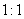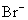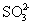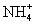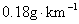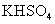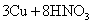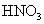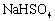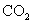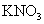2021-2022学年高中化学第一单元练习题含解析
| 1. | 详细信息 |
|
下列离子方程式正确的是 A .稀硝酸溶液与氢氧化钠溶液反应: H + +OH - =H 2 O B .碳酸钙与盐酸反应: C .稀硫酸与锌反应: H 2 SO 4 +Zn=Zn 2+ + D .稀硫酸与氢氧化钡溶液混合产生沉淀: Ba 2+ + |
|
| 2. | 详细信息 |
|
在某无色溶液中,下列离子能大量共存的是 A . OH - 、 Cl - 、 Cu 2+ B . Cl - 、 C . |
|
| 3. | 详细信息 |
|
当光束通过下列分散系时,会出现丁达尔效应的是 A .澄清石灰水 B . Fe(OH) 3 胶体 C . CH 3 COOH 溶液 D . NaOH 溶液 |
|
| 4. | 详细信息 |
|
关于反应 A . CO 是氧化产物 B .氧化剂与还原剂的物质的量之比为 C . |
|
| 5. | 详细信息 |
|
下列实验所涉及反应的离子方程式错误的是 A .向 Na 2 S 2 O 3 溶液中滴加稀硫酸: B .向海带灰浸出液中滴加几滴硫酸酸化的过氧化氢溶液: 2I - +H 2 O 2 +2H + =I 2 +2H 2 O C .向硫酸铜溶液中加入过量的 NaHS 溶液: Cu 2+ +2HS - =CuS↓+H 2 S↑ D .用酸性高锰酸钾标准溶液滴定草酸: 2 |
|
| 6. | 详细信息 |
|
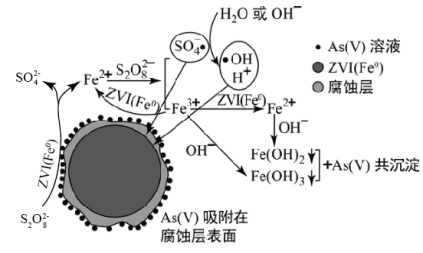
《环境科学》刊发了我国科研部门采用零价铁活化过二硫酸钠 (Na 2 S 2 O 8 ) 去除废水中的正五价砷 [As(V)] 的研究成果,其反应机制模型如图所示。下列叙述不正确的是 A . 56gFe 参加反应,消耗的 S 2 O B .过二硫酸钠 (Na 2 S 2 O 8 ) 中 S 的化合价为 +6 C . pH 越大,越有利于去除废水中的正五价砷 D .碱性条件下,硫酸根自由基发生反应的方程式为: |
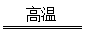
|
| 7. | 详细信息 |
|
“84” 消毒液 ( 有效成分为 NaClO) 、洁厕液 ( 主要成分为 HCl) 是生活中常见的消毒剂、清洁用品,二者混合使用会产生毒气 (Cl 2 ) 。从氧化还原的角度推测,下列关于 Cl 2 性质的猜想正确的是 A .只有氧化性 B .只有还原性 C .既有氧化性又有还原性 D .无法判断 |
|
| 8. | 详细信息 |
|
根据物质的组成对物质进行分类,下列物质属于盐类的是 A . CO 2 B . Li 2 O C . Na 2 CO 3 D . Ba(OH) 2 |
|
| 9. | 详细信息 |
|
已知反应 A . |
|
| 10. | 详细信息 |
|
下列变化中涉及氧化还原反应的是 A .将玉石 “ 变 ” 成印章 B . C .铁被浓硫酸钝化 D .用 |
|
| 11. | 详细信息 |
|
氯化硫 (S 2 C1 2 ) 的结构式为 Cl- S- S- Cl , 常温下为浅黄色油状液体,遇与水即分解: 2S 2 Cl 2 +2H 2 O→4HCl+SO 2 ↑+3S↓ 。下列有关此反应的说法正确的是 A . S 2 C1 2 做氧化剂, H 2 O 做还原剂。 B .每生成 1molSO 2 转移 4mol 电子 C .氧化产物与还原产物的物质的量之比为 3 : 1 D .每生成 48g 硫会断裂 2mol 氢氧键 |
|
| 12. | 详细信息 |
|
下列各组离子在溶液中能大量共存的是 A . Na + 、 NH C . Na + 、 NH |
|
| 13. | 详细信息 |
|
下列反应中, H 2 O 做氧化剂的是 A . SO 3 +H 2 O=H 2 SO 4 B . 3NO 2 +H 2 O=2HNO 3 +NO C . Cl 2 +H 2 O |
|
| 14. | 详细信息 |
|
下列物质中,属于电解质的是 A . |
|
| 15. | 详细信息 |
|
在下列溶液中一定能大量共存的离子组是 A .在某溶液中: B .在强酸性溶液中: C .含有大量 D .滴入酚酞变红的溶液中: |
|
| 16. | 详细信息 |
|
下列化合物中,属于氧化物的是 A . |
|
| 17. | 详细信息 |
|
下列离子方程式书写正确的是 A .铜与浓硫酸在加热条件下反应: B .水玻璃中通入过量二氧化碳气体: C . D .过量铁粉与稀硝酸反应: |
|
| 18. | 详细信息 |
|
下列离子方程式书写正确的是 A .少量金属钠投入冷水中: B .向次氯酸钙溶液中通入少量 C .向 D .向 |
|
| 19. | 详细信息 |
|
为测定空气中 A . |
|
| 20. | 详细信息 |
|
下列离子方程式正确的是 A .向硫酸溶液中加入 B .氢氧化钡溶液与稀硫酸反应: C .钠与水反应: D . |
|
| 21. | 详细信息 | ||||||||||||||||||||||||||||||
|
下列物质分类的正确组合是
A . A B . B C . C D . D |
|||||||||||||||||||||||||||||||
| 22. | 详细信息 |
|
某工业废水中存在大量的 Na + 、 Cl - 、 Cu 2+ 、 SO 下列有关说法错误的是 A . NaOH 的作用是除去 Cu 2+ B .试剂 a 为 Na 2 CO 3 ,试剂 b 为 BaCl 2 C .操作 x 为过滤,试剂 c 为稀盐酸 D .检验 SO |
|
| 23. | 详细信息 |
|
2021 年 10 月 16 日凌晨, “ 神舟十三号 ” 将翟志刚、王亚平、叶光富三名宇航员送到空间站,这是中国航天事业的巨大成功。下列说法错误的是 A .宇航员喜欢吃的 “ 宫保鸡丁 ” 主要成分是有机物 B .空间站广泛使用的钛合金,属于金属材料 C .飞船返回舱外面是一层耐高温的氮化硅陶瓷,属于新型无机非金属材料 D .中国空间站的太阳能电池板主要材料是 SiO 2 |
|
| 24. | 详细信息 |
|
我国明代《余东录》记载 “ 铅块悬酒缸内,封闭四十九日,开之则化为粉矣。化不白者,炒为黄丹。 ” 涉及物质转化如下: A .铅块属于金属材料 B . C .反应 ⅰ 中 |
|
| 25. | 详细信息 |
|
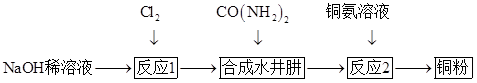
水合肼 下列说法错误的是 A .上述三步反应过程均为氧化还原反应 B .反应 1 的目的是制备 C .合成水合肼的反应中每消耗 D .反应 2 完成后要用到过滤操作 |
|
| 26. | 详细信息 |
|
为了测定铁铜合金的组成,将 7.6g 铁、铜合金加入 100mL 某浓度的稀硝酸中,将合金完全溶解后,共收集到 NO 气体 2.24L( 标准状况下 ) ,并测得溶液中 H + 的浓度为 0.5mol•L -1 ,若反应前后溶液的体积变化忽略不计,则下列判断不正确的是 A .上述反应中金属共失去电子 0.3mol B .合金中,铜的质量为 4.8g C .原硝酸的浓度: c(HNO 3 )=3mol•L -1 D .要使溶液中的金属离子完全沉淀,需加 5mol•L -1 的 NaOH 溶液 70mL |
|
| 27. | 详细信息 |
|
除去粗盐中的杂质 CaCl 2 、 MgCl 2 和 Na 2 SO 4 ,过程如下: 下列有关说法不正确的是 A .除去 Mg 2 + 的主要反应: MgCl 2 + 2NaOH=Mg(OH) 2 ↓ + 2NaCl B .试剂 ① 一定不是 Na 2 CO 3 溶液 C .检验 SO D .滤液加稀盐酸时只发生反应: HCl + NaOH=H 2 O + NaCl |
|
| 28. | 详细信息 |
|
某钠盐溶液中可能含有 SO 向 ① 中加入足量 BaCl 2 溶液,产生白色沉淀,加稀硝酸后沉淀消失且有气体生成。 向 ② 中加入过量的硝酸酸化的 AgNO 3 溶液,有沉淀生成且放出无色气体,该气体遇空气变红棕色。 根据上述实验现象,下列说法正确的是 A .原溶液中 CO B .原溶液中一定存在 Na + 、 CO C .原溶液中一定存在 CO D .原溶液中一定不存在 SO |
|
| 29. | 详细信息 |
|
向 A .氧化性: B .还原性: C .参加反应的 D .被氧化的 |
|
| 30. | 详细信息 |
|
下列各种情况下,溶液中一定能大量存在的离子组是 A .碱性溶液中: S 2- 、 B .含有大量 C .由水电离出的 c(H + )=l×l0 -12 mol/L 的溶液中: K + 、 Na + 、 Cl - 、 D .含有大量 Al 3+ 的溶液: Na + 、 |
|
| 31. | 详细信息 |
|
科学家也在尝试用 (1) 该过程中,还原剂是 _______( 用化学式表示 ) 。 (2) 某辆汽车的 NO 排放量为 |
|
| 32. | 详细信息 |
|
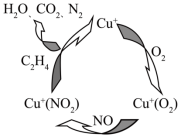
雾霾与汽车尾气有关,为了减少污染,可使用尾气净化装置,其原理如图所示: (1) 净化过程中的中间产物是 _______( 用化学式表示 ) 。 (2) 净化过程的总化学方程式是 _______ 。 |
|
| 33. | 详细信息 |
|
FeS 2 粉碎后加水调成悬浊液,向悬浊液中缓慢通入 Cl 2 ,发生如下反应: 2FeS 2 + 3Cl 2 = 2FeCl 3 +4S S+ 3Cl 2 + 4H 2 O = SO (1) 标准状况下, 0.672LCl 2 与 a gFeS 2 完全反应,取上层清液加 BaCl 2 溶液,无白色沉淀, a 的最小值为 _______ 。 (2) 标准状况下, 0.672LCl 2 与 1.20 gFeS 2 完全反应后,所得悬浊液中 S 和 SO |
|
| 34. | 详细信息 |
|
木炭与浓硫酸发生反应: C+2H 2 SO 4 ( 浓 ) (1) 作还原剂的物质是 _______ ,硫元素的化合价 _______( 填 “ 升高 ” 或 “ 降低 ”) 。 (2) 反应中每生成 1mol CO 2 ,消耗 C 的物质的量是 _______mol ,转移电子的物质的量是 _______mol 。 |
|
| 35. | 详细信息 |
|
实验室可用 KMnO 4 和浓盐酸反应制取氯气,反应原理如下: 2KMnO 4 +l6HCl( 浓 )=2KCl+2MnCl 2 +5Cl 2 ↑+8H 2 O 。 (1) 该反应的氧化剂是 _______ ;氧化产物是 _______ 。 (2) 用双线桥标出电子得失情况: _______ 。 |
|
| 36. | 详细信息 | ||||||||
|
现有以下十种物质: ① 稀盐酸、 ② 氨水、 ③ 空气、 ④CaCO 3 、 ⑤ 食盐水、 ⑥ 石墨、 ⑦Al 、 ⑧Ba(OH) 2 、 ⑨H 2 SO 4 、 ⑩CO 2 。对上述物质进行分类,将符合条件的物质的编号填入相应的位置:
|
|||||||||
| 37. | 详细信息 |
|
以下物质: ①NaOH 溶液; ② 液氨; ③BaCO 3 固体; ④ 熔融 (1) 所给物质中属于混合物的是 _______ (2) 在 ① 中通入足量 ⑦ ,发生反应的离子方程式为 _______ (3) 写出 (4) 在 |
|
| 38. | 详细信息 |
|
有如下物质: ① 铜丝; ② 氢氧化钠溶液; ③ (1) 以上物质中,属于电解质的是 _______( 填序号,下同 ) ,属于非电解质的是 _______ 。 (2) 已知蒸馏水有微弱的导电性,上述物质除 ⑥ 外,能导电的是 _______ 。 (3) 物质 ③ 溶于水的电离方程式为 _______ 。 (4) 向 ⑨ 的分散系中逐渐滴加 ③ 的溶液,可观察到的现象是 _______ 。 |
|
| 39. | 详细信息 |
|
回答下列问题 (1) 根据反应 3H 2 S+2HNO 3 =3S↓+2NO+4H 2 O ,回答下列问题。 ① 在上述反应中,表现出氧化性的物质是 _______ , _______ 是还原产物。 ② 用双线桥表示出上述反应的电子的情况: _______ 。 (2) 根据反应 8NH 3 +3Cl 2 =6NH 4 Cl+N 2 ,回答下列问题。 ① 氧化剂是 _______ ,还原剂是 _______ 。 ② 氧化剂与还原剂的物质的量之比为 _______ 。 ③ 当生成 28gN 2 时,被氧化的物质为 _______g 。 |
|
| 40. | 详细信息 |
|
对反应 NH 3 + O 2 →NO +H 2 O( 未配平 ) 作分析,配平方程式并用 单线桥法 标出电子转移的方向和数目。 _______ 。 |
|