2020е®үеҫҪй«ҳдёүдёҠеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺеҢ–еӯҰз”ЁиҜӯзҡ„иЎЁзӨәжӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (гҖҖВ В гҖҖ) AпјҺж°®ж°”зҡ„з”өеӯҗејҸпјҡNвӢ®вӢ®N BпјҺзҶ”иһҚзҠ¶жҖҒдёӢзЎ«й…ёж°ўй’ҫзҡ„з”өзҰ»ж–№зЁӢејҸпјҡKHSO4 CпјҺиҙЁеӯҗж•°дёә53пјҢдёӯеӯҗж•°дёә78зҡ„зўҳеҺҹеӯҗпјҡ DпјҺдёҷзғҜзҡ„з»“жһ„з®ҖејҸпјҡCH3CHCH2
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁз»ҷе®ҡжқЎд»¶дёӢпјҢдёӢеҲ—йҖүйЎ№жүҖзӨәзҡ„зү©иҙЁй—ҙиҪ¬еҢ–еқҮиғҪе®һзҺ°зҡ„жҳҜ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲВ В В В В В В В пјү AпјҺN2(g) BпјҺFe(s) CпјҺMgO(s) DпјҺS(s)
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
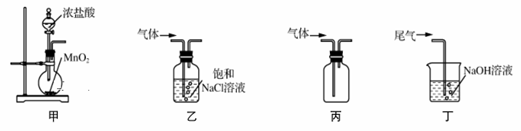
е®һйӘҢе®Өз”ЁдёӢеҲ—иЈ…зҪ®еҲ¶еҸ–гҖҒжҸҗзәҜгҖҒ收йӣҶCl2гҖҒе°ҫж°”еӨ„зҗҶпјҢдёҚиғҪиҫҫеҲ°е®һйӘҢзӣ®зҡ„зҡ„жҳҜпјҲ В В В В В В В пјү
AпјҺз”ЁиЈ…зҪ®з”ІеҲ¶еҸ–Cl2гҖҖВ В BпјҺз”ЁиЈ…зҪ®д№ҷйҷӨеҺ»Cl2дёӯзҡ„е°‘йҮҸHCl CпјҺз”ЁиЈ…зҪ®дёҷ收йӣҶCl2В В В В В В DпјҺз”ЁиЈ…зҪ®дёҒеҗёж”¶е°ҫж°”дёӯзҡ„Cl2
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁжҺўз©¶дёӢеҲ—зү©иҙЁжҖ§иҙЁжҲ–з»„жҲҗзҡ„е®һйӘҢдёӯпјҢз»“и®әдёҚжӯЈзЎ®зҡ„жҳҜ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (В В В В В В В В В В В В ) A. е°ҶдәҢж°§еҢ–зЎ«йҖҡе…Ҙй…ёжҖ§KMnO4жә¶ж¶ІдёӯпјҢзҙ«иүІиӨӘеҺ»пјҢиҜҒжҳҺдәҢж°§еҢ–зЎ«жңүиҝҳеҺҹжҖ§ B. еҗ‘жҹҗжә¶ж¶ІдёӯеҠ е…ҘKSCNжә¶ж¶ІпјҢжә¶ж¶ІеҸҳжҲҗзәўиүІпјҢиҜҒжҳҺеҺҹжә¶ж¶Ідёӯеҗ«жңүFe3+ C. е°Ҷй“қзүҮж”ҫе…ҘеҶ·жө“зЎқй…ёдёӯпјҢж— жҳҺжҳҫзҺ°иұЎпјҢиҜҒжҳҺжө“зЎқй…ёдёҺй“қзүҮдёҚеҸҚеә” D. еҗ‘жҹҗж— иүІжә¶ж¶ІдёӯеҠ е…Ҙж°ўж°§еҢ–й’ жә¶ж¶Іе№¶еҠ зғӯпјҢдә§з”ҹиғҪдҪҝж№ҝ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
е®Өжё©дёӢпјҢдёӢеҲ—еҗ„з»„зҰ»еӯҗеңЁжҢҮе®ҡжә¶ж¶ІдёӯиғҪеӨ§йҮҸе…ұ AпјҺpHпјқ12зҡ„жә¶ж¶Іпјҡ В NaпјӢгҖҒKпјӢгҖҒNO BпјҺиғҪдҪҝз”Іеҹәж©ҷеҸҳзәўзҡ„жә¶ж¶Іпјҡ Na CпјҺ1.0 molВ·LпјҚ1зҡ„KNO3жә¶ж¶Іпјҡ Fe2пјӢгҖҒHпјӢгҖҒSO DпјҺ0.1 molВ·LпјҚ1 Ba(OH)2жә¶ж¶Іпјҡ Al3пјӢгҖҒNH
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (В В В В В В В В В В ) A.1 L 0.2 molВ·LпјҚ1зҡ„NaHCO3жә¶ж¶ІдёӯHCO3пјҚе’ҢCO32пјҚзҰ»еӯҗж•°д№Ӣе’Ңдёә0.2NA
C.3.6 g COе’ҢN2зҡ„ж··еҗҲж°”дҪ“еҗ«иҙЁеӯҗж•°дёә1.8NA D.еёёжё©еёёеҺӢдёӢпјҢ30 gд№ҷзғ·ж°”дҪ“дёӯжүҖеҗ«е…ұд»·й”®зҡ„ж•°зӣ®дёә7NA
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҢҮе®ҡеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (В В В В В В В В В В ) A.зЈҒжҖ§ж°§еҢ–й“Ғжә¶дәҺи¶ійҮҸзҡ„зЁҖзЎқй…ёдёӯпјҡ3Fe2пјӢпјӢNO3пјҚпјӢ4HпјӢпјқNOвҶ‘пјӢ3Fe3пјӢпјӢ2H2O B.еҗ‘ж¬Ўж°Ҝй…ёй’ жә¶ж¶ІдёӯйҖҡе…Ҙи¶ійҮҸSO2ж°”дҪ“пјҡClOпјҚпјӢSO2пјӢH2OпјқHClOпјӢHSO3пјҚ C.зўҳеҢ–й’ҫжә¶ж¶Ій…ёеҢ–еҗҺеҠ е…Ҙе°‘йҮҸеҸҢж°§ж°ҙпјҡ2HпјӢпјӢ2IпјҚпјӢH2O2пјқI2пјӢ2H2O D.еҗ‘NaOHжә¶ж¶ІдёӯйҖҡе…ҘиҝҮйҮҸCO2пјҡ2OHпјҚпјӢCO2пјқCO32пјҚпјӢH2O
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ XгҖҒYгҖҒZгҖҒWеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§пјҢXзҡ„еҺҹеӯҗж ёеҶ…еҸӘжңүдёҖдёӘиҙЁеӯҗпјҢYеҺҹеӯҗжңҖеӨ–еұӮжҜ”WеҺҹеӯҗжңҖеӨ–еұӮеӨҡ1дёӘз”өеӯҗпјҢZзҡ„еҚ•иҙЁжҳҜз©әж°”дёӯеҗ«йҮҸжңҖй«ҳзҡ„ж°”дҪ“пјҢWеҚ•иҙЁеңЁеёёжё©дёӢиғҪиў«жө“зЎ«й…ёй’қеҢ–гҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (гҖҖ В В В гҖҖ) AпјҺеҺҹеӯҗеҚҠеҫ„пјҡY<Z<W BпјҺз®ҖеҚ•зҰ»еӯҗеҚҠеҫ„пјҡZ>W CпјҺXгҖҒYеҪўжҲҗзҡ„еҢ–еҗҲзү©еҸӘеҗ«жңүжһҒжҖ§й”® DпјҺYзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©й…ёжҖ§жҜ”Zзҡ„ејә
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
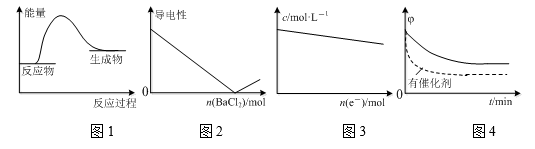
дёӢеҲ—еӣҫзӨәдёҺеҜ№еә”зҡ„еҸҷиҝ°зӣёз¬Ұзҡ„жҳҜ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (В В В В )
A. еӣҫ1иЎЁзӨәй•ҒжқЎдёҺзӣҗй…ёеҸҚеә”зҡ„иғҪйҮҸеҸҳеҢ– B. еӣҫ2иЎЁзӨәH2SO4жә¶ж¶Ідёӯж»ҙе…ҘBaCl2жә¶ж¶ІеҗҺпјҢжә¶ж¶Ізҡ„еҜјз”өжҖ§йҡҸBaCl2зү©иҙЁзҡ„йҮҸзҡ„еҸҳеҢ– C. еӣҫ3иЎЁзӨәз”өи§ЈзІҫзӮјй“ңж—¶пјҢжә¶ж¶ІдёӯCu2пјӢзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰйҡҸиҪ¬з§»з”өеӯҗзү©иҙЁзҡ„йҮҸзҡ„еҸҳеҢ– D. еӣҫ4иЎЁзӨәе…¶д»–жқЎд»¶дёҖе®ҡпјҢеҸҚеә”2SO2пјӢO2
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
пјҺдёӢеҲ—е®һйӘҢж–№жЎҲгҖҒзҺ°иұЎгҖҒеҫ—еҮәзҡ„з»“и®әеқҮжӯЈзЎ®зҡ„жҳҜ В В В В В В В В В В В В В В В В В В В В ( гҖҖгҖҖ)
|
||||||||||||||||
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
ж°§еҢ–дәҡй“ңеёёз”ЁдәҺеҲ¶иҲ№еә•йҳІжұЎжјҶ,з”ЁCuOдёҺCuй«ҳжё©зғ§з»“еҸҜеҲ¶еҸ–Cu2O.е·ІзҹҘеҸҚеә”пјҡ 2Cu(s)+O2(g)в•җ2CuO(s)в–іH = вҲ’314kJвӢ…molвҲ’1 2Cu2O(s)+O2(g)в•җ4CuO(s)в–іH = вҲ’292kJвӢ…molвҲ’1 еҲҷCuO(s)+Cu(s)в•җCu2O(s)зҡ„в–іHзӯүдәҺ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (В В В В В ) A.В вҲ’11kJвӢ…molвҲ’1В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В B.В +11kJвӢ…molвҲ’1
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
жө·жҙӢз”өжұ пјҢжҳҜд»Ҙй“қеҗҲйҮ‘дёәз”өжұ иҙҹжһҒпјҢйҮ‘еұһ(PtгҖҒFe)зҪ‘дёәжӯЈжһҒпјҢ科еӯҰ家жҠҠжӯЈжһҒеҲ¶жҲҗд»ҝйұјйіғзҡ„зҪ‘зҠ¶з»“жһ„гҖӮз”Ёжө·ж°ҙдёәз”өи§ЈиҙЁжә¶ж¶ІпјҢе®ғйқ жө·ж°ҙдёӯзҡ„жә¶и§Јж°§дёҺй“қеҸҚеә”дә§з”ҹз”өиғҪгҖӮжө·ж°ҙдёӯеҸӘеҗ«жңү0.5%зҡ„жә¶и§Јж°§гҖӮдёҚж”ҫе…Ҙжө·жҙӢж—¶пјҢй“қжһҒе°ұдёҚдјҡеңЁз©әж°”дёӯиў«ж°§еҢ–пјҢеҸҜд»Ҙй•ҝжңҹеӮЁеӯҳгҖӮз”Ёж—¶пјҢжҠҠз”өжұ ж”ҫе…Ҙжө·ж°ҙдёӯпјҢдҫҝеҸҜдҫӣз”өпјҢз”өжұ и®ҫи®ЎдҪҝз”Ёе‘ЁжңҹеҸҜй•ҝиҫҫдёҖе№ҙд»ҘдёҠпјҢйҒҝе…Қз»ҸеёёжӣҙжҚўз”өжұ зҡ„йә»зғҰгҖӮеҚідҪҝжӣҙжҚўпјҢд№ҹеҸӘжҳҜжҚўдёҖ AпјҺиҙҹжһҒй“қиў«ж°§еҢ– BпјҺжө·ж°ҙжё©еәҰеҚҮй«ҳпјҢз”өжұ еҸҚеә”йҖҹзҺҮеҸҜиғҪеҠ еҝ« CпјҺжӯЈжһҒеҲ¶жҲҗд»ҝйұјйіғзҡ„зҪ‘зҠ¶з»“жһ„зҡ„зӣ®зҡ„жҳҜеўһеӨ§жӯЈжһҒжқҗж–ҷе’Ңж°§ж°”жҺҘи§Ұйқўз§Ҝ DпјҺжӯЈжһҒз”өжһҒеҸҚеә”ејҸдёәO2пјӢ4HпјӢпјӢ4eпјҚ===2H2O
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
.еҗ‘зү©иҙЁзҡ„йҮҸжө“еәҰеқҮдёә1mol/Lзҡ„Fe2(SO4)3гҖҒCuSO4зҡ„1Lж··еҗҲж¶ІдёӯеҠ е…Ҙa molй“ҒзІүпјҢе……еҲҶеҸҚеә”еҗҺпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (В В В В В В В В В ) A. еҪ“aвүӨ1ж—¶пјҢеҸ‘з”ҹзҡ„еҸҚ B. еҪ“еӣәдҪ“жңүеү©дҪҷж—¶пјҢжә¶ж¶ІдёӯдёҖе®ҡеӯҳеңЁFe2+гҖҒCu2+ C. еҪ“1вүӨaпјң2ж—¶пјҢжә¶ж¶Ідёӯ n(Fe2+)пјқ(2+a)mol D. иӢҘжңүеӣәдҪ“еү©дҪҷпјҢеҲҷеӣәдҪ“дёӯдёҖе®ҡжңүй“ҒпјҢеҸҜиғҪжңүй“ң
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
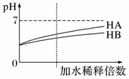
еёёжё©дёӢпјҢзӯүдҪ“з§ҜгҖҒpHеқҮдёә3зҡ„HAе’ҢHBжә¶ж¶ІеҲҶеҲ«еҠ ж°ҙзЁҖйҮҠпјҢжә¶ж¶ІpHзҡ„еҸҳеҢ–еҰӮеӣҫжүҖзӨәпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В ( В гҖҖгҖҖ)
AпјҺеҗ‘HBжә¶ж¶Ідёӯж»ҙеҠ NaOHжә¶ж¶Ізҡ„иҝҮзЁӢдёӯпјҢж°ҙзҡ„з”өзҰ»зЁӢеәҰдёҖзӣҙеўһеӨ§ BпјҺз”ЁpHдёә11зҡ„жҹҗзўұдёҺpHдёә3зҡ„HBжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲеҗҺпјҢжә¶ж¶ІдёҚеҸҜиғҪжҳҫзўұжҖ§ CпјҺж°Ёж°ҙдёҺHAжә¶ж¶Іж··еҗҲеҗҺзҡ„жә¶ж¶ІдёӯеҸҜиғҪеӯҳеңЁпјҡc(NH DпјҺе®Ңе…Ёдёӯе’ҢзӯүдҪ“з§ҜгҖҒзӯүpHзҡ„HAгҖҒHBдёӨжә¶ж¶Іж—¶пјҢж¶ҲиҖ—еҗҢжө“еәҰNaOHжә¶ж¶Ізҡ„дҪ“з§ҜпјҡHA<HB
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
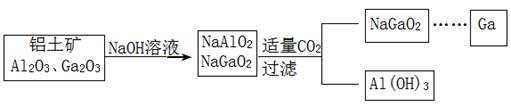
(Ga)дёҺй“қеҗҢдё»ж—ҸпјҢжӣҫиў«з§°дёәвҖңзұ»й“қвҖқпјҢе…¶ж°§еҢ–зү©гҖҒж°ўж°§еҢ–зү©еқҮдёәдёӨжҖ§еҢ–еҗҲзү©гҖӮе·ҘдёҡеҲ¶еӨҮй•“зҡ„жөҒзЁӢеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—еҲӨж–ӯдёҚеҗҲзҗҶзҡ„жҳҜ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (В В В В В В В В В В В )
A. AlгҖҒGaеқҮеӨ„дәҺв…ўAж—Ҹ B. Ga(OH)3еҸҜдёҺNaOHеҸҚеә”з”ҹжҲҗ NaGaO2 C. й…ёжҖ§пјҡAl(OH)3пјһGa(OH)3 D. Ga2O3еҸҜдёҺзӣҗй…ёеҸҚеә”з”ҹжҲҗGaCl3
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
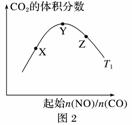
йӣҫйңҫдёҘйҮҚеҪұе“Қдәә们зҡ„з”ҹжҙ»пјҢжұҪиҪҰе°ҫж°”жҺ’ж”ҫжҳҜйҖ жҲҗйӣҫйңҫеӨ©ж°”зҡ„йҮҚиҰҒеҺҹеӣ д№ӢдёҖгҖӮе·ІзҹҘжұҪиҪҰе°ҫж°”жҺ’ж”ҫж—¶е®№жҳ“еҸ‘з”ҹд»ҘдёӢеҸҚеә”пјҡ в‘ N2(g)пјӢO2(g)оҲҘ в‘Ў2NO(g)пјӢO2(g)оҲҘ в‘ўCO(g)пјӢ в‘Ј2CO(g)пјӢ2NO(g)оҲҘ иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)ж №жҚ®еҸҚеә”в‘ в‘Ўв‘ўпјҢзЎ®е®ҡеҸҚеә”в‘ЈдёӯО”H4пјқ________ kJВ·molпјҚ1гҖӮ (2)еҜ№дәҺж°”дҪ“еҸӮдёҺзҡ„еҸҚеә”пјҢиЎЁзӨәе№іиЎЎеёёж•°Kpж—¶з”Ёж°”дҪ“з»„еҲҶ(B)зҡ„е№іиЎЎеҺӢејәp(B)д»ЈжӣҝиҜҘж°”дҪ“зү©иҙЁзҡ„йҮҸжө“еәҰc(B)пјҢеҲҷеҸҚеә”в‘ зҡ„Kpпјқ____________________________________(з”ЁиЎЁиҫҫејҸиЎЁзӨә)гҖӮ (3)дёӢеҲ—жғ…еҶөиғҪиҜҙжҳҺеҸҚеә”в‘Ўе·Іиҫҫе№іиЎЎзҠ¶жҖҒзҡ„жҳҜ________(еЎ«еӯ—жҜҚ)гҖӮ AпјҺеҚ•дҪҚж—¶й—ҙеҶ…з”ҹжҲҗ1 mol NO2зҡ„еҗҢж—¶ж¶ҲиҖ—дәҶ1 mol NO BпјҺеңЁжҒ’жё©жҒ’е®№зҡ„е®№еҷЁдёӯпјҢж··еҗҲж°”дҪ“зҡ„еҜҶеәҰдҝқжҢҒдёҚеҸҳ CпјҺеңЁз»қзғӯжҒ’е®№зҡ„е®№еҷЁдёӯпјҢеҸҚеә”зҡ„е№іиЎЎеёёж•°дёҚеҶҚеҸҳеҢ– DпјҺеңЁжҒ’жё©жҒ’еҺӢзҡ„е®№еҷЁдёӯпјҢNOзҡ„дҪ“з§ҜеҲҶж•°дҝқжҢҒдёҚеҸҳ (4)иҜ•еҲҶжһҗй«ҳжё©дёӢдёҚеҲ©дәҺеҸҚеә”в‘ўиҮӘеҸ‘иҝӣиЎҢзҡ„еҺҹеӣ ______________________________гҖӮ
(5)жҺўз©¶еҸҚеә”в‘Јдёӯе№іиЎЎж—¶CO2зҡ„дҪ“з§ҜеҲҶж•°дёҺеҸҚеә”зү©дёӯиө·е§Ӣn(NO)/n(CO)зҡ„жҜ”еҖјгҖҒжё©еәҰзҡ„е…ізі»пјҢеҫ—еҲ°еҰӮеӣҫ2жүҖзӨәзҡ„жӣІзәҝгҖӮеңЁXгҖҒYгҖҒZдёүзӮ№дёӯпјҢCOзҡ„иҪ¬еҢ–зҺҮд»ҺеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜ____________________гҖӮ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
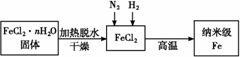
зәізұіжқҗж–ҷдёҖзӣҙжҳҜдәәд»¬з ”з©¶зҡ„йҮҚиҰҒиҜҫйўҳ,дҫӢеҰӮзәізұізә§FeзІүиЎЁйқўз§ҜеӨ§,е…·жңүи¶…ејәзҡ„зЈҒжҖ§ в… .е®һйӘҢе®ӨйҮҮз”Ёж°”зӣёиҝҳеҺҹжі•еҲ¶еӨҮзәізұізә§Fe,е…¶жөҒзЁӢеҰӮеӣҫжүҖзӨә:
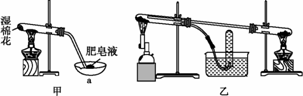
(1)зәізұізә§Feе’ҢзЁҖзӣҗй…ёеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖҖгҖҖгҖҖгҖҖгҖҖ В В В В В В В В В В В В В В гҖҖгҖҖгҖҖгҖҖгҖӮВ (2)еҰӮдҪ•е°ҶFeCl2В·nH2OеӣәдҪ“еҠ зғӯи„ұж°ҙеҲ¶еҫ—ж— ж°ҙFeCl2:В В В В В В В В В В В (з”Ёз®ҖиҰҒж–Үеӯ—жҸҸиҝ°)гҖӮВ (3)з”ҹжҲҗзәізұізә§Feзҡ„еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖҖгҖӮВ в…Ў.жҹҘйҳ…иө„ж–ҷ:еңЁдёҚеҗҢжё©еәҰдёӢ,зәізұізә§FeзІүдёҺж°ҙи’ёж°”еҸҚеә”зҡ„еӣәдҪ“дә§зү©дёҚеҗҢ,жё©еәҰдҪҺдәҺ570 в„ғж—¶з”ҹжҲҗFeO,й«ҳдәҺ 570 в„ғж—¶з”ҹжҲҗFe3O4гҖӮз”ІеҗҢеӯҰз”Ёеӣҫз”ІжүҖзӨәиЈ…зҪ®иҝӣиЎҢзәізұізә§FeзІүдёҺж°ҙи’ёж°”еҸҚеә”зҡ„е®һйӘҢ,д№ҷеҗҢеӯҰз”Ёеӣҫд№ҷжүҖзӨәзҡ„иЈ…зҪ®иҝӣиЎҢзәізұізә§FeзІүдёҺж°ҙи’ёж°”зҡ„еҸҚеә”并йӘҢиҜҒдә§зү©гҖӮ
(4)з”ІиЈ…зҪ®дёӯзәізұізә§FeзІүдёҺж°ҙи’ёж°”еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜгҖҖ В В В В В В В В В В В В В В В В В В В В В гҖӮВ (5)з”ІиЈ…зҪ®дёӯд»ӘеҷЁaзҡ„еҗҚз§°дёәгҖҖгҖҖгҖҖгҖҖВ В В В В В В В В В В В В гҖҖгҖҖгҖӮВ (6)дёҒеҗҢеӯҰз§°еҸ–5.60 g FeзІү,з”Ёд№ҷиЈ…зҪ®еҸҚеә”дёҖж®өж—¶й—ҙеҗҺ,еҒңжӯўеҠ зғӯгҖӮе°ҶиҜ•з®ЎеҶ…зҡ„еӣәдҪ“зү©иҙЁеңЁе№ІзҮҘеҷЁдёӯеҶ·еҚҙеҗҺ,з§°еҫ—иҙЁйҮҸдёә6.88 g,еҲҷдёҒеҗҢеӯҰе®һйӘҢеҗҺзҡ„еӣәдҪ“зү©иҙЁдёӯж°§еҢ–зү©зҡ„иҙЁйҮҸеҲҶж•°дёәгҖҖгҖҖВ гҖҖгҖҖ В
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
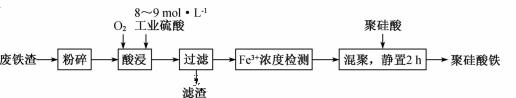
иҒҡзЎ…й…ёй“ҒжҳҜзӣ®еүҚж— жңәй«ҳеҲҶеӯҗзө®еҮқеүӮз ”з©¶зҡ„зғӯзӮ№,дёҖз§Қз”Ёй’ўз®ЎеҺӮзҡ„еәҹй“ҒжёЈ(дё»иҰҒжҲҗеҲҶFe3O4пјҢеҗ«е°‘йҮҸзўіеҸҠдәҢж°§еҢ–зЎ…)дёәеҺҹж–ҷеҲ¶еӨҮзҡ„жөҒзЁӢеҰӮдёӢпјҡ
пјҲ1пјүеәҹй“ҒжёЈиҝӣиЎҢвҖңзІүзўҺвҖқзҡ„зӣ®зҡ„жҳҜгҖҖгҖҖгҖҖгҖҖВ В В В В В В В гҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖӮВ пјҲ2пјүв‘ еҠ зғӯжқЎд»¶дёӢй…ёжөёж—¶пјҢFe3O4дёҺзЎ«й…ёеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖӮВ в‘Ўй…ёжөёж—¶,йҖҡе…ҘO2зҡ„зӣ®зҡ„жҳҜгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖӮВ В пјҲ3пјүж»ӨжёЈзҡ„дё»иҰҒжҲҗеҲҶдёәгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖ(еЎ«еҢ–еӯҰејҸ)гҖӮВ пјҲ4пјүвҖңFe3+жө“еәҰжЈҖжөӢвҖқжҳҜе…Ҳз”ЁSnCl2е°ҶFe3+иҝҳеҺҹдёәFe2+пјӣеңЁй…ёжҖ§жқЎд»¶дёӢпјҢеҶҚз”ЁK2Cr2O7ж ҮеҮҶжә¶ж¶Іж»ҙе®ҡFe2+(Cr2O72-иў«иҝҳеҺҹдёәCr3+)пјҢиҜҘж»ҙе®ҡ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
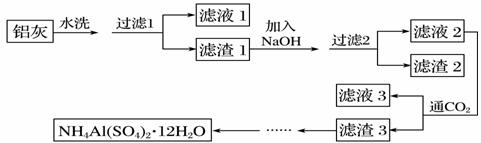
NH4Al(SO4)2В·12H2O(й“өжҳҺзҹҫ)еҸҜз”ЁдҪңжіЎжІ«зҒӯзҒ«еҷЁзҡ„еҶ…з•ҷеүӮгҖҒзҹіжІ№и„ұиүІеүӮзӯүгҖӮжҹҗе…ҙи¶Је°Ҹз»„еҗҢеӯҰз”Ёж°§еҢ–й“ҒгҖҒй“қзІүгҖҒй•ҒжқЎе’Ңж°Ҝй…ёй’ҫзӯүзү©иҙЁеҒҡй“қзғӯеҸҚеә”зҡ„й“қзҒ°еҸҠзЎ«й…ёй“өзӯүдёәеҺҹж–ҷеҲ¶еӨҮй“өжҳҺзҹҫзҡ„е®һйӘҢпјҢжӯҘйӘӨеҰӮдёӢпјҡ
(1)дёӢеҲ—жңүе…іиҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ________(еЎ«еӯ—жҜҚ)гҖӮ AпјҺвҖңж»Өж¶І1вҖқдёӯеҗ«жңүKпјӢгҖҒMg2пјӢгҖҒClпјҚ BпјҺвҖңж»ӨжёЈ1вҖқе’ҢвҖңж»ӨжёЈ2вҖқдёӯеҗ«жңүзӣёеҗҢзҡ„зү©иҙЁ CпјҺвҖңж»ӨжёЈ2вҖқдёӯеҗ«жңүж°ўж°§еҢ–й“ҒпјҢж°ўж°§еҢ–й•ҒзӯүеӣәдҪ“ DпјҺе°ҶвҖңж»Өж¶І3вҖқ蒸干并зҒјзғ§пјҢеҸҜеҫ—зәҜзўұ (2)з”ЁNaOHжә¶и§ЈвҖңж»ӨжёЈ1вҖқж—¶пјҢеҸҜд»ҘйҮҮз”Ё__________________ж–№ејҸжҸҗй«ҳжөёеҮәзҺҮгҖӮ пјҲ3пјүз”ЁNaOHжә¶и§ЈвҖңж»ӨжёЈ1вҖқж—¶пјҢеҸҜиғҪеҸ‘з”ҹзҡ„еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәв‘ ___________________В В В В В ___гҖҒв‘Ў В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ (4)еҗ‘вҖңж»Өж¶І2вҖқдёӯйҖҡе…Ҙи¶ійҮҸзҡ„CO2пјҢеҶҷеҮәзӣёеә”зҡ„зҰ»еӯҗеҸҚеә”ж–№зЁӢејҸпјҡ_______________ ____ В |
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
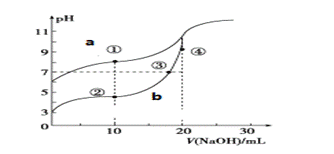
еёёжё©дёӢпјҢз”Ёй…ҡй…һдҪңжҢҮзӨәеүӮпјҢз”Ё0.10molВ·LпјҚ1 NaOHжә¶ж¶ІеҲҶеҲ«ж»ҙе®ҡ20.00mLжө“еәҰеқҮдёә0.10molВ·LпјҚ1зҡ„ CH3COOHжә¶ж¶Іе’ҢHCNжә¶ж¶ІжүҖеҫ—ж»ҙе®ҡжӣІзәҝеҰӮеӣҫгҖӮ пјҲе·ІзҹҘпјҡCH3COOHгҖҒ HCNзҡ„з”өзҰ»е№іиЎЎеёёж•°еҲҶеҲ«дёә1.75Г—10-5гҖҒ6.4Г—10-10пјү
(1)еӣҫ___пјҲaжҲ–bпјүжҳҜNaOHжә¶ж¶Іж»ҙе®ҡHCNжә¶ж¶Ізҡ„pHеҸҳеҢ–зҡ„жӣІзәҝпјҢеҲӨж–ӯзҡ„зҗҶз”ұжҳҜ_______________________гҖӮ (2)зӮ№в‘ўжүҖзӨәжә¶ж¶ІдёӯжүҖеҗ«зҰ»еӯҗжө“еәҰзҡ„д»ҺеӨ§еҲ°е°Ҹзҡ„йЎәеәҸпјҡ_______________________гҖӮ (3)зӮ№в‘ е’ҢзӮ№в‘Ў жүҖзӨәжә¶ж¶Ідёӯпјҡc(CH3COOпјҚ)пјҚc(CNпјҚ)___c(HCN)пјҚc(CH3COOH)пјҲеЎ«вҖң>гҖҒ<жҲ–=вҖқпјү (4)зӮ№
|
|
- 2019еұҠй«ҳдёүдёҠеӯҰжңҹ第дәҢж¬ЎиҒ”иҖғеҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲжұҹиҘҝзңҒж–°дҪҷеёӮ第еӣӣдёӯеӯҰгҖҒдёҠй«ҳеҺҝ第дәҢдёӯеӯҰпјү
- 2018-2019е№ҙй«ҳдёҖдёҠеҚҠе№ҙжңҹжң«иҖғиҜ•еҢ–еӯҰиҖғйўҳеҗҢжӯҘи®ӯз»ғпјҲй»‘йҫҷжұҹзңҒеӨ§еәҶе®һйӘҢдёӯеӯҰпјү
- 2019-2020е№ҙй«ҳдёҖдёҠеҚҠжңҹ12жңҲжңҲиҖғеҢ–еӯҰйўҳејҖеҚ·жңүзӣҠпјҲдә‘еҚ—зңҒдёҙжІ§еёӮиҖҝ马еҺҝж°‘ж—ҸдёӯеӯҰпјү
- й«ҳдәҢдёӢеҚҠе№ҙжңҹжң«иҖғиҜ•еҢ–еӯҰйўҳеёҰеҸӮиҖғзӯ”жЎҲпјҲ2019-2020е№ҙиҫҪе®ҒеёҲиҢғеӨ§еӯҰйҷ„еұһдёӯеӯҰпјү
- 2018иҮі2019е№ҙй«ҳдёҖдёӢеҚҠжңҹ5жңҲжңҲиҖғеҢ–еӯҰиҖғйўҳпјҲжІіеҚ—зңҒжҙӣйҳіеёӮ第дёҖй«ҳзә§дёӯеӯҰпјү
- дёҠжө·еёӮ2018е№ҙй«ҳдёҖеҢ–еӯҰдёҠеӯҰжңҹжңҹдёӯиҖғиҜ•е®Ңж•ҙиҜ•еҚ·
- е·ҙеҪҰж·–е°”еёӮ2018е№ҙй«ҳдёҖеҢ–еӯҰдёҠеҚҠе№ҙжңҲиҖғжөӢйӘҢе…Қиҙ№иҜ•еҚ·
- 2019зүҲеҝ…дҝ®з¬¬дёҖеҶҢпјҲдё“йўҳ3 第дәҢеҚ•е…ғз»јеҗҲжӢ”й«ҳз»ғ-й«ҳдёӯеҢ–еӯҰиӢҸж•ҷпјү