2019高二上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
下列与化学有关的文献,理解错误的是 A. 《咏石灰》中“…烈火焚烧若等闲…要留清白在人间”其中“清白”是指氢氧化钙 B. 《咏煤炭》中“凿开混沌得乌金…不辞辛苦出山林”其中“乌金”的主要成分是煤炭 C. 《天工开物》记载:“以消石、硫磺为主,草木灰为辅。…魂散惊而魄齑粉”文中提到的是火药 D. 《天工开物》有如下描述:“世间丝、麻、裘 ,皆具素质…”文中的“裘”主要成分是蛋白质
|
|
| 2. | 详细信息 |
|
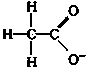
对H2O的电离平衡不产生影响的粒子是: A.
|
|
| 3. | 详细信息 |
|
下列说法正确的是(NA表示阿伏加德罗常数的值): A.30g乙烷含有的共价键数目为8NA B.2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA C.1mol甲基含10 NA个电子 D.标况下,22.4L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA
|
|
| 4. | 详细信息 |
|
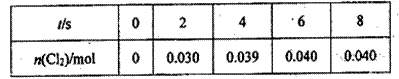
在反应3H2 + N2 用H2表示的平均反应速率为0.45 mol•L-1s-1则反应所经过的时间为 A.0.44s B.1s C.2s D.0.33s
|
|
| 5. | 详细信息 |
|
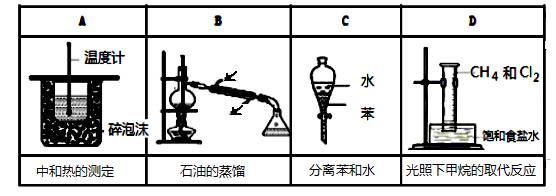
下列实验装置正确(固定装置略去)且能达到实验目的的是:
|
|
| 6. | 详细信息 |
|
已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的有:
A.由红外光谱可知,该有机物中至少有三种不同的化学键 B.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3 C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数 D.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
|
|
| 7. | 详细信息 |
|
下列化合物的一氯代物的数目大小排列顺序正确的是: ①CH3CH2CH2CH2CH2CH3 ②(CH3)2CHCH(CH3)2 ③(CH3)3CCH2CH3 ④2,2,3,3﹣四甲基丁烷 A.①>②>③>④ B.③>②>④>① C.③=①>②>④ D.②>③=①>④
|
|
| 8. | 详细信息 |
|
某无色溶液中由水电离产生的C(H+)和C(OH-)的乘积为1×10-18( 25℃),下列离子组在此溶液中能大量共存的是: A.MnO4- Cl- K+ Na+ B.CO32- NO3- Cu2+ Na+ C.SO42- HCO3- K+ Na+ D.SO42- NO3- K+ Na+
|
|
| 9. | 详细信息 |
|
某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法不正确的是: A. 若溶液中c(A-)=c(Na+),则溶液一定呈中性 B. 溶液中不可能存在:c(Na+)>c(A-)>c(H+)> c(OH-) C. 若c(OH-)>c(H+),溶液中可能存在:c(Na+)>c(OH-)>c(A-)>c(H+) D. 若溶质为NaA、HA,则不可能存在:c(A-)>c(Na+)>c(H+)>c(OH-)
|
|
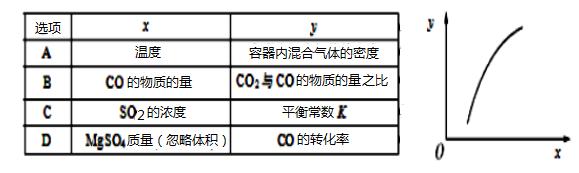
| 10. | 详细信息 |
|
通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)
|
|
| 11. | 详细信息 |
|
下列有机物的系统命名中正确的是: A. 3-甲基-4-乙基戊烷 B. 3,3,4-三甲基己烷 C. 3,4,4-三甲基己烷 D. 3,5-二甲基己烷
|
|
| 12. | 详细信息 |
|
某原电池构造如图所示,下列叙述正确的是: A. 原电池的总反应式为:Cu+2AgNO3 = 2Ag+Cu(NO3)2 B. 取出盐桥后,电流表的指针仍发生偏转 C. 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g D. 在外电路中,电子由银电极流向铜电极
|
|
| 13. | 详细信息 |
|
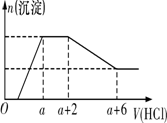
某溶液中可能含有SiO 当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随加入盐酸的
A.原溶液中一定含有Na2SO4 B.反应最后形成的溶液中的溶质只有NaCl C.原溶液中含有CO D.原溶液中一定含有的阴离子是OH-、CO
|
|
| 14. | 详细信息 |
|
常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全中和,则下列说法错误的是: A.氨水的浓度等于盐酸的浓度 B.原氨水中有1%的含氮微粒为NH4+ C.氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍 D.混合溶液中c(NH4+)+c(NH3•H2O) +c(NH3)=5×10﹣4mol•L
|
|
| 15. | 详细信息 |
|
T K时,向2.0L恒容密闭容器中充入0.10molCOCl2,发生反应 A. T K时该反应的化学平衡常数为 B. 反应在前2s的平均速率 C. 保持其他条件不变,升高温度,若新平衡时c(C12)=0.038 mol·L-1,则反应的△H < 0 D. 平衡后向上述容器中再充入0.10molCOCl2,平衡正向移动,COCl2的转化率增大
|
|
| 16. | 详细信息 |
|
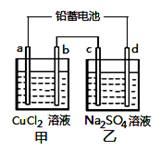
用铅蓄电池电解甲、乙电解池中的溶液。已知铅蓄电池的总反应为:
分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是: A.d极为阴极 B.放电时铅蓄电池负极的电极反应式为: PbO2(s) + 4 H+(aq)+SO4 2-(aq)+4e- =PbSO4 (s) +2H2O (l) C.若利用甲池精炼铜,b极应为粗铜 D.若四个电极材料均为石墨,当析出6.4 g Cu时,两池中 共产生气体3.36 L(标准状况下)
|
|
| 17. | 详细信息 |
|
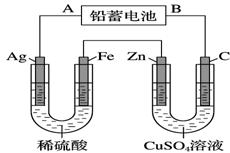
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。
甲池 乙池 (1)B是铅蓄电池的______极,放电过程中A电极反应式: 。 (2)电解后甲池中电解液的PH________(填“减小”“增大”或“不变”)。,若甲池中产生气体11.2L (标准状况下),此时乙池中理论上Zn电极最多产生固体________ g。 (3)乙池中 C(碳)电极是_________极。C电极的电极反应式是_____________________, 反应一段时间后,向乙池中加入一定量的 (填化学式)固体,能使CuSO4溶液恢复 到原浓度。
|
|
| 18. | 详细信息 |
|
分析、归纳、探究是学习化学的重要方法和手段之一。下面就电解质A回答有关问题 (假定以下都是室温时的溶液)。 (1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a ①当a =10时,A溶液呈碱性的原因是(用离子方式程式表示) 。 ②当a =11,n =1时,A溶液中各种离子浓度由大到小的顺序为 , c(OH-)-c(HB)=________ mol/L。 ③当n=1、c=0.1,溶液中c(HB)∶c(B-)=1∶999时,A溶液的pH为______(保留整数值)。 (2)已知难溶电解质A的化学式为XY2,测得其饱和溶液中X2+离子的浓度为c mol/L,则该 难溶物X3Y2的溶度积常数为Ksp=_______。
|
|
| 19. | 详细信息 |
|
溶液中的化学反应大多是离子反应。根据要求回答下列问题: (1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用离子方程式表示: 盐碱地产生碱性的原因:__________________________________________; (2)已知水存在如下平衡:H2O+H2O 向________移动,且所得溶液显________性。 (3)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等, 则m________n (填“>”“<”或“=”)。 (4)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=________。 (5)已知:常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;则 NH4HCO3溶液呈________ 性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
|
|
| 20. | 详细信息 |
|
氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,它们应用广泛。 (1)N2O是人类最早应用于医疗的麻醉剂之一.它可由NH4NO3在加热条件下分解产生,此反应的化学方程式为 。 (2)N2O4可作火箭高能燃料N2H4的氧化剂.已知:2NO2(g)⇌ N2O4(g)△H=﹣akJ•mol﹣1; N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣bkJ•mol﹣1; N2(g)+2O2(g)=2NO2(g)△H=+ckJ•mol﹣1;(a、b、c均大于0). 写出气态肼(N2H4)在气态(N2O4)中燃烧生成氮气和气态水的热化学方程式 。 (3)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度, 分压=总压 × 物质的量分数(例如p(NO2)=p总×x(NO2))。
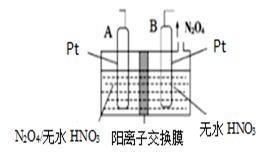
(4)新型绿色硝化剂N2O5可以通过N2O4为原料用电 解法制备,实验装置如图所示.则电极B接 直流电源的 极,电解池中生成N2O5的 电极反应式为 。
|
|
| 21. | 详细信息 |
|
有A、B两种烃,其相关信息如下: A: ①完全燃烧的产物中n(CO2)∶n(H2O)=2∶1 ②28< M (A)<60 ③不能使溴的四氯化碳溶液褪色 ④一氯代物只有一种结构 B: ①饱和链烃,通常情况下呈气态、②有同分异构体、③二溴代物有三种 回答下列问题: (1)烃A的实验式是 _____________;(2)烃A的结构简式是_____________; (3)烃B的三种二溴代物的结构简式为___________、_____________、___________; (4)烃C为烃B的同系物,常温下为气态且只有一种一溴代物,则烃C的一溴代物的结构简式 为_____________ (填一种即可)。
|
|
- 高中化学人教版 必修1 第三章 金属及其化合物 2.几种重要的金属化合物 铁的重要化合物
- 黄金30题系列 高二化学 小题好拿分
- 2016-2017年高一下半期理综化学开学考试(安徽师大附中)
- 高中化学人教版 必修2 第四章 化学与自然资源的开发利用 第一节 开发利用金属矿物和海水资源 海水资源的开发利用
- 2017-2018年高二12月联考化学考试题(河南省豫北重点中学)
- 2016-2017年高一下半年化学开学考试专题训练(广西省桂林市第十八中学)
- 高中化学人教版 选修四 第三章 水溶液中的离子反应 第二节 水的电离和溶液的酸碱性 水的电离和溶液的酸碱性第二课时
- 2016-2017年高一上册化学期中考试考卷带参考答案和解析(山东省淄博市淄川一中)