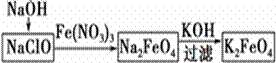2019зҰҸе»әй«ҳдёүдёҠеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
В В В В В В В В В В еҢ–еӯҰдёҺзӨҫдјҡз”ҹдә§з”ҹжҙ»зҙ§еҜҶзӣёе…іпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺй“ҒжҜ”й“ңйҮ‘еұһжҖ§ејәпјҢж•…з”Ё BпјҺж°ўж°§еҢ–й“қе…·жңүејұзўұжҖ§пјҢеҸҜз”ЁдәҺеҲ¶иғғй…ёдёӯе’ҢеүӮ CпјҺжҙҒеҺ•зҒөзҡ„дё»иҰҒжҲҗеҲҶжҳҜзӣҗй…ёпјҢдёҺвҖң84вҖқж¶ҲжҜ’ж¶Іж··з”ЁпјҢж•ҲжһңжӣҙеҘҪ DпјҺжІіж°ҙдёӯжңүи®ёеӨҡжқӮиҙЁе’Ңжңүе®із»ҶиҸҢпјҢеҠ е…ҘжҳҺзҹҫж¶ҲжҜ’жқҖиҸҢеҗҺеҸҜд»ҘйҘ®з”Ё
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢәеҲ«зЎқзҹіпјҲKNO3пјүе’Ңжңҙж¶ҲпјҲNa2SO4пјүпјҡвҖңд»ҘзҒ«зғ§д№ӢпјҢзҙ«йқ’зғҹиө·пјҢд№ғзңҹзЎқзҹід№ҹвҖқвҖ”вҖ”гҖҠжң¬иҚүз»ҸйӣҶжіЁгҖӢпјҢиҝҷйҮҢиҝҗз”ЁдәҶзЎқзҹізҡ„пјҲВ В В пјүжҖ§иҙЁ AпјҺз„°иүІеҸҚеә”В В В В В В В В В BпјҺж°§еҢ–жҖ§В В В В В В В В CпјҺиҝҳеҺҹжҖ§В В В В В В В В DпјҺдёҚзЁіе®ҡжҖ§
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
жҹҗеҗҢеӯҰз”ЁдёӢиЎЁжүҖзӨәеҪўејҸеҜ№жүҖеӯҰзҹҘиҜҶиҝӣиЎҢеҲҶзұ»пјҢе…¶дёӯз”ІдёҺд№ҷгҖҒдёҷгҖҒдёҒжҳҜеҢ…еҗ«е…ізі»гҖӮдёӢеҲ—еҗ„з»„дёӯпјҢжӯЈзЎ®зҡ„з»„еҗҲжҳҜ(гҖҖгҖҖ)
|
||||||||||||||||
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁNAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺеңЁж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4Lд№ҷйҶҮеҗ«жңүзҡ„еҲҶеӯҗж•°дёәNA BпјҺ1 mol/L AlCl3жә¶ж¶Ідёӯеҗ«жңү3NAдёӘClпјҚ CпјҺе®Өжё©дёӢпјҢ14gN2е’ҢCOзҡ„ж··еҗҲж°”дҪ“дёӯеҗ«жңүзҡ„еҺҹеӯҗж•°зӣ®дёәNA DпјҺ71gж°Ҝж°”еҸ‘з”ҹж°§еҢ–иҝҳеҺҹеҸҚеә”пјҢдёҖе®ҡеӨұеҺ»2NAдёӘз”өеӯҗгҖҖ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иЎЁиҝ°жӯЈзЎ®зҡ„жҳҜ(В В В В ) AпјҺйҮ‘еұһй’ й•ҝжңҹжҡҙйңІдәҺз©әж°”дёӯпјҢжңҖз»ҲеҸҳдёәNa2CO3зІүжң« BпјҺйҷӨеҺ»NaHCO3жә¶ж¶Ідёӯзҡ„Na2CO3пјҢеҸҜеҠ е…Ҙжҫ„жё…зҹізҒ°ж°ҙеҗҺиҝҮж»Ө CпјҺд»…з”Ёж°Ёж°ҙеҸҜд»ҘйүҙеҲ«NaClгҖҒMgCl2гҖҒAlCl3дёүз§Қжә¶ж¶І DпјҺй…ҚеҲ¶жҲҗ480 mL 1.0 molВ·LпјҚ1 NaOHжә¶ж¶ІпјҢйңҖз§°йҮҸNaOHеӣәдҪ“19.2g
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жңү(В В В В В ) в‘ зўұжҖ§ж°§еҢ–зү©пјҡNa2O2гҖҒMgOгҖҒAl2O3В в‘ўCa(HCO3)2гҖҒFe(OH)3гҖҒFeCl2еқҮеҸҜз”ұеҢ–еҗҲеҸҚеә”еҲ¶еҫ— в‘ЈеҲҶеҲ«д»ҘзҶ”иһҚзҡ„NaClгҖҒMgCl2гҖҒAl2O3дёәеҺҹж–ҷйҖҡиҝҮз”өи§Јжі•еҲ¶еҸ–йҮ‘еұһNaгҖҒMgгҖҒAl в‘Өзўҳжҷ¶дҪ“еҲҶж•ЈеҲ°й…’зІҫдёӯгҖҒйҘұе’Ңж°ҜеҢ–й“Ғжә¶ж¶Іж»ҙе…ҘжІёж°ҙдёӯжүҖеҪўжҲҗзҡ„еқҮдёҖгҖҒйҖҸжҳҺзҡ„еҲҶж•Јзі»еҲҶеҲ«дёәпјҡжә¶ж¶ІгҖҒиғ¶дҪ“ AпјҺв‘ в‘Јв‘ӨВ В В В В В В В В В В В BпјҺв‘ўв‘Јв‘ӨВ В В В В В В В CпјҺв‘Ўв‘ўв‘ЈВ В В В В В В В В В В В DпјҺв‘Ўв‘Јв‘Ө
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁй—ҙзҡ„иҪ¬еҢ–е…ізі»дёӯдёҚиғҪе…ЁйғЁйҖҡиҝҮдёҖжӯҘеҸҚеә”е®ҢжҲҗзҡ„жҳҜ(гҖҖгҖҖ) AпјҺNaвҶ’NaOHвҶ’Na2CO3вҶ’NaClгҖҖгҖҖВ В В BпјҺMgвҶ’MgCl2вҶ’MgCO3вҶ’Mg(OH)2 CпјҺAlвҶ’Al2O3вҶ’Al(OH)3вҶ’AlCl3гҖҖВ В В В гҖҖ DпјҺFeвҶ’FeCl3вҶ’Fe(OH)3вҶ’Fe2O3
|
|
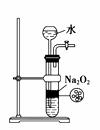
| 8. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||||||||||||||||||
|
дёӢеҲ—е®һйӘҢж“ҚдҪңжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјүВ
зӣҗй…ё
В В В В В В В В IВ В В В В В В В В В В В В В В В В В в…ЎВ В В В В В В В В В В В В В В В В В В В в…ўВ В В В В В В В В В В В В IVВ В В В AпјҺе®һйӘҢв… пјҡйҖҗж»ҙж»ҙеҠ зӣҗй…ёж—¶пјҢиҜ•з®Ўдёӯз«ӢеҚідә§з”ҹеӨ§йҮҸж°”жіЎ BпјҺе®һйӘҢв…Ўпјҡй…ҚеҲ¶0.10 molВ·LпјҚ1 NaOHжә¶ж¶І CпјҺе®һйӘҢв…ўпјҡиЈ…зҪ®в‘ўз”ЁдәҺеҲ¶еӨҮе°‘йҮҸж°§ж°” DпјҺе®һйӘҢIVпјҡеҸҜз”ЁдәҺFe(OH)2 зҡ„еҲ¶еҸ–пјҢ并иғҪйҳІжӯўFe(OH)2 иў«ж°§еҢ–
|
|||||||||||||||||||||||||||||||||||||
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁжә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸNa2O2еҗҺд»ҚиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜпјҲВ В В пјүВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В AпјҺNH4+гҖҒBa2+гҖҒClпјҚгҖҒNO3пјҚВ В В В В В В В В В В В В В В В В В В В В В В В BпјҺK+гҖҒSiO32пјҚгҖҒAlO2пјҚгҖҒSO42пјҚ CпјҺFe2+гҖҒMg2+гҖҒSCNпјҚгҖҒClпјҚВ В В В В В В В В В В В В В В В В В В В DпјҺNa+гҖҒHCO3пјҚгҖҒSO32пјҚгҖҒIпјҚ
|
|
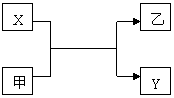
| 10. | иҜҰз»ҶдҝЎжҒҜ | |||
|
XгҖҒYжҳҜдёӨз§Қеёёи§Ғзҡ„еҚ•иҙЁпјҢз”ІгҖҒд№ҷжҳҜдёӨз§Қеёёи§Ғзҡ„еҢ–еҗҲзү©пјҢиҝҷдәӣеҚ•иҙЁе’ҢеҢ–еҗҲзү©д№Ӣй—ҙеӯҳеңЁеҰӮеӣҫжүҖзӨәзҡ„е…ізі»пјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү
AпјҺиӢҘXдёәз„ҰзӮӯпјҢеҲҷд№ҷеҸҜиғҪжҳҜCOВ В В В В В В В BпјҺиӢҘXдёәйҮ‘еұһй“қпјҢеҲҷз”ІеҸҜиғҪдёәж°§еҢ–й•Ғ CпјҺиӢҘYдёәж°ўж°”пјҢеҲҷXеҸҜиғҪдёәйҮ‘еұһеҚ•иҙЁВ В В DпјҺиӢҘYдёәеҚ•иҙЁзўіпјҢеҲҷXеҸҜиғҪжҳҜйҮ‘еұһй•Ғ
|
||||
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘеёёжё©дёӢдәҢж°ҜеҢ–дәҢзЎ«(S2 Cl2)дёәзәўжЈ•иүІж¶ІдҪ“пјҢе…¶з»“жһ„ејҸдёәCl-S-S-ClгҖӮ е…¶еҲ¶еӨҮеҸҚеә”еҸҠдёҺж°ҙеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸеҰӮдёӢпјҡ
в‘Ў2S2Cl2 +2H2O = 4HCl + SO2вҶ‘+ 3SвҶ“пјҢ еҲҷдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ (В В В ) AпјҺеҸҚеә”в‘ дёӯCS2дҪңж°§еҢ–еүӮВ В В В В В В В В В В В В В В BпјҺеҸҚеә”в‘ дёӯжҜҸз”ҹжҲҗ1mol S2Cl2иҪ¬з§»4molз”өеӯҗ CпјҺеҸҚеә”в‘ЎдёӯS2Cl2ж—ўдҪңж°§еҢ–еүӮеҸҲдҪңиҝҳеҺҹеүӮ DпјҺеҸҚеә”в‘Ўдёӯж°§еҢ–дә§зү©дёҺиҝҳеҺҹдә§зү©зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә3:1В В
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
20 в„ғж—¶пјҢйҘұе’ҢKClжә¶ж¶Ізҡ„еҜҶеәҰдёә1.174 gВ·cmпјҚ3пјҢзү©иҙЁзҡ„йҮҸжө“еәҰдёә4.0 molВ·LпјҚ1пјҢеҲҷдёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺ20 в„ғж—¶пјҢеҜҶеәҰе°ҸдәҺ1.174 gВ·cmпјҚ3зҡ„KClжә¶ж¶ІжҳҜдёҚйҘұе’Ңжә¶ж¶І BпјҺжӯӨжә¶ж¶ІдёӯKClзҡ„иҙЁйҮҸеҲҶж•°дёә CпјҺ25 в„ғж—¶пјҢйҘұе’ҢKClжә¶ж¶Ізҡ„жө“еәҰе°ҸдәҺ4.0 molВ·LпјҚ1 DпјҺе°ҶжӯӨжә¶ж¶Іи’ёеҸ‘йғЁеҲҶж°ҙпјҢеҶҚжҒўеӨҚеҲ°20 в„ғж—¶пјҢжә¶ж¶ІеҜҶеәҰдёҖе®ҡеӨ§дәҺ1.174 gВ·cmпјҚ3
|
|
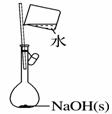
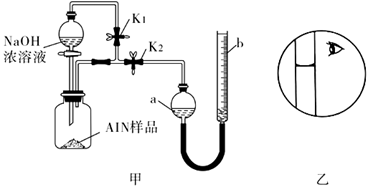
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
ж°®еҢ–й“қ( AlN)жҳҜдёҖз§Қж–°еһӢж— жңәйқһйҮ‘еұһжқҗж–ҷпјҢеёёжё©дёӢAlN +NaOH+H2O=NaAlO2+NH3вҶ‘гҖӮжҹҗиҜҫйўҳе°Ҹз»„еҲ©з”Ёз”ІеӣҫжүҖзӨәиЈ…зҪ®жөӢе®ҡж ·е“ҒдёӯAlNзҡ„еҗ«йҮҸпјҲжқӮиҙЁдёҚеҸҚеә”пјүгҖӮдёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү AпјҺйҮҸж°”з®Ўдёӯзҡ„ж¶ІдҪ“еә”дёәж°ҙ BпјҺз”Ёй•ҝйўҲжјҸж–—д»ЈжӣҝеҲҶж¶ІжјҸж–—пјҢжңүеҲ©дәҺжҺ§еҲ¶еҸҚеә”йҖҹзҺҮ CпјҺеҸҚеә”з»“жқҹж—¶пјҢaгҖҒbдёӨз®Ўж¶Ійқўзҡ„е·®еҖјеҚідёәдә§з”ҹж°”дҪ“зҡ„дҪ“з§Ҝ DпјҺиӢҘе…¶е®ғж“ҚдҪңеқҮжӯЈзЎ®пјҢе®һйӘҢз»“жқҹж—¶жҢүд№ҷеӣҫиҜ»ж•°пјҢжөӢеҫ—AlNеҗ«йҮҸеҒҸй«ҳ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
дёӢеҲ—дҫқжҚ®е®һйӘҢж“ҚдҪңеҸҠзҺ°иұЎеҫ—еҮәзҡ„з»“и®әжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү
|
|||||||||||||||||||||
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷ13.6gCuе’ҢCu2Oз»„жҲҗзҡ„ж··еҗҲзү©еҠ е…Ҙ250mlдёҖе®ҡжө“еәҰзҡ„зЁҖзЎқй…ёдёӯпјҢеӣәдҪ“е®Ңе…Ёжә¶и§Јз”ҹжҲҗCu(NO3)2е’ҢNOгҖӮеҗ‘жүҖеҫ—жә¶ж¶ІдёӯеҠ е…Ҙ1.0L 0.5molвҖўL-1зҡ„NaOHжә¶ж¶ІпјҢз”ҹжҲҗжІүж·Җзҡ„иҙЁйҮҸдёә19.6gпјҢжӯӨж—¶жә¶ж¶Іе‘ҲдёӯжҖ§пјҢдё”йҮ‘еұһзҰ»еӯҗжІүж·Җе®Ңе…ЁгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺеҺҹеӣәдҪ“ж··еҗҲзү©дёӯпјҢCuе’ҢCu2Oзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә1вҲ¶1В В В BпјҺеҺҹзЁҖзЎқй…ёзҡ„жө“еәҰдёә1.3molВ·L-1 CпјҺдә§з”ҹзҡ„NOзҡ„дҪ“з§Ҝдёә2.24LВ В В В В В В В В В В В В В В В В В В В В В В В В В В DпјҺеҸҚеә”еҗҺеү©дҪҷзЎқй…ёзҡ„зү©иҙЁзҡ„йҮҸдёә0.1mol
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү AпјҺй’ дёҺ CuSO4 жә¶ж¶ІеҸҚеә”пјҡ2Na + Cu2+ = 2Na+ + Cu BпјҺFe3O4жә¶дәҺи¶ійҮҸзЁҖHNO3пјҡFe3O4пјӢ8HпјӢ===Fe2пјӢпјӢ2Fe3пјӢпјӢ4H2O CпјҺзўій…ёж°ўй’ҷжә¶ж¶ІдёӯеҠ е…Ҙе°‘йҮҸзҡ„ж°ўж°§еҢ–й’ жә¶ж¶ІпјҡCa2++HCO3пјҚ + OHпјҚ=CaCO3вҶ“+H2O DпјҺеҗ‘NaHSO4жә¶ж¶Ідёӯж»ҙе…ҘBa (OH)2жә¶ж¶ІиҮідёӯжҖ§пјҡHпјӢ+SO42пјҚ+Ba2++OHпјҚ = BaSO4 вҶ“+H2O
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ | |||
|
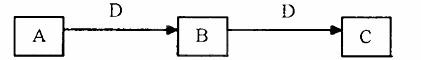
в… пјҺжҹҗж··еҗҲзү©зҡ„ж°ҙжә¶ж¶Іе‘Ҳж— иүІпјҢеҸҜиғҪеҗ«жңүд»ҘдёӢзҰ»еӯҗдёӯзҡ„иӢҘе№Із§ҚпјҡKпјӢгҖҒCa2пјӢгҖҒFe3пјӢгҖҒNH4+гҖҒClпјҚгҖҒCO32пјҚе’ҢSO42пјҚгҖӮзҺ°жҜҸж¬ЎеҸ–10.00mLиҝӣиЎҢе®һйӘҢпјҡ пјҲ1пјүc(CO32пјҚ)=______molВ·LвҲ’1пјӣ пјҲ2пјүжҹҗеҗҢеӯҰи®ӨдёәиҜҘжә¶ж¶ІдёӯдёҖе®ҡеӯҳеңЁKпјӢпјҢжө“еәҰиҢғеӣҙжҳҜ_________________пјӣ пјҲ3пјүж №жҚ®д»ҘдёҠе®һйӘҢпјҢжҹҗзҰ»еӯҗеҸҜиғҪеӯҳеңЁгҖӮжЈҖйӘҢиҜҘзҰ»еӯҗжҳҜеҗҰеӯҳеңЁзҡ„ж–№жі•жҳҜ _________________________________________________________________гҖӮ в…ЎпјҺе·ІзҹҘAгҖҒBгҖҒCжҳҜдёӯеӯҰеҢ–еӯҰеёёи§Ғзү©иҙЁпјҢе®ғ们еңЁдёҖе®ҡжқЎд»¶дёӢжңүеҰӮдёӢиҪ¬еҢ–е…ізі»пјҡВ
В В пјҲ4пјүиӢҘDжҳҜе…·жңүж°§еҢ–жҖ§зҡ„еҚ•иҙЁпјҢAе…ғзҙ еұһдәҺзҹӯе‘Ёжңҹдё»ж—ҸйҮ‘еұһе…ғзҙ пјҢеҲҷCдёҺж°ҙеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡВ _________________________________________________________В пјӣ иӢҘиҜҘеҸҚеә”дёӯз”өеӯҗиҪ¬з§»дәҶ2molпјҢж¶ҲиҖ—дәҶ_______molCгҖӮ пјҲ5пјүВ иӢҘDжҳҜйҮ‘еұһпјҢCжә¶ж¶ІеңЁиҙ®еӯҳж—¶еә”еҠ е…Ҙе°‘йҮҸDпјҢе…¶зҗҶз”ұВ ______В пјҲз”ЁзҰ»еӯҗж–№зЁӢејҸиҜҙжҳҺпјүпјӣ пјҲ6пјүиӢҘDжҳҜз©әж°”иҙЁйҮҸж—ҘжҠҘдёӯйҮҚзӮ№е…іжіЁзҡ„ж°”дҪ“пјҢзӣёеҗҢжқЎд»¶дёӢе…¶еҜҶеәҰжҳҜж°§ж°”зҡ„дёӨеҖҚпјҢAжҳҜзғ§зўұжә¶ж¶ІпјҢеҲҷеҸҜд»ҘйӘҢиҜҒBжҳҜеҗҰеҸҳиҙЁзҡ„дёҖз»„иҜ•еүӮжҳҜ_________________пјҲеҶҷеҢ–еӯҰејҸпјүпјҢиӢҘе·ІйғЁеҲҶеҸҳиҙЁеҲҷе®һйӘҢзҺ°иұЎдёәВ ___________________________________________В гҖӮ
|
||||
| 18. | иҜҰз»ҶдҝЎжҒҜ | |||
|
пјҲ1пјүй«ҳй“Ғй…ёй’ҫ(K2FeO4)жҳҜдёҖз§Қж–°еһӢгҖҒй«ҳж•ҲгҖҒеӨҡеҠҹиғҪж°ҙеӨ„зҗҶеүӮгҖӮжҹҗеӯҰд№ е°Ҹз»„и®ҫи®ЎеҰӮдёӢж–№жЎҲеҲ¶еӨҮй«ҳй“Ғй…ёй’ҫпјҡ
в‘ й«ҳй“Ғй…ёй’ҫдёӯй“Ғе…ғзҙ зҡ„еҢ–еҗҲд»·дёә_______пјҢжҚ®жӯӨжҺЁжөӢе®ғе…·жңүзҡ„еҢ–еӯҰжҖ§иҙЁжҳҜ_________гҖӮ в‘Ўе…¶дёӯ第дёҖжӯҘж“ҚдҪңжҳҜпјҡеңЁNaClOжә¶ж¶ІдёӯеҠ е…Ҙзғ§зўұеӣәдҪ“еҪўжҲҗејәзўұжҖ§зҺҜеўғпјҢе°Ҷз ”зЈЁиҝҮзҡ„зЎқй…ёй“Ғе°‘йҮҸеӨҡж¬Ўең°еҠ е…ҘдёҠиҝ°жә¶ж¶ІдёӯпјҢеҶ°ж°ҙжөҙдёӯеҸҚеә”1 hгҖӮеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә________________________________________________________гҖӮ в‘ўй«ҳй“Ғй…ёй’ҫе’Ңж°ҙеҸ‘з”ҹеҸҚеә”пјҢз”ҹжҲҗзү©иғҪеҗёйҷ„жқӮиҙЁеҮҖж°ҙпјҢеҗҢж—¶иҝҳдә§з”ҹж°”дҪ“пјҢеҶҷеҮәеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲ2пјүжҹҗFe2(SO4)3ж ·е“Ғеҗ«жңүе°‘йҮҸFeSO4жқӮиҙЁпјҢдёәдәҶжөӢе®ҡиҜҘж ·е“Ғдёӯй“Ғе…ғзҙ зҡ„еҗ«йҮҸпјҢи®ҫи®ЎеҰӮдёӢе®һйӘҢпјҡ в… пјҺз§°еҸ–ж ·е“Ғm gпјҢеҠ е…ҘзЁҖH2SO4пјҢеҗҺеҠ ж°ҙй…ҚеҲ¶жҲҗ250.00 mLжә¶ж¶Іпјӣ в…ЎпјҺеҸ–25.00 mLжә¶ж¶ІпјҢе…ҲеҠ е…ҘиҜ•еүӮH2O2пјҢ然еҗҺеҶҚеҠ иҝҮйҮҸзҡ„ж°Ёж°ҙпјҢиҝҮж»Өпјӣ в…ўпјҺе°ҶжІүж·Җз”Ёи’ёйҰҸж°ҙжҙ—ж¶Өж•°ж¬ЎеҗҺпјҢзғҳе№Іпјӣ в…ЈпјҺзҒјзғ§иҮіиҙЁйҮҸдёҚеҶҚеҮҸе°‘дёәжӯўпјҢеҫ—еҲ°зәўжЈ•иүІеӣәдҪ“пјҢеҶ·еҚҙеҗҺз§°йҮҸпјҢиҙЁйҮҸдёәn gгҖӮ иҜ·ж №жҚ®дёҠйқўж“ҚдҪңжөҒзЁӢпјҢеӣһзӯ”д»ҘдёӢй—®йўҳпјҡ в‘ жӯҘйӘӨв… й…ҚеҲ¶жә¶ж¶Із”ЁеҲ°зҡ„д»ӘеҷЁжңүжүҳзӣҳеӨ©е№ігҖҒзғ§жқҜгҖҒзҺ»з’ғжЈ’пјҢиҝҳиҰҒиЎҘе……зҡ„зҺ»з’ғд»ӘеҷЁжҳҜ_________________________________гҖӮ в‘ЎжӯҘйӘӨв…ЎеҠ е…ҘиҜ•еүӮH2O2пјҢе…¶дё»иҰҒзӣ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘ўжӯҘйӘӨв…ўдёӯжЈҖйӘҢиҜҘжІүж·Җе·Із»Ҹжҙ—ж¶Өе№ІеҮҖзҡ„ж“ҚдҪңжҳҜ______________________________гҖӮ
|
||||
| 19. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||
|
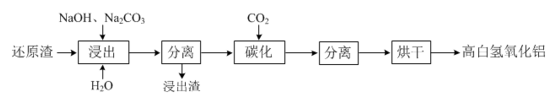
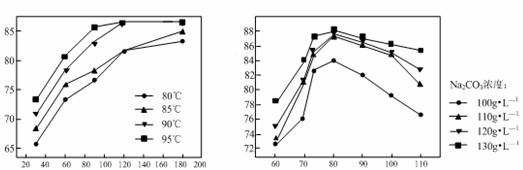
ж–°жі•й“қзғӯзӮјй•Ғе·ҘиүәиҺ·еҫ—йҮ‘еұһй•Ғзҡ„еҗҢж—¶еҫ—еҲ°еҜҢеҗ«CaOвҖў2Al2O3зҡ„иҝҳеҺҹжёЈ(еҗ«е°‘йҮҸAlгҖҒMgOеҸҠе…¶д»–дёҚжә¶жҖ§жқӮиҙЁ)пјҢеҲ©з”ЁиҝҳеҺҹжёЈеҸҜжҸҗеҸ–й«ҳйҷ„еҠ еҖјзҡ„й«ҳзҷҪж°ўж°§еҢ–й“қпјҢе…¶е·ҘиүәжөҒзЁӢеҰӮдёӢпјҡ
В еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)вҖңеҲҶзҰ»вҖқж“ҚдҪңзҡ„еҗҚз§°дёәВ _______ В гҖӮ (2)зўіеҢ–ж—¶жүҖеҠ иҜ•еүӮCO2зҡ„з”өеӯҗејҸдёә_____пјҢиҝҮйҮҸCO2вҖңзўіеҢ–вҖқж—¶зҡ„зҰ»еӯҗж–№зЁӢејҸдёәВ _____В В гҖӮ (3)е®һйӘҢе®ӨжЁЎжӢҹз ”з©¶дёҚеҗҢжөёеҮәжё©еәҰдёӢж—¶й—ҙеҜ№ж°§еҢ–й“қжөёеҮәзҺҮзҡ„еҪұе“ҚеҰӮеӣҫ1пјҢдёҚеҗҢзўій…ёй’ жө“еәҰж—¶ж°ўж°§еҢ–й’ жө“еәҰеҜ№ж°§еҢ–й“қжөёеҮәзҺҮзҡ„еҪұе“ҚеҰӮеӣҫ2гҖӮ Al2O3 жөё еҮә зҺҮ В пј… Al2O3 жөё еҮә зҺҮ В пј…
В В в‘ жңҖйҖӮе®ңзҡ„жөёеҮәжё©еәҰе’Ңж—¶й—ҙдёә______ В (еЎ«зј–еҸ·)гҖӮ AпјҺ85в„ғгҖҒ180minВ В В В В В В BпјҺ95в„ғгҖҒ90minВ В В В В CпјҺ90в„ғгҖҒ120minВ В В В В В В DпјҺ95в„ғгҖҒ120minВ В в‘Ўзўій…ёй’ жә¶ж¶Іжө“еәҰе°ҸдәҺ110gвҖўLвҲ’1ж—¶пјҢж°§еҢ–й“қжөёеҮәзҺҮдёӢйҷҚжҳҺжҳҫгҖӮе·ІзҹҘдёӢеҲ—еҸҚеә”дјҡдҪҝе·Іжә¶ и§ЈдәҺжә¶ж¶Ідёӯзҡ„еҒҸй“қй…ёй’ йҮҚж–°еӣһеҲ°еӣәзӣёпјҡ 3Ca(OH)2 + 2NaAlO2 + 4H2O = 3CaOвҖўA12O3вҖў6H2O + 2NaOHпјҢ еҲҷзўій…ёй’ еңЁжөёеҮәиҝҮзЁӢзҡ„дё»иҰҒдҪңз”ЁжҳҜ__________________________________________гҖӮ
|
|||||||||||||||
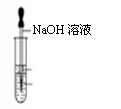
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
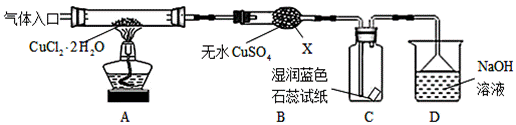
CuClе№ҝжіӣеә”з”ЁдәҺеҢ–е·Ҙе’ҢеҚ°жҹ“зӯүиЎҢдёҡпјӣжҹҗз ”з©¶жҖ§еӯҰд№ е°Ҹз»„жӢҹзғӯеҲҶи§ЈCuCl2вҖў2H2OеҲ¶еӨҮCuClпјҢ
иҜҘе°Ҹз»„з”ЁеҰӮеӣҫжүҖзӨәиЈ…зҪ®иҝӣиЎҢе®һйӘҢпјҲеӨ№жҢҒд»ӘеҷЁз•Ҙпјүпјӣ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүд»ӘеҷЁXзҡ„еҗҚз§°жҳҜВ В В В В В В В В В В В В В В В пјҲ2пјүе®һйӘҢж“ҚдҪңзҡ„е…ҲеҗҺйЎәеәҸжҳҜв‘ вҶ’______вҶ’______вҶ’______вҶ’в‘Ө в‘ жЈҖжҹҘиЈ…зҪ®зҡ„ж°”еҜҶжҖ§еҗҺеҠ е…ҘиҚҜе“ҒВ В В В В В В В в‘ЎзҶ„зҒӯй…’зІҫзҒҜпјҢеҶ·еҚҙ в‘ўеңЁвҖңж°”дҪ“е…ҘеҸЈвҖқеӨ„йҖҡе№ІзҮҘHClВ В В В В В В В В в‘ЈзӮ№зҮғй…’зІҫзҒҜпјҢеҠ зғӯВ в‘ӨеҒңжӯўйҖҡе…ҘHClпјҢ然еҗҺйҖҡе…ҘN2 пјҲ3пјүеңЁе®һйӘҢиҝҮзЁӢдёӯпјҢи§ӮеҜҹеҲ°Bдёӯзү©иҙЁз”ұзҷҪиүІеҸҳдёәи“қиүІпјҢеҲҷCдёӯиҜ•зәёзҡ„йўңиүІеҸҳеҢ–жҳҜ______ ж №жҚ®иө„ж–ҷдҝЎжҒҜеҲҶжһҗпјҡ в‘ЎиӢҘжқӮиҙЁжҳҜCuOпјҢеҲҷдә§з”ҹзҡ„еҺҹеӣ еҸҜиғҪжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲ5пјүиӢҘmе…ӢCuCl2вҖў2H2Oе…ЁйғЁиҪ¬еҢ–дёәCuOпјҲй“ңе…ғзҙ ж— жҚҹиҖ—пјүпјҢеҲҷеӣәдҪ“иҙЁйҮҸеҮҸе°‘_____е…ӢгҖӮ
|
|
- й«ҳдёҖеҢ–еӯҰдёҠеҶҢеҚ•е…ғжөӢиҜ•иҖғйўҳеҗҢжӯҘи®ӯз»ғ
- 2018иҮі2019е№ҙй«ҳдәҢеҗҺеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲз”ҳиӮғзңҒжӯҰеЁҒ第еҚҒе…«дёӯеӯҰпјү
- 2019-2020е№ҙй«ҳдёҖдёҠеҶҢжңҹдёӯиҖғиҜ•еҢ–еӯҰиҖғйўҳпјҲжІіеҚ—зңҒе‘ЁеҸЈдёӯиӢұж–ҮеӯҰж Ўпјү
- е®үйҳіеёӮй«ҳдёүеҢ–еӯҰ2018е№ҙдёҠеҶҢжңҲиҖғжөӢйӘҢе…Қиҙ№иҜ•еҚ·
- й№ӨеІ—еёӮ2018е№ҙй«ҳдёҖдёҠеҶҢеҢ–еӯҰжңҹдёӯиҖғиҜ•е®Ңж•ҙиҜ•еҚ·
- еӨҜеҹәжҸҗиғҪй«ҳдёүеҢ–еӯҰдёҠеҶҢдё“йўҳз»ғд№ ж‘ёеә•иҖғиҜ•йўҳ
- 2018-2019е№ҙй«ҳдёҖдёҠеҶҢ11жңҲд»ҪиҖғиҜ•еҢ–еӯҰдё“йўҳи®ӯз»ғпјҲиҙөе·һзңҒйҒөд№үд№ ж°ҙеҺҝдёҖдёӯпјү
- ж№–еҢ—зңҒйғЁеҲҶйҮҚзӮ№дёӯеӯҰ2020-2021е№ҙй«ҳдәҢдёҠеҚҠе№ҙиҒ”иҖғеҢ–еӯҰйўҳе…Қиҙ№еңЁзәҝжЈҖжөӢ