高一下学期人教版高中化学开学考试
| 1. | 详细信息 |
|
下列物质属于电解质的是( ) A.铜 B.烧碱 C. 食盐水 D.蔗糖
|
|
| 2. | 详细信息 |
|
下列化学方程式中,不能用离子方程式Ba2+ + SO42— = BaSO4↓表示的是( ) A.Ba(NO3)2 +H2SO4= BaSO4↓+2HNO3 B.BaCl2+ Na2SO4= BaSO4↓+2 NaCl C.BaCO3 + H2SO4= BaSO4+ H2O+CO2↑ D.BaCl2+ H2SO4= BaSO4↓+2HCl
|
|
| 3. | 详细信息 |
|
下列说法正确的是( ) A.能电离出H+的化合物叫做酸 B.实验测得1mol某气体体积为22.4L,测定条件一定是标准状况 C.摩尔是七个基本物理量之一 D.化合物分为酸、碱、盐和氧化物是用树状分类法分类的
|
|
| 4. | 详细信息 |
|
下列各组物质,按化合物、单质、混合物的顺序排列的是( ) A.烧碱、液氯、碘酒 C.干冰、铁、氯化氢 D.空气、氮气、胆矾
|
|
| 5. | 详细信息 |
|
同温同压下,同体积的甲乙两种气体的质量比是17:14。若乙气体是CO,则甲气体是( ) A.H2S B.HCl C.NH3 D.Cl2
|
|
| 6. | 详细信息 |
|
下列溶液与20mL 1 mol·L—1 NaNO3溶液中NO3—物质的量浓度相等的是( ) A.10 mL 1 mol·L—1 Mg(NO3)2溶液 B.5 mL 0.8 mol·L—1 Al(NO3)3溶液 C.10 mL 2 mol·L—1 AgNO3溶液 D.10 mL 0.5 mol·L—1 Cu(NO3)2溶液
|
|
| 7. | 详细信息 |
|
下列各组中的离子,能在水溶液中大量共存的是( ) A.K+、H+、SO42—、OH— B.Na+、Ca C.Na+、H+、Cl—、CO32— D.Na+、Cu2+、SO42—、Cl—
|
|
| 8. | 详细信息 |
|
下列离子方程式中,正确的是( ) A.Na2O2溶于水产生O2:Na2O2+H2O===2Na++2OH-+O2↑ B.钠与CuSO4溶液反应:2Na+Cu2+===Cu↓+2Na+ C.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO D.Ba(OH)2溶液与稀H2SO4反应:Ba2++OH-+H++SO42-===BaSO4↓+H2O
|
|
| 9. | 详细信息 |
|
200 ml Fe2(SO4)3溶液中含Fe3+ 5.6g,溶液中SO42—的物质的量浓度是( ) A.0.5mol/L B.0.75 mol/L C.1 mol/L D.0.25 mol/L
|
|
| 10. | 详细信息 |
|
设NA为阿佛加德罗常数,下列说法正确的是( ) ①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA ②同温同压下,体积相同的氢气和氩气所含的原子数相等 ③2.3克Na与O2完全反应,反应中转移的电子数目介于0.1NA与0.2NA之间 ④标准状况下22.4LH2O中分子数为NA ⑤32g O2和O3混合气体中含有原子数为2NA ⑥lmol C12与足量Fe A.①⑤ B.③④⑤ C.①④⑥ D.①②③
|
|
| 11. | 详细信息 |
|
下列有关胶体的说法正确的是( ) A.胶体是纯净物,氢氧化铁胶体带正电 B.胶体与溶液的本质区别是有丁达尔效应 C.将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 D.胶体属于介稳体系
|
|
| 12. | 详细信息 |
|
下列对实验操作和实验事实的描述中不正确的说法共有( )。 ①存放浓硝酸时,使用带玻璃塞的棕色玻璃瓶 ②不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上稀硼酸溶液 ③用托盘天平称量时,所称药品均可放在纸上,并置于天平的左盘 ④金属钠着火时,用干沙覆盖灭火 ⑤将饱和FeCl3溶液滴入煮沸的稀氢氧化钠溶液中制取氢氧化铁胶体 A.2个 B.3个 C.4个 D.5个
|
|
| 13. | 详细信息 |
|
下列关于二氧化硫性质的说法正确的是 ( )
|
|
| 14. | 详细信息 |
|
下列关于物质的检验说法正确的是( ) A.加入硝酸钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子 B.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂 丝蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。 C.待检液加入NaOH溶液,有白色沉淀,则原溶液中有Al3+存在 D.某溶液中滴入KSCN溶液后呈红色,说明该溶液中有Fe2+
|
|
| 15. | 详细信息 |
|
下列反应中,硝酸既表现酸性,又表现氧化性的是( )
|
|
| 16. | 详细信息 |
|
实验室用固态不纯氯化钠(含少量NH4HCO3和Na2SO4杂质)制取纯净氯化钠溶液。下列操作可供选用:①逐滴加入稀盐酸,调节pH值为5;②煮沸;③加蒸馏水溶解;④加热至不再产生气体为止;⑤加入稍过量的Na2CO3溶液;⑥加入稍过量的BaCl2溶液;⑦过滤。上述实验操作的正确顺序应是( ) A. ④③⑥⑤⑦①② B.③④⑥⑤⑦①② C. ①②⑤⑥⑦③④ D.④③⑤⑥⑦②① |
|
| 17. | 详细信息 |
|
由锌、铁、铝、镁四种金属中的 两种组成的混合物10 g,与足量的盐酸反应产生的氢气在标准状况下为11.2 L,则混合物中一定含有的金属是( )
|
|
| 18. | 详细信息 |
|
下列说法正确的是 ( )
|
|
| 19. | 详细信息 |
|
要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为( )
|
|
| 20. | 详细信息 |
|
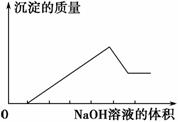
实验室将NaClO3和Na2SO3按物质的量之比2∶1倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为( ) |
|
| 21. | 详细信息 | |||||||||||||||
|
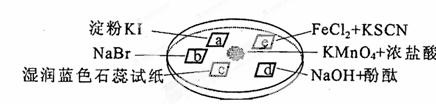
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。 已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O
对实验现象的“解释或结论”正确的是( )
|
||||||||||||||||
| 22. | 详细信息 |
|
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO A.①②④⑥ B.①③④ C.②⑥⑦ D.①②⑤
|
|
| 23. | 详细信息 |
|
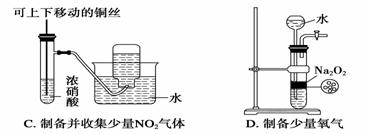
某课外实验小组设计的下列实验合理的是 ( )
|
|
| 24. | 详细信息 |
|
某铁的“氧化物”样品,用5 mol/L盐酸50 mL恰好完全溶解,所得溶液还能吸收标准状况下0.56 L氯气,使其中Fe2+全部转化为Fe3+。该样品可能的化学式是( )
|
|
| 25. | 详细信息 |
|
在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g。(1)混合气体的平均摩尔质量是 (2)此混合物中CO和CO2的物质的量比是 (3)CO的体积分数是 (4)CO的质量分数是 ,(5)C和O的原子个数比是
|
|
| 26. | 详细信息 | ||||||||||||||||||||||||||||||||||||||
|
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情 (1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是
(2)在容量瓶的使用方法中,下列操作不正确的是____________ A.使用容量瓶前检验是否漏水 B.容量瓶用水洗净后,再用待配溶液洗涤 C.配制 D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。 (3)根据计算用托盘天平称取的质量为 g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 0.1mol/L(填“大于”“小于”或“等于”)。 (4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL
|
|||||||||||||||||||||||||||||||||||||||
| 27. | 详细信息 |
|
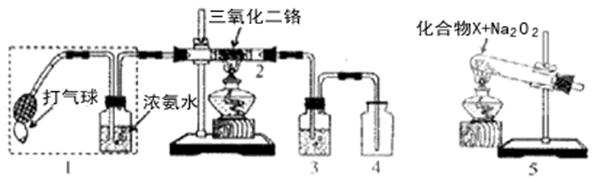
某兴趣小组用下图装置探究氨的催化氧化。 | |
|
| |
| (3) 写出氨催化氧化的化学方程式,并用单线桥表示电子转移的方向和数目 ____ (2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”). 化合物X为_________(只写一种),Na2O2的作用是___________________. | |
| 28. | 详细信息 |
|
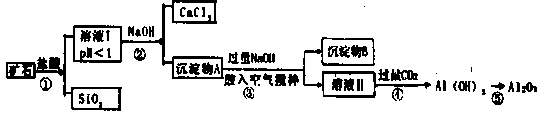
榴石矿石可以看作CaO、FeO、Fe2O3、A12O3、SiO2组成。工业上对其进行综合利用的流程如下: (1)SiO2的用途广泛,试写出其中的一种重要用途 (2)溶液Ⅰ中除了Ca2+外,还含有的金属阳离子有 (3)步骤③中NaOH参加反应的离子方程式是 ,鼓入空气并充分搅拌的目的是 (4)在工业生产中,步骤④的离子方程式是 ,步骤④通入过量CO2而不加入盐酸的原因是 (5)试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与
|
|