2018甘肃高二下学期人教版高中化学开学考试
| 1. | 详细信息 |
|
下列物质中,不属于醇的是( ) A.
|
|
| 2. | 详细信息 |
|
往水中加入下列物质,对水的电离平衡不产生影响的是( ) A. NaHSO4 B. NaI C. KAl(SO4)2 D.CH3COOK
|
|
| 3. | 详细信息 |
|
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是( ) A. CuS的溶解度大于PbS的溶解度 B. 原生铜的硫化物具有还原性,而铜蓝没有还原性 C. CuSO4与ZnS反应的离子方程式是Cu2++S2-===CuS↓ D. 整个过程涉及的反应类型有氧化还原反应和复分解反应
|
|
| 4. | 详细信息 |
|
已知0.1 mol/L的碳酸氢钠溶液的pH为8.4,则下列说法正确的是( ) A. 加入少量NaOH固体,钠离子和碳酸根离子浓度均增大 B. 将该溶液加水稀释, C. c(Na+)+c(H+)=c(HCO3- )+c(CO32 -)+c(OH-) D. c(Na+)=c(HCO3- )+2c(CO32 -)+c(H2CO3)
|
|
| 5. | 详细信息 |
|
5个碳的烷烃的同分异构体共有( ) A. 1种 B. 2种 C. 3种 D. 4种
|
|
| 6. | 详细信息 |
|
甲烷是一种高效清洁的新能源,4g甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列热化学方程式中表示甲烷燃烧热的热化学方程式是( ) A. 1/2CH4(g) + O2(g) = 1/2CO2(g) + H2O(l) ΔH= +445 kJ·mol-1 B. CH4(g) + 2O2(g) = CO2(g) +2H2O(l) ΔH= +890 kJ·mol-1 C. CH4(g) + 2O2(g) = CO2(g) +2H2O(l) ΔH= -890 kJ·mol-1 D. 2CH4(g) + 4O2(g) = 2CO2(g) + 4H2O(l) ΔH= -1780 kJ·mol-1
|
|
| 7. | 详细信息 |
|
下列说法或表示法正确的是( ) A. 氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多 B. 需要加热的反应说明它是吸热反应 C. 在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,若将含0.5molH2SO4的稀硫酸与含1mol NaOH的稀溶液混合,放出的热量等于57.3kJ D. 1molS完全燃烧放热297.3kJ,热化学方程式为:S+O2=SO2 ΔH=297.3kJ·mol-1
|
|
| 8. | 详细信息 |
|
用化学用语解释相关现象正确的是( ) A.BaSO4的水溶液导电性极弱:BaSO4 B.常温下,0.1mol/L的HF溶液的pH>1:HF+H2O C. KHSO4在熔融状态下可导电:KHSO4=K++H++SO42- D.向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH-
|
|
| 9. | 详细信息 |
|
.下列各组中两个化学反应属于同一反应类型的是( ) A. 由苯制溴苯;由乙醇与乙酸反应制乙酸乙酯 B. 由乙烯制 1,2-二溴乙烷;由乙烷制一氯乙烷 C. 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 D. 由苯制硝基苯;由苯制环己烷
|
|
| 10. | 详细信息 |
|
在常温下,将pH=9的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH最接近于( ) A. 9.3 B. 9.7 C. 10 D. 10.7
|
|
| 11. | 详细信息 |
|
A. a > c > d > b B.a > b > c > d C. c > a > b .> d D. b > d > c > a
|
|
| 12. | 详细信息 |
|
.Cu(OH)2在水中存在着如下沉淀溶解平衡:Cu(OH)2(s) A. 2 B. 3 C. 4 D. 5
|
|
| 13. | 详细信息 |
|
某温度下,相同pH 值的盐酸和醋酸溶液分别加水稀释,平衡pH 值随溶液体积变化的曲线如图所示。据图判断正确的是( )
B. b 点溶液的导电性比c 点溶液的导电性强 C. b点酸的总浓度大于a 点酸的总浓度 D. a 点Kw的数值比c点Kw的数值大
|
|
| 14. | 详细信息 |
|
新型肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,其工作原理是N2H4+O2=N2+2H2O,电池放电时,电子由b极经外电路流向a极。下列有关该燃料电池的说法正确的是( ) A. 该装置中,X为N2H4,Y为空气 B. 负极的电极反应式:O2+2H2O+4e-=4OH- C. 电池工作时,b极附近溶液pH升高 D. 若电解质溶液为KOH溶液,则K+由右池通过交换膜向左池迁移
|
|
| 15. | 详细信息 |
|
某温度时,N2+3H2 A. a1/2 B. a-1/2 C. 1/2 a D. a-2
|
|
| 16. | 详细信息 |
|
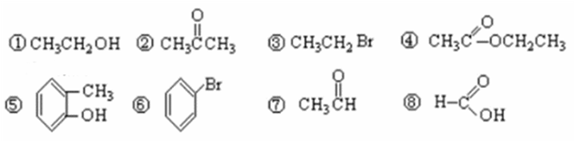
I.有下列8种有机物按要求作答:
(1)按官能团分类,其中属于羧酸的有___________(填序号),属于醇的有_________(填序号); (2)④中所含官能团的名称_______________,⑦中所含官能团结构简式_____________; II.下列各组中的两种有机物,可能是:A.同一物质 B.同系物 C.同分异构体,请判断它们之间的关系(用字母完成填空): (3)2-甲基丁烷和丁烷_______________;(4)正戊烷和新戊烷_________________; (5)
|
|
| 17. | 详细信息 |
|
请你利用所学的化学反应原理解决下列问题: (1)下列溶液在空气中加热蒸干,并且灼烧之后,所得固体仍为原溶液中的溶质的是__________。 A.FeCl3 B.NaClO C.Fe2(SO4)3 D.K2SO3 (2)焙制糕点把NaHCO3作为发酵粉使用,往往添加少量的明矾,就是利用明矾中的Al3+与HCO3-发生双水解,写出离子方程式 ____________________________。 (3)常温下,有0.1mol/L的盐酸,由水电离出的c(H+)= __________ ,该盐酸与0.04mol/L的Ba(OH)2等体积混合,混合后的pH值为________。 (4)常温下,物质的量浓度均为0.1 mol·L-1的下列溶液: ①Na2CO3溶液 ②NaOH溶液 ③CH3COONa溶液 ④NH4Cl溶液 ⑤NaNO3,溶液的pH由大到小的排列顺序是________________________ 。 (5)实验:①0.1 mol·L-1 AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1 KI溶液,出现浑浊;③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。 A. 写出AgCl沉淀溶解平衡方程式______________________。 B. ③中颜色变化说明Ksp(AgCl) ____ Ksp(AgI)(填“>”、“<”、“=”)。
|
|
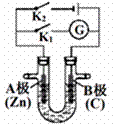
| 18. | 详细信息 |
|
(1)断开K2,闭合K1,若所盛溶液为AgNO3溶液:则A为________极,B(石墨)极的电极反应式为________________。若所盛溶液为海水:则B极的电极反应式为______________________ (2)断开K1,闭合K2,若所盛溶液为滴有酚酞的NaCl溶液,则: A电极附近可观察到的现象是___________________________________, 检验B电极上产生的物质的方法_________________________________________, 该装置中发生的反应化学方程式是___________________________________。
|
|


 ______________
______________