2020湖南人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
下列说法或表示法正确的是 ( ) A.增大压强能够增加活化分子的百分数,从而加快化学反应的速率。 B.由C(s,石墨)=C(s,金刚石);ΔH = +1.19 kJ· mol—1可知,金刚石比石墨稳定 C.在稀溶液中:H+(aq)+OH-(aq)= H2O(l);ΔH=-57.3 kJ· mol—1,若将0.5 mol/L 的H2SO4溶液与1 mol/L的 NaOH溶液等体积混合,放出的热量等于57.3 kJ D.乙醇的燃烧热ΔH= -1366.8 kJ· mol—1,则在25℃、101kPa时,1kg乙醇充分燃烧后放出2.971×104kJ热量
|
|
| 2. | 详细信息 | ||||||||||||||||||||||||||||||
|
下列关于纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是( )
|
|||||||||||||||||||||||||||||||
| 3. | 详细信息 |
|
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH 对于该平衡,下列叙述正确的是( ) A.加入水时,平衡向逆反应方向移动 B.加入少量NaOH固体,平衡向正反应方向移动 C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小 D.加入少量CH3COONa固体,平衡向正反应方向移动
|
|
| 4. | 详细信息 |
|
某反应A + B = C + D 在低温下能自发进行,在高温下不能自发进行,对该反应过程△H、△S的判断正确的是( ) A.△H <0 △S >0 B.△H >0 △S >0 C.△H <0 △S <0 D.△H >0 △S <0
|
|
| 5. | 详细信息 |
|
已知一定温度和压强下,合成氨反应:N2(g)+3H2(g) A.吸收18.4 kJ热量 B.吸收73.6 kJ热量 C.放出18.4 kJ热量 D.放出73.6 kJ热量
|
|
| 6. | 详细信息 |
|
向纯水中加入少量的盐酸(温度不变),则下列说法正确的是( ) A.促进了水的电离 B.c(H+)减小 C.水中c(H+)与c(OH-)的乘积增大 D.c(OH-)减小
|
|
| 7. | 详细信息 | ||||||||
|
高炉炼铁过程中发生反应:
A.由表中数据可判断该反应:反应物的总能量<生成物 的总能量 B.1000℃下Fe2O3与CO反应,t min达到平衡时c(CO)=2×10-3 mol/L,则用CO2表示该反应的平均速率为2×10-3/t mol·L-1·min-1 C.为了使该反应的K增大,可以在其他条件不变时,增大c(CO) D.其他条件不变时,增加Fe2O3的用量,不能有效降低炼铁尾气中CO的含量
|
|||||||||
| 8. | 详细信息 |
|
下列各种溶液中,可能大量共存的离子组是( ) A.pH=1的溶液中:Fe2+、NO3-、SO42-、Cl- B.由水电离出的c(OH-)=1×10-13 mol·L-1的溶液中:Na+、AlO2-、S2-、CO32- C.含有大量Fe3+的溶液中:Na+、SCN-、K+、NO3- D.c(H+)=10-14 mol·L-1的溶液中:Mg2+、NO3-、Fe2+、ClO-
|
|
| 9. | 详细信息 |
|
可逆反应2NO2 ①单位时间内生成n mo1 O2的同时生成2nmol NO2 ②单位时间内生成nmol O2的同时生成2nmolNO ③混合气体的颜色不再改变 ④混合气体的密度不再改变的状态 ⑤混合气体的平均相对分子质量不再改变的状态 A.①③⑤ B.②④⑤ C.①③④ D.①②③④⑤
|
|
| 10. | 详细信息 |
|
下列图象能正确地表达可逆反应3A(g)+B(g)
|
|
| 11. | 详细信息 |
|
在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) A.该反应的ΔH>0 B.若该反应在T1、T2时的平衡常数分别为 K1、 K2,则K1<K2 C.在T2时,若反应体系处于状态D,则此时一定有v正<v逆 D.在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
|
|
| 12. | 详细信息 |
|
体积一定的绝热密闭容器中加入等物质的量的X、Y,进行如下可逆反应: X(g)+Y(g) A.若继续充入X,平衡向正反应方向移动,Y的转化率增大 B.若继续充入Z,平衡逆向移动,Z的体积分数减小 C.若移走部分W,平衡正向移动 D.平衡后移走X,上述反应的ΔH减小
|
|
| 13. | 详细信息 |
|
在298K时,2SO2(g)+O2(g) A.Q2< Q1/2 B.Q2=Q1/2 C.Q2> Q1/2 D.Q1=Q2=197kJ
|
|
| 14. | 详细信息 |
|
下列事实能说明醋酸是弱电解质的是( ) ①醋酸与水能以任意比互溶;②醋酸溶液能导电;③醋酸稀溶液中存在醋酸分子;④常温下,0.1mol/L醋酸的pH比0.1 mol/L盐酸的pH大;⑤醋酸能和碳酸钙反应放出CO2;⑥0.1 mol/L醋酸钠溶液pH=8.9;⑦大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢 A.②⑥⑦ B.③④⑥⑦ C.③④⑤⑥ D.①②
|
|
| 15. | 详细信息 |
|
在25 ℃、1.01×105 Pa下,将22 g CO2通入750 mL 1mol/LNaOH溶液中充分反应,测得反应放出x kJ热量。在该条件下,1 mol CO2通入1mol/L NaOH溶液2 L中充分反应放出y kJ热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是( ) A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x) kJ·mol−1 B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y) kJ·mol−1 C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y) kJ·mol−1 D.2CO2(g)+NaOH(l)=NaHCO3(l) ΔH=-(8x-2y) kJ·mol−1
|
|
| 16. | 详细信息 |
|
酸、碱、盐都是电解质,在水中都能电离出离子。根据下列化合物: ①NaOH ②CH3COOH ③NH4Cl ④NH3·H2O ⑤CH3COONa请回答下列问题: (1)上述几种电解质中属于弱电解质的是 (2)常温下pH=2的CH3COOH溶液中由水电离产生的 c(OH-) = (3)写出CH3COOH的电离方程式 (4)将等pH等体积的NaOH和NH3·H2O分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m n (填“大于、等于或小于”) (5)pH=12的NaOH溶液100mL,要使它的pH为11,如果加0.01mol/L HCl,应加 mL。 (体积变化忽略不计)
|
|
| 17. | 详细信息 |
|
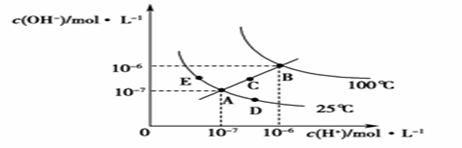
水的电离平衡曲线如图所示,下列说法正确的是 ( )
A.图中五点KW间的关系:B>C>A=D=E B.若从A点到D点,可采用在水中加入少量NaOH的方法 C.若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法 D.若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
|
|
| 18. | 详细信息 |
|
常温下0.1mol•L﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( ) A.将溶液稀释到原体积的2倍 B.加入适量的醋酸钠固体 C.加入等体积0.2 mol•L﹣1盐酸 D.加少量冰醋酸
|
|
| 19. | 详细信息 | ||||||||||||||
|
800℃时,在2 L密闭容器中发生反应:2NO(g)+O2(g)
下列有关说法不正确的是( ) A.用氧气表示0~3 s内该反应的平均速率ν(O2)=0.0025 mol·L-1·s-1 B.容器内颜色保持不变时,说明该反应达到平衡状态 C.增大氧气的浓度,既加快反应速率,又使平衡正向移动 D.该反应达到平衡时,转移电子总数为0.03NA
|
|||||||||||||||
| 20. | 详细信息 | |||||||||||||||||||||||||||||||||||||||||||
|
某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
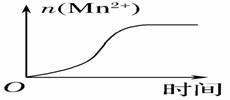
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=_________,T1=_______;通过实验___________可探究出温度变化对化学反应速率的影响。 (2)C组实验中溶液褪色时间t1______(填“>”或“<”)8s,C组实验的反应速率v(KMnO4) = _________________。(用含有t1的式子表示) (3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示, 并以此分析造成n(Mn2+)突变的可能的原因是:______________。
|
||||||||||||||||||||||||||||||||||||||||||||
| 21. | 详细信息 |
|
运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。 I.氨为重要的化工原料,有广泛用途。 (1)合成氨中的氢气可由下列反应制取: a. CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+216.4kJ/mol b. CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2=-41.2kJ/mol
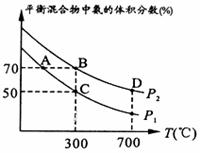
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。 ①恒压时,反应一定达到平衡状态的标志是_____________(填序号) A. C. ②P1_____P2 (填“<”或“>”或“=”或“不确定”,下同);反应的平衡常数:B点_______D点。 ③C点
|
|
| 22. | 详细信息 |
|
氮的化合物在生产、生活中广泛存在。 (1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:
写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。 (2)用焦炭还原NO的反应为:2NO(g)+C(s)
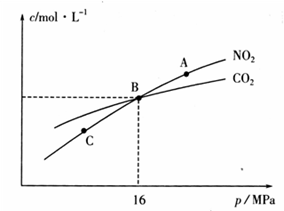
①该反应为________(填“放热”或“吸热”)反应。 ②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。 (3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。 ②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。 ③计算B点时该反应的压强平衡常数Kp(B)=________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
|
|