2017宁夏高二下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
以下能级符号不正确的是( ) A.6s B.2d C.3p D.7f
|
|
| 2. | 详细信息 |
|
构造原理揭示的电子排布能级顺序,实质是各能级能量高低.若以E(nx)表示某能级的能量,以下各式中正确的是( ) ①E(4s)>E(3s)>E(2s)>E(1s) ②E(3d)>E(4s)>E(3p)>E(3s) ③E(5s)>E(4f)>E(4s)>E(3d) ④E(5s)>E(4s)>E(4f)>E (3d) A.①② B.①②④ C.②③④ D.①②③④
|
|
| 3. | 详细信息 |
|
以下对核外电子运动状况的描述正确的是( ) A.同一原子中,2p,3p,4p能级的轨道依次增多,均为哑铃状 B.当碳原子的核外电子排布由 C.3p2表示3p能级有两个轨道 D.在同一能级上运动的电子,其运动状态完全相同
|
|
| 4. | 详细信息 |
|
4p轨道半充满的元素,其原子序数是( ) A.15 B.33 C.35 D.51
|
|
| 5. | 详细信息 |
|
前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有几种( ) A.2 B.3 C.4 D.5
|
|
| 6. | 详细信息 |
|
闪烁着银白色光泽的金属钛Ti因具有密度小、强度大、无磁性等优良的机械性能,被广泛地应用于军事、医学等领域,号称“崛起的第三金属”。已知钛有48Ti、49Ti、50Ti等核素,下列关于金属钛的叙述中不正确的是( ) A.上述钛原子中,中子数不可能为22 B.钛元素在周期表中处于第四周期 C.钛的不同核素在周期表中处于不同的位置 D.钛元素是d区的过渡元素
|
|
| 7. | 详细信息 |
|
下列物质性质的递变关系正确的是( ) A.原子半径:C > Al > Na > K B.碱性:NaOH > KOH > Ca(OH)2 > Mg(OH)2 C.最高正价:Cl > Si > Al > Na D.离子半径:O2- >F - >Al3+ > Mg2+ > Na+
|
|
| 8. | 详细信息 |
|
X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍。有关下列叙述正确的是( ) A.Y的价层电子排布式为3s23p5 B.稳定性:Y的氢化物>Z的氢化物 C.第一电离能:Y﹤Z D.X、Y两元素形成的化合物为离子化合物
|
|
| 9. | 详细信息 |
|
下列有关σ键和π键的说法错误的是( ) A.含有π键的分子在反应时,π键是化学反应的积极参与者 B.当原子形成分子时,首先形成σ键,可能形成π键 C.有些原子在与其他原子形成分子时只能形成σ键,不能形成π键 D.在分子中,化学键可能只有π键,而没有σ键
|
|
| 10. | 详细信息 |
|
下列关于丙烯的说法正确的( ) A.丙烯分子有8个σ键,1个π键 B.丙烯分子中3个碳原子都是sp3杂化 C.丙烯分子不存在非极性键 D.丙烯分子中3个碳原子在同一直线
|
|
| 11. | 详细信息 |
|
下列分子或离子中键角由大到小排列顺序的是( ) ①BCl3 ②NH3 ③H2O ④CH4 ⑤BeCl2 A.⑤④①②③ B.⑤①④②③ C.④①②⑤③ D.③②④①⑤
|
|
| 12. | 详细信息 |
|
已知具有相同价电子数和相同原子数的分子或离子具有相同的结构,这一原理称为“等电子原理”。根据等电子原理,下列各组粒子结构不相似的是( ) A.BCl3和PH3 B.NH4+和CH4 C.NO3-和CO32- D.CO2和N2O
|
|
| 13. | 详细信息 |
|
下列离子的VSEPR模型与其立体构型一致的是( ) A.SO B.ClO C.NO D.ClO
|
|
| 14. | 详细信息 |
|
下列分子或离子中,不含孤电子对的是( ) A.H2O B. H3O+ C. NH3 D. NH4+
|
|
| 15. | 详细信息 |
|
下列分子的空间构型是正四面体形的是( ) ①CH4 ②NH3 ③CF4 ④SiH4 ⑤C2H4 ⑥CO2 A.①②③ B.①③④ C.②④⑤ D.①③⑤
|
|
| 16. | 详细信息 |
|
已知以下反应中的四种物质由三种元素组成,其中a的分子立体构型为正四面体形,组成a物质的两种元素的原子序数之和小于10,组成b物质的元素为第三周期元素。下列判断正确的是( )
A.四种分子中的化学键均是极性键 B.a、c分子中中心原子均采用sp3杂化 C.四种分子中既有σ键,又有π键 D.b、d分子中共价键的键能:b>d
|
|
| 17. | 详细信息 |
|
X,Y,Z是3种短周期元素,其中X,Y位于同一族,Y,Z处于同一周期。X原子的最外层电子排布式是2s22p4,Z原子的核外电子数比Y原子少1。下列说法不正确的是( ) A.CX2(C是原子核内含6个质子的元素)分子是非极性分子 B.ZH3分子的立体构型为平面三角形 C.Z4分子是非极性分子 D.酸H2YO4比酸H3ZO4的酸性强
|
|
| 18. | 详细信息 |
|
下列说法正确的是( ) A.N2、O2和Cl2分子中既含有σ键,又含有π键 B.PCl3分子中,中心原子采取sp3杂化方式 C.CS2、H2O、C2 H2都是直线型分子 D.CH4、CCl4、C6 H6都是只含有极性键的非极性分子
|
|
| 19. | 详细信息 |
|
下列物质的变化,破坏的主要是分子间作用力的是( ) ①碘单质的升华 ②KCl溶于水 ③将液溴加热变为气态 ④NH4Cl受热分解 A.①③ B.②③ C.①④ D.②④
|
|
| 20. | 详细信息 |
|
下列叙述与范德华力无关的是( ) A.气体物质加压或降温时能凝结或凝固 B.通常状况下氯化氢为气体 C.氟、氯、溴、碘单质的熔、沸点依次升高 D.氟、氯、溴、碘的气态氢化物的稳定性越来越弱
|
|
| 21. | 详细信息 |
|
下列有关叙述正确的是( ) A.氢键是一种特殊化学键,它广泛地存在于自然界中 B.在 C.碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 D.含氧酸可用通式(HO) mXOn来表示,若m值越大,则含氧酸的酸性越强
|
|
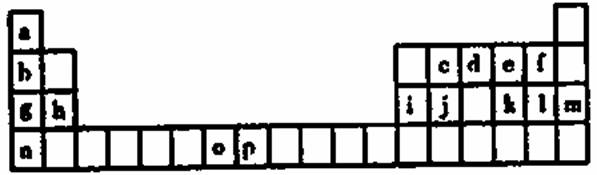
| 22. | 详细信息 | ||||||||||||||
|
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
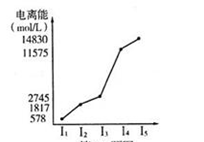
(1)写出元素k的基态原子的电子排布式________________________________,其原子核外有________个未成对电子。 (2)单质c在空气中充分燃烧的产物的分子构型为________ ,中心原子的杂化方式为_______,该分子含有________(填“极性键”或“非极性键”), 该分子是________分子(填“极性”或“非极性”)。 (3)上述元素的最高价氧化物的水化物中,酸性最强的是___________________,碱性最的___________________(填化学式)。(每空1分) (4)d的气态氢化物与d的最高价氧化物的水化物反应的离子方程式是:___________________________________________________________________________________________________________________________________。 (5)o、p两元素的部分电离能数据列于下表:比较两元素的I2、I3可知,气态o2+再失去一个电子比气p2+再失去一个电子困难。对此,你的解是__________________________________________________________________________。
(6)短周期某主族元素的电离能情况如上图所示,则元素是上述周期表的__________元素(填元素符号)。
|
|||||||||||||||
| 23. | 详细信息 | ||||||||||||
|
现有部分元素的性质或原子结构信息如表,据此回答下列问题:
(1)元素X的基态原子核外共有________种空间运动状态不同的电子,元素X与H元素形成的化合物是当今重要的能源,该化合物的电子式为________。 (2)元素Y的价电子排布图为________________,元素Y与元素T相比,电负性较大的是________(用元素符号表示)。 (3)元素Z与元素T相比,非金属性强的是________(用元素符号表示),下列表述中能证明这一事实的是________。 A.常温下Z的单质和T的单质状态不同 C.一定条件下Z和T的单质都能与氢氧化钠溶液反应 B.Z的氢化物比T的氢化物稳定 D.最高价氧化物对应水化物的酸性Z的比T的酸性强 (4)W的价电子排布式为________,稳定性比较:W3+________W2+(填“>”或“<”),原因是__________________________________________________________________________。
|
|||||||||||||
| 24. | 详细信息 |
|
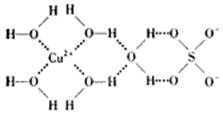
第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。 (1)Cr3+的核外电子排布式为____________________, 配离子 3+中,与Cr3+形成配位键的原子是________(填元素符号)。 (2)NH3是一种很好的配体,氨分子是____________(填“极性”或“非极性”)分子,NH3的沸点_____________(填“高于”、“等于”或“低于”)AsH3。 (3)科学家通过X-射线测得胆矾(CuSO4·5H2O)的结构示意图可简单表示如下: 图中虚线表示的作用力为_______________________;
(4)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,2+为平面正方形结构,呈正四面体结构的原子团是_________,其中心原子的杂化类型是______。 (5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。Ni(CO)4易溶于_________(填标号)。 A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
|
|
| 25. | 详细信息 |
|
A、X、Y、Z、Q、R、T分别代表原子序数依次增大的短周期元素。元素A是原子半径最小的元素;X、Y、Z同周期且相邻,都是蛋白质的组成元素;X、R同族,Q与T原子的最外层电子数之和是R原子最外层电子数的2倍,T单质为淡黄色固体。U是d区元素,U2+的核外最高能级有2对成对电子。请回答下列问题: (1)Y元素在周期表中的位置____________,位于周期表_____区;Q原子的核外电子排布式为________。 (2) X、Y、Z元素的第一电离能由大到小的顺序是________________。 (3)TZ3分子为________分子(填“极性”或“非极性”),YZ2-离子的VSEPR模型名称是________。(每空2分) (4)Z和T的简单气态氢化物稳定性好的是_______(填化学式),原因是________________________________________________________________。 (5) A、X、Z、可形成分子式为A2XZ的有机物,则该化合物分子中B原子的轨道杂化类型是________;1mol该分子中含有π键的数目是________。 (6)通常情况下,U2+的溶液很稳定,它与YH3形成的配位数为6的配离子却不稳定,在空气中易被氧化为配位数不变的+3价配离子.该反应的离子方程式是________________________________________________________________________。
|
|
- 高中化学人教版 必修1 第三章 金属及其化合物 2.几种重要的金属化合物 铁的重要化合物
- 黄金30题系列 高二化学 小题好拿分
- 2016-2017年高一下半期理综化学开学考试(安徽师大附中)
- 高中化学人教版 必修2 第四章 化学与自然资源的开发利用 第一节 开发利用金属矿物和海水资源 海水资源的开发利用
- 2017-2018年高二12月联考化学考试题(河南省豫北重点中学)
- 2016-2017年高一下半年化学开学考试专题训练(广西省桂林市第十八中学)
- 高中化学人教版 选修四 第三章 水溶液中的离子反应 第二节 水的电离和溶液的酸碱性 水的电离和溶液的酸碱性第二课时
- 2016-2017年高一上册化学期中考试考卷带参考答案和解析(山东省淄博市淄川一中)