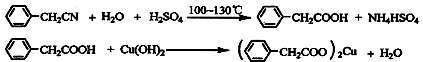2017江西高三下学期人教版高中化学单元测试
| 1. | 详细信息 |
|
设NA为阿伏加德罗常数的数值,下列说法正确的是( ) A.42g丙烯和环丙烷的混合气体中所含极性键的数目为9NA B.12g石墨烯(单层石墨)中含有六元环的数目为0.5NA C.室温下,1L pH=13的NaOH溶液中,由水电离出的OH-的数目为0.1NA D.3.6 g CaO2晶体中阴离子的数目为0.1NA |
|
| 2. | 详细信息 |
|
一定体积的酸性KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.2000 mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为( ) A. 0.0176 B. 0.1600 C.0.1200 D.0.2400 |
|
| 3. | 详细信息 |
|
0.03mol铜完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol.该混合气体的平均相对分子质量可能是( ) A.30 B.46 C.66 D.69 |
|
| 4. | 详细信息 |
|
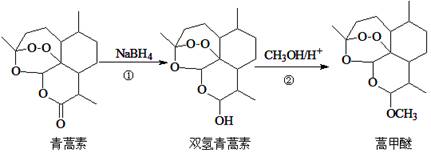
2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖。由青蒿素合成衍生药物蒿 甲醚的合成路线如下:下列说法正确的是( )
C.青蒿素因含酯基具有氧化性和杀菌功能 D.蒿甲醚的化学式为C16H24O5 |
|
| 5. | 详细信息 |
|
下列各组有机物,不管它们以何种比例混合,只要总物质的量一定,则完全燃烧时消耗O2为一恒量的是( ) ①C2H4和C3H6 ②C5H10和C6H6 ③C3H6和C3H8O ④C2H2和C6H6 ⑤C2H5OH和CH3OCH3 A.①④ B.②③⑤ C.③⑤ D.全部 |
|
| 6. | 详细信息 |
|
某溶液中含有两种溶质NaCl和H2SO4,物质的量之比为3:1.用石墨作电极电解溶液,根据电极产物,可明显分为三个阶段.下列叙述不正确的是( ) A.阴极只析出H2 B.阳极先析出Cl2,后析出O2 C.电解最后阶段为电解水 D.溶液pH不断增大,最后为7 |
|
| 7. | 详细信息 |
|
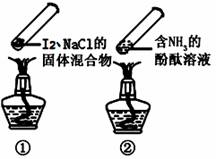
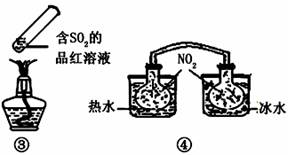
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差 B.加热时,②、③中的溶液均变红,冷却后又都变为无色 C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 D.四个“封管实验”中都有可逆反应发生 |
|
| 8. | 详细信息 |
|
化学与人类的生活、生产息息相关,下列说法正确的是( ) A.BaSO4在医学上用作“钡餐”,Ba2+对人体无害 B.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性 C.光导纤维的主要成分是单质硅,太阳能电池使用的材料是SiO2 D.“地沟油”禁止食用,但可以用来制肥皂或燃油 |
|
| 9. | 详细信息 |
|
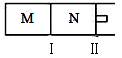
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)
A.若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N) B.若x>3,达到平衡后B的转化率关系为:α(M)>α(N) C.若x<3,C的平衡浓度关系为:c(M)>c(N) D.x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等 |
|
| 10. | 详细信息 |
|
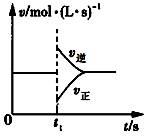
可逆反应2SO2(g)+O2(g)
A.维持温度、容积不变,t1时充入SO3(g) B.维持压强不变,t1时升高反应体系温度 C.维持温度、容积不变,t1时充入一定量Ar D.维持温度、压强不变,t1时充入SO3(g) |
|
| 11. | 详细信息 |
|
常温下,下列各组离子在指定溶液中能大量共存的是( ) A.pH=1的溶液中:Fe2+、NO3-、Na+、SO42- B.水电离出的c(H+)=10-12 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- C.c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl- D.c(Fe3+) =0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- |
|
| 12. | 详细信息 |
|
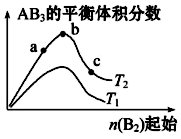
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)
A.达到平衡时A2的转化率大小为:b>a B.a、b、c三点的平衡常数相同 C.若T2>T1,则正反应一定是吸热反应 D.b点时,平衡体系中A、B原子数之比一定是1:1 |
|
| 13. | 详细信息 |
|
温度为T1(T1=25℃)和T2时,水溶液中水的离子积曲线如图所示:下列判断错误的是( ) A.T2>25℃ B.x=1.0×10﹣7 C.KW(a)=KW(d) D.b点溶液呈碱性,c点溶液呈酸性
|
|
| 14. | 详细信息 | ||||||||
|
下表是3种物质在水中的溶解度(20℃),下列说 法中正确的是( )
A.已知MgCO3的Ksp=2.14×10﹣5mol2•L﹣2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)= c(CO32﹣),且c(Mg2+)•c(CO32﹣)=2.14×10﹣5mol2•L﹣2 B.除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 C.将适量的表中的三种物质分别与足量水混合,充分加热、灼烧,最终的固体产物相同 D.用石灰水处理水中的Mg2+和HCO3﹣,发生的离子反应方程式为Mg2++2HCO3﹣+Ca2++2OH﹣═CaCO3↓+MgCO3↓+2H2O |
|||||||||
| 15. | 详细信息 |
|
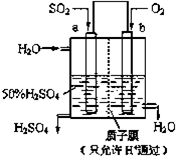
科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )
A.a为正极,b为负极 B.生产过程中a电极质量减轻 C.电子从b极向a极移动 D.负极反应式为:SO2+2H2O﹣2e﹣=SO42﹣+4H+ |
|
| 16. | 详细信息 |
|
下列溶液中有关微粒的物质的量浓度关系正确的是( ) A.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等 B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) C.常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2:三种溶液中NH4+的浓度:②>③>① D.等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后 |
|
| 17. | 详细信息 | ||||||||||||
|
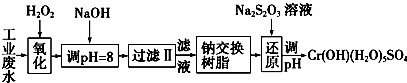
重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放. Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
(1)氧化过程中可代替H2O2加入的试剂是 (填序号). A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4 (2)加入NaOH溶液调整溶液pH=8时,除去的离子是 ;已知钠离子交换树脂的原理: Mn++nNaR﹣→MRn+nNa+,此步操作被交换除去的杂质离子是 . A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+ (3)还原过程中,每消耗0.8mol Cr2O72﹣转移4.8mol e﹣,该反应离子方程式为 . Ⅱ.酸性条件下,六价铬主要以Cr2O72﹣形式存在,工业上常用电解法处理含Cr2O72﹣的废水: 该法用Fe作电极电解含Cr2O72﹣的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生 Cr(OH)3溶液. (4)电解时能否用Cu电极来代替Fe电极? (填“能”或“不能”),理由是 . (5)电解时阳极附近溶液中Cr2O72﹣转化为Cr3+的离子方程式为 . (6)常温下,Cr(OH)3的溶度积Ksp=1×10﹣32,溶液的pH应为 时才能使c(Cr3+)降至 10﹣5 mol•L﹣1. |
|||||||||||||
| 18. | 详细信息 |
|
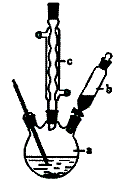
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。 回答下列问题: (1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓 硫酸的先后顺序是 。 (2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温 至130 ℃继续反应。在装置中,仪器b的作用是 ;仪器c的名称是 ,其作用是 。反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是 。下列仪器中可用于分离苯乙酸粗品的是 (填标号)。 A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒 (3)提纯粗苯乙酸的方法是 ,最终得到40 g纯品,则苯乙酸的产率是 (保留3位有效数字)。 (4)用CuCl2• 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是 。 (5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 。 |
|