2018湖北高二上学期人教版高中化学单元测试
| 1. | 详细信息 |
|
化学在生产和日常生活中有着重要的应用。下列说法不正确的是( ) A.明矾水解形成的Al(OH) 3胶体能吸附水中悬浮物,可用于水的净化 B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 C.MgO的熔点很高,可用于制作耐高温材料 D.电解MgCl2饱和溶液,可制得金属镁
|
|
| 2. | 详细信息 |
|
在压强为2.20×104 kPa、温度达到374℃时,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,这就是“水热反应”。生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法不正确的是( ) A.二氧化碳与超临界水作用生成汽油的反应,属于放热反应 B.“水热反应”是一种复杂的化学变化 C.火力发电厂可望利用废热,将二氧化碳转变为能源物质 D.随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环
|
|
| 3. | 详细信息 |
|
常温下,下列各组离子在指定溶液中能大量共存的是( ) A.pH=1的溶液中:Fe2+、NO B.水电离出的c(H+)=10-12 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO C.c(H+)/c(OH-)=1012的水溶液中:NH D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO
|
|
| 4. | 详细信息 |
|
下列离子方程式正确的是( ) A.氯化铵溶液呈酸性:NH4+==NH3+H+ B.氢硫酸的电离:H2S C.向小苏打溶液中加入醋酸溶液: HCO3-+H+ D.在标准状况下,向10 mL 0.1 mol·L-1 FeBr2溶液中通入22.4 mL Cl2: 2Fe2++2Br-+2Cl2==2Fe3++Br2+4Cl-
|
|
| 5. | 详细信息 |
|
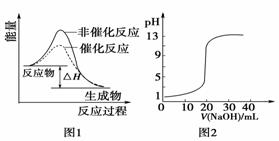
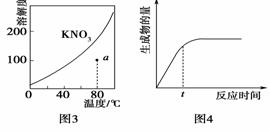
下列图示与对应的叙述相符的是( )
A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 B.图2表示0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1CH3COOH溶液所得 到的滴定曲线 C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 D.图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
|
|
| 6. | 详细信息 |
|
下列依据热化学方程式得出的结论正确的是( ) A.已知C(石墨, s)=C(金刚石,s);ΔH>0,则金刚石比石墨稳定 B.已知C(s)+O2(g)=CO2(g);ΔH1 C(s)+1/2O2(g)=CO(g);ΔH2,则ΔH2>ΔH1 C.已知2H2(g)+O2(g)=2H2O(g);ΔH=—483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=—57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol
|
|
| 7. | 详细信息 |
|
下面有关电化学的图示,完全正确的是( )
|
|
| 8. | 详细信息 |
|
下列说法不正确的是( ) A.配制FeCl2溶液时,可将FeCl2晶体先溶于浓盐酸,再加水稀释和少量铁屑保存 B.输油管道,为防止其表面被腐蚀应涂上隔水材料并与外电源负极相连 C.pH值均为9的NaOH溶液和Na2CO3溶液,两溶液中水的电离程度相同 D.0.1mol/L 弱酸HA溶液与0.05mol/L NaOH溶液等体积混合所得溶液有 2c(H+)+c(HA) = c(A-)+2 c(OH-)
|
|
| 9. | 详细信息 | |||||||||||||||||
|
稀硫酸
|
||||||||||||||||||
| 10. | 详细信息 |
|
有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:①CH3COONa和HCl; ②CH3COONa和NaOH;③CH3COONa和NaCl;④CH3COONa和NaHCO3 ;下列各项排序正确的是( ) A.pH:②>③>④>① B.c(CH3COO-):②>④>③>① C.溶液中c(H+):①>③>②>④ D.c(CH3COOH):①>④>③>②
|
|
| 11. | 详细信息 |
|
在相同的条件下(500℃),有相同体积的甲、乙两容器,甲容器充入1gO2和1gSO2,乙容器充入2gO2和2g SO2 。下列叙述中错误的是:( ) A.化学反应速率:乙>甲 B.平衡时O2的浓度:乙>甲 C.平衡时SO2的转化率:乙>甲 D.平衡时SO2的体积分数:乙>甲
|
|
| 12. | 详细信息 |
|
右图为阳离子交换膜法电解饱和食盐水原理示意图。 A.从E口逸出的气体是H2 B.从B口加入含少量NaOH的水溶液以增强导电性 C.标准状况下每生成22.4 LCl2,便产生2 mol NaOH D.电解一段时间后加适量盐酸可以恢复到电解前的浓度
|
|
| 13. | 详细信息 |
|
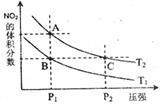
反应N2O4(g)
下列说法正确的是( ) A.A、C两点的反应速率:A>C B.B、C两点的反应速率:B=C C.由状态B到状态A,可以用加热的方法 D.A、C两点气体的颜色:A深,C浅
|
|
| 14. | 详细信息 |
|
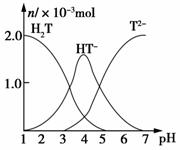
常温下,向20 mL 0.1 mol/L酒石酸(用H2T表示)溶液中逐滴滴加 等物质的量浓度的NaOH溶液。有关微粒的物质的量与混合溶液 的pH有如图关系。下列说法正确的是( ) A.V(NaOH)=10 mL时,溶液中存在 c(Na+)=2c(H2T)+2c(HT-)+2c(T2-) B.V(NaOH)=20mL时,溶液中存在 c(Na+)>c(HT-)>c(H+)>c(H2T)>c(T2-) C.V(NaOH)=30mL时,溶液中存在 c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+) D.V(NaOH)=40mL时,溶液中存在c(OH-)=c(HT-)+2c(H2T)+c(H+)
|
|
| 15. | 详细信息 |
|
用石墨电极电解500mLNaNO3和Cu(NO3)2的混合溶液。通电一段时间后,阴、阳两极逸出的气体在标准状况下的体积分别为11.2L和8.4L,求原溶液中Cu2+的物质的量浓度(假设溶液的体积不变)( ) A.1.25 mol·L-1 B.2.5 mol·L-1 C.0.50 mol·L-1 D.1.0 mol·L-1
|
|
| 16. | 详细信息 |
|
构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( ) A.E(5s)>E(4f)>E(4s)> E(3d) B.E(3d)>E(4s)>E(3p)>E(3s) C.E(4s)<E(3s)<E(2s)<E(1s) D.E(5s)>E(4s)>E(4f)>E(3d)
|
|
| 17. | 详细信息 |
|
下列各基态原子或离子的核外电子排布或电子排布图表示正确的是( ) A.铜原子 1s22s22p63s23p63d94s2 B.氮原子 C.铁原子 1s22s22p63s23p63d8 D.Cl- 1s22s22p63s23p6
|
|
| 18. | 详细信息 |
|
以下对核外电子运动状态的描述正确的是( ) A.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转 B.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动 C.能层序数越大,s电子云的半径越大 D.在同一能级上运动的电子,其运动状态肯定相同
|
|
| 19. | 详细信息 |
|
下列说法中正确的是( ) A.s电子云是在空间各个方向上伸展程度相同的对称形状 B.因为p轨道是“8”字形的,所以p电子是“8”字形 C.L电子层有d轨道 D.2p轨道有一个未成对电子的基态原子和价电子排布为2s22p5的原子是同种元素的原子
|
|
| 20. | 详细信息 |
|
若某原子的外围电子排布式为4d15s2,则下列说法正确的是( ) A.该元素基态原子中共有3个电子 B.该元素原子核外有5个能层 C.该元素原子最外层共有3个电子 D.该元素原子M能层共有8个电子
|
|
| 21. | 详细信息 |
|
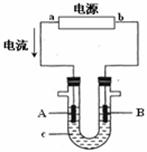
电解原理在化学工业中有广泛应用。下图表示一个电解池, 装有电解液c ;A、B是两块电极板,通过导线与直流电源相连。 请回答以下问题: (1)电源a极为 极。 (2)若A、B都是惰性电极,c是饱和NaCl溶液,实验开始时,同时在 U形管两边各滴入几滴酚酞试液,则: 极(填“A”或 “B”)附近先呈红色;电解饱和NaCl溶液的总反应方程式: 。 (3)若要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液c选用CuSO4溶液,则: ①B电极反应式是 。 ②下列说法正确的是________。 a.电能全部转化为化学能 b.在电解精炼过程中,电解液中伴随有Al3+、Zn2+产生 c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属 (4)用惰性电极电解CuSO4溶液。若阴极析出Cu的质量为12.8 g ,则阳极上产生的气体在标准状况下的体积为 L 。
|
|
| 22. | 详细信息 | ||||||||
|
1)已知:蒸发1mol Br2(l)需要吸收的能量为 30kJ,其他相关数据如下表:
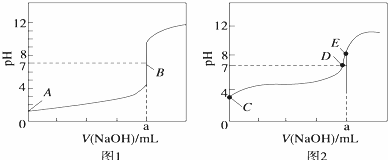
H2(g)+Br2(l)═2HBr(g)△H=____________。 (2)常温下,用0.100 0mol⋅L−1 NaOH溶液分别滴定20.00mL 0.100 0mol⋅L−1 HBr溶液和 20.00mL0.100 0mol⋅L−1 CH3COOH溶液,得到2条滴定曲线,如图1和图2所示:
① 根据图1和图2判断,滴定HBr溶液的曲线是____________(填“图1”或“图2”); ② a=______ mL; ③ c(Na+)=c(CH3COO−)的点是______点; ④ E点对应溶液中离子浓度由大到小的顺序为________________________________。 (3)常温下,将0.02mol⋅L−1 的 Ba(OH)2溶液100mL和0.02mol⋅L−1的NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为___________。 (4)25℃时,Ksp[Mg(OH)2]=5.61×10−12,Ksp[MgF2]=7.42×10−11。该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,___________(填化学式)溶液中的c(Mg2+)大。
|
|||||||||
| 23. | 详细信息 |
|
该反应的影响,以c0mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。 (2)有人利用NH3和NO2构成电池的方法,既能实现有效消除氮氧化物的排放减少环境污染,又能充分利用化学能进行粗铝的精炼,如图B所示,e极为精铝。a极通入______________气体(填化学式)。 (3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下 平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在T2、60MPa下达到平衡。 ①能判断N2(g)+3H2(g) ②若T1、T2、T3温度下的平衡常数分别为K1、K2、K3,则K1、K2、K3由大到小的排序为___________________________。 ③此时N2的平衡分压为__________________MPa。(分压=总压×物质的量分数)
|
|
| 24. | 详细信息 |
|
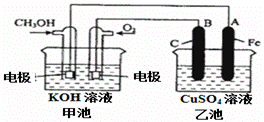
电化学与我们的生活有着密切的联系,请结合电化学知识回答下列有关问题。 (1)炒过菜的铁锅未及时洗净(残液中含有NaCl),不久便会腐蚀而出现红棕色锈斑。试回答: 铁锅的锈蚀属于___(填“析氢腐蚀”或“吸氧腐蚀”),铁锅锈蚀的负极反应式为:____________;正负极反应产物会继续发生反应,最终生成的红棕色锈斑的主要成分是________(填化学式)。 (2)下图是一个电化学过程的示意图。
① 甲池是______装置,通CH3OH一极的电极反应式为__________________________。 ② 乙池中反应的化学方程式为____________。如果开始加入的CuSO4溶液足量,当乙池中A(Fe)极的质量增加3.2g时,甲池中消耗O2______mL(标准状况下)。
|
|
| 25. | 详细信息 |
|
某基态原子的3p轨道上有一个电子的自旋方向与3p轨道上其他电子的自旋方向相反,该元素名称是________,它的电子排布式为______________________,所有电子排布共占据______个原子轨道。该原子中能量最高的电子的原子轨道的空间取向为__________,该原子轨道呈现______形。画出它的离子结构示意图 。
|
|
| 26. | 详细信息 | ||||||||||
|
现有部分前36号元素的性质或原子结构如下表:
(1)写出R元素单质的电子式_______________。 (2)S元素基态原子的价电子排布图为__________________。 (3)T元素元素名称为_______。 (4)X的电子排布图违背了___________。用X单质、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:_____________。
|
|||||||||||


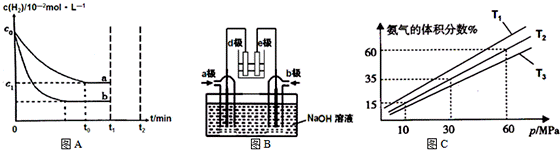 氨气在工业上有广泛用途.请回答以下问题:
氨气在工业上有广泛用途.请回答以下问题: