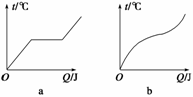2019й«ҳдәҢдёӢеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҰӮеӣҫжҳҜaгҖҒbдёӨз§ҚдёҚеҗҢзү©иҙЁзҡ„зҶ”еҢ–жӣІзәҝпјҢдёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜВ В В В В В В В (гҖҖВ В )
в‘ aжҳҜжҷ¶дҪ“гҖҖв‘ЎaжҳҜйқһжҷ¶дҪ“гҖҖв‘ўbжҳҜжҷ¶дҪ“гҖҖв‘ЈbжҳҜйқһжҷ¶дҪ“ AпјҺв‘ в‘ЈВ В В В В В В BпјҺв‘Ўв‘ЈВ В В В В В CпјҺв‘ в‘ўВ В В В В В DпјҺв‘Ўв‘ў
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…ізҹіеўЁжҷ¶дҪ“зҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (гҖҖ гҖҖ) AпјҺз”ұдәҺзҹіеўЁжҷ¶дҪ“еҜјз”өпјҢжүҖд»Ҙе®ғжҳҜйҮ‘еұһжҷ¶дҪ“В В BпјҺз”ұдәҺзҹіеўЁзҡ„зҶ”зӮ№еҫҲй«ҳпјҢжүҖд»Ҙе®ғжҳҜеҺҹеӯҗжҷ¶дҪ“ CпјҺз”ұдәҺзҹіеўЁиҙЁиҪҜпјҢжүҖд»Ҙе®ғжҳҜеҲҶеӯҗжҷ¶дҪ“В В В В В В DпјҺзҹіеўЁжҷ¶дҪ“жҳҜдёҖз§Қж··еҗҲжҷ¶дҪ“
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
жөӢзҹҘж°ҜеҢ–й’ жҷ¶дҪ“дёӯзӣёйӮ»зҡ„NaпјӢдёҺClпјҚзҡ„и·қзҰ»дёәa cmпјҢиҜҘжҷ¶дҪ“еҜҶеәҰдёәd gВ·cmпјҚ3пјҢеҲҷйҳҝдјҸеҠ еҫ·зҪ—еёёж•°еҸҜиЎЁзӨәдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (гҖҖ гҖҖ) A.
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёӯпјҢжӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (В В В В ) AпјҺеҶ°иһҚеҢ–ж—¶пјҢеҲҶеӯҗдёӯHвҖ”Oй”®еҸ‘з”ҹж–ӯиЈӮ BпјҺеҺҹеӯҗжҷ¶дҪ“дёӯпјҢе…ұд»·й”®и¶ҠејәпјҢзҶ”зӮ№и¶Ҡй«ҳ CпјҺеҲҶеӯҗжҷ¶дҪ“дёӯпјҢе…ұд»·й”®й”®иғҪи¶ҠеӨ§пјҢиҜҘеҲҶеӯҗжҷ¶дҪ“зҡ„зҶ”гҖҒжІёзӮ№дёҖе®ҡи¶Ҡй«ҳ DпјҺеҲҶеӯҗжҷ¶дҪ“дёӯпјҢеҲҶеӯҗй—ҙдҪңз”ЁеҠӣи¶ҠеӨ§пјҢиҜҘзү©иҙЁи¶ҠзЁіе®ҡ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ідәҺSiO2жҷ¶дҪ“зҡ„еҸҷиҝ°дёӯпјҢжӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В (гҖҖ гҖҖ) AпјҺйҖҡеёёзҠ¶еҶөдёӢпјҢ60 g SiO2жҷ¶дҪ“дёӯеҗ«жңүзҡ„еҲҶеӯҗж•°дёәNA(NAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°) BпјҺ60 g SiO2жҷ¶дҪ“дёӯпјҢеҗ«жңү2NAдёӘSiвҖ”Oй”® CпјҺжҷ¶дҪ“дёӯдёҺеҗҢдёҖзЎ…еҺҹеӯҗзӣёиҝһзҡ„4дёӘж°§еҺҹеӯҗеӨ„дәҺеҗҢдёҖеӣӣйқўдҪ“зҡ„4дёӘйЎ¶зӮ№ DпјҺSiO2жҷ¶дҪ“дёӯеҗ«жңү1дёӘзЎ…еҺҹеӯҗпјҢ2дёӘж°§еҺҹеӯҗ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„жҷ¶дҪ“зү©иҙЁдёӯпјҢеҢ–еӯҰй”®зұ»еһӢзӣёеҗҢпјҢжҷ¶дҪ“зұ»еһӢд№ҹзӣёеҗҢзҡ„жҳҜВ В В В В В В (гҖҖ гҖҖ) в‘ SiO2е’ҢSO3гҖҖв‘Ўжҷ¶дҪ“зЎје’ҢHClгҖҖв‘ўCO2е’ҢSO2гҖҖв‘Јжҷ¶дҪ“зЎ…е’ҢйҮ‘еҲҡзҹігҖҖв‘Өжҷ¶дҪ“ж°–е’Ңжҷ¶дҪ“ж°® в‘ҘзЎ«й»„е’Ңзўҳ AпјҺв‘ в‘Ўв‘ўВ В В В В В В В BпјҺв‘Јв‘Өв‘ҘВ В В В В В В CпјҺв‘ўв‘Јв‘ҘВ В В В В В В В В В DпјҺв‘ в‘ўв‘Ө
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺйҮ‘еұһй”®зҡ„еҸҷиҝ°дёӯпјҢдёҚжӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В (гҖҖ гҖҖ) AпјҺйҮ‘еұһй”®жҳҜйҮ‘еұһйҳізҰ»еӯҗе’ҢиҮӘз”ұз”өеӯҗиҝҷдёӨз§ҚеёҰејӮжҖ§з”өиҚ·зҡ„еҫ®зІ’й—ҙзҡ„ејәзғҲзӣёдә’дҪңз”ЁпјҢе…¶е®һиҙЁдёҺзҰ»еӯҗй”®зұ»дјјпјҢд№ҹжҳҜдёҖз§Қз”өжҖ§дҪңз”Ё BпјҺйҮ‘еұһй”®еҸҜд»ҘзңӢдҪңжҳҜи®ёеӨҡеҺҹеӯҗе…ұз”Ёи®ёеӨҡз”өеӯҗжүҖеҪўжҲҗзҡ„ејәзғҲзҡ„зӣёдә’дҪңз”ЁпјҢжүҖд»ҘдёҺе…ұд»·й”®зұ»дјјпјҢд№ҹжңүж–№еҗ‘жҖ§е’ҢйҘұе’ҢжҖ§ CпјҺйҮ‘еұһй”®жҳҜеёҰејӮжҖ§з”өиҚ·зҡ„йҮ‘еұһйҳізҰ»еӯҗе’ҢиҮӘз”ұз”өеӯҗй—ҙзҡ„зӣёдә’дҪңз”ЁпјҢж•…йҮ‘еұһй”®ж— йҘұе’ҢжҖ§е’Ңж–№еҗ‘жҖ§ DпјҺжһ„жҲҗйҮ‘еұһй”®зҡ„иҮӘз”ұз”өеӯҗеңЁж•ҙдёӘйҮ‘еұһеҶ…йғЁзҡ„дёүз»ҙз©әй—ҙдёӯеҒҡиҮӘз”ұиҝҗеҠЁ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺйҮ‘еұһжҷ¶дҪ“е’ҢзҰ»еӯҗжҷ¶дҪ“зҡ„иҜҙжі•дёӯй”ҷиҜҜзҡ„жҳҜВ В В В В В В В В В В В В В В В В В (гҖҖ гҖҖ) AпјҺйғҪеҸҜйҮҮеҸ–вҖңзҙ§еҜҶе Ҷз§ҜвҖқзҡ„з»“жһ„В В В В В В В В В В В В В В В В BпјҺйғҪеҗ«зҰ»еӯҗ CпјҺдёҖиҲ¬е…·жңүиҫғй«ҳзҡ„зҶ”зӮ№е’ҢжІёзӮ№В В В В В В В В В В В В В В В В В В DпјҺйғҪиғҪеҜјз”ө
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
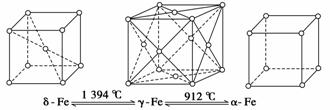
еҰӮдёӢеӣҫпјҢй“ҒжңүОҙгҖҒОігҖҒОұдёүз§ҚеҗҢзҙ ејӮеҪўдҪ“пјҢдёүз§Қжҷ¶дҪ“еңЁдёҚеҗҢжё©еәҰдёӢиғҪеҸ‘з”ҹиҪ¬еҢ–гҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (гҖҖгҖҖ)
AпјҺОіВӯFeжҷ¶дҪ“дёӯдёҺжҜҸдёӘй“ҒеҺҹеӯҗи·қзҰ»зӣёзӯүдё”жңҖиҝ‘зҡ„й“ҒеҺҹеӯҗжңү6дёӘ BпјҺОұВӯFeжҷ¶дҪ“дёӯдёҺжҜҸдёӘй“ҒеҺҹеӯҗи·қзҰ»зӣёзӯүдё”жңҖиҝ‘зҡ„й“ҒеҺҹеӯҗжңү6дёӘ CпјҺе°Ҷй“ҒеҠ зғӯеҲ°1 500 в„ғеҲҶеҲ«жҖҘйҖҹеҶ·еҚҙе’Ңзј“ж…ўеҶ·еҚҙпјҢеҫ—еҲ°зҡ„жҷ¶дҪ“зұ»еһӢзӣёеҗҢ DпјҺдёүз§ҚеҗҢзҙ ејӮеҪўдҪ“зҡ„жҖ§иҙЁзӣёеҗҢ
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||
|
ж №жҚ®дёӢеҲ—еҮ з§Қзү©иҙЁзҡ„зҶ”зӮ№е’ҢжІёзӮ№ж•°жҚ®пјҢеҲӨж–ӯдёӢеҲ—жңүе…іиҜҙжі•дёӯпјҢй”ҷиҜҜзҡ„жҳҜ(гҖҖ гҖҖ)
жіЁпјҡAlCl3зҶ”зӮ№еңЁ2.02Г—105 PaжқЎд»¶дёӢжөӢе®ҡгҖӮ AпјҺSiCl4жҳҜеҲҶеӯҗжҷ¶дҪ“В В В В В В В В В В В BпјҺеҚ•иҙЁBжҳҜеҺҹеӯҗжҷ¶дҪ“ CпјҺAlCl3еҠ зғӯиғҪеҚҮеҚҺВ В В В В В В В В В В DпјҺMgCl2жүҖеҗ«зҰ»еӯҗй”®зҡ„ејәеәҰжҜ”NaClеӨ§
|
|||||||||||||||||||
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁеӣәжҖҒж—¶зҶ”зӮ№зҡ„жҜ”иҫғжӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В (гҖҖВ В ) AпјҺF2>Cl2>Br2В В В В В В В В В В В В В В В В В В В В В В В BпјҺйҮ‘еҲҡзҹі>P4>O2 CпјҺS>HBr>йҮ‘еҲҡзҹіВ В В В В В В В В В В В В В В В В В В В DпјҺI2>CH4>еҶ°
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҷ¶дҪ“дёӯз”ұеҺҹеӯҗзӣҙжҺҘжһ„жҲҗзҡ„еҚ•иҙЁжңүВ В В В В В В В В В В В (гҖҖ гҖҖ) AпјҺйҮ‘еұһй’ҫВ В В В В В В В В В В В BпјҺж°ўж°”В В В В В В В В В В CпјҺйҮ‘еҲҡзҹі В В В В В В В В В В В В DпјҺзҷҪзЈ·
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ідәҺеҗҢжё©еҗҢеҺӢдёӢзӯүдҪ“з§Ҝзҡ„CO2е’ҢCOпјҢдёӢеҲ—еҸҷиҝ°пјҡпјҲ1пјүиҙЁйҮҸзӣёзӯү (2)еҜҶеәҰзӣёзӯү (3)жүҖеҗ«еҲҶеӯҗж•°зӣёзӯүпјҲ4пјүжүҖеҗ«зўіеҺҹеӯҗж•°зӣёзӯүпјҢе…¶дёӯжӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В пјҲВ В В В пјү A.(1)(2)(3)(4)В В В В В В В B. (2)(3)(4)В В В В В В В В C.(3)(4)В В В В В В В D.(3)
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
ж ҮеҮҶзҠ¶еҶөдёӢпјҢдёӨз§Қж°”дҪ“зҡ„дҪ“з§ҜзӣёзӯүпјҢеҲҷВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲВ В В пјү A. жүҖеҗ«еҺҹеӯҗж•°дёҖе®ҡзӣёзӯүВ В В В B.зү©иҙЁзҡ„йҮҸдёҖе®ҡзӣёеҗҢ В В В В C.иҙЁйҮҸдёҖе®ҡзӣёеҗҢВ В В В D.еҜҶеәҰдёҖе®ҡзӣёеҗҢ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ | ||
|
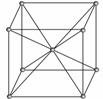
е…ідәҺй’ҫеһӢжҷ¶иғһз»“жһ„(еҰӮеӣҫ)зҡ„еҸҷиҝ°дёӯжӯЈзЎ®зҡ„жҳҜВ В В В В В (гҖҖ гҖҖ) AпјҺжҳҜеҜҶзҪ®еұӮзҡ„дёҖз§Қе Ҷз§Ҝж–№ејҸВ В В В В В В BпјҺжҷ¶иғһжҳҜе…ӯжЈұжҹұВ В В В В В В В В В В В В В В В В В В CпјҺжҜҸдёӘжҷ¶иғһеҶ…еҗ«2дёӘеҺҹеӯҗВ В В В В В В В В DпјҺжҜҸдёӘжҷ¶иғһеҶ…еҗ«6дёӘеҺҹеӯҗВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В
|
|||
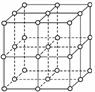
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
В еҰӮеӣҫжүҖзӨәдёҖдәӣжҷ¶дҪ“дёӯзҡ„жҹҗдәӣз»“жһ„пјҢе®ғ们еҲҶеҲ«жҳҜNaClгҖҒCsClгҖҒе№ІеҶ°гҖҒйҮ‘еҲҡзҹігҖҒзҹіеўЁз»“жһ„дёӯзҡ„жҹҗдёҖз§Қзҡ„жҹҗдёҖйғЁеҲҶпјҡ
(1)д»ЈиЎЁйҮ‘еҲҡзҹізҡ„жҳҜ(еЎ«зј–еҸ·еӯ—жҜҚпјҢдёӢеҗҢ)________пјҢе…¶дёӯжҜҸдёӘзўіеҺҹеӯҗдёҺ________дёӘзўіеҺҹеӯҗжңҖжҺҘиҝ‘дё”и·қзҰ»зӣёзӯүгҖӮйҮ‘еҲҡзҹіеұһдәҺ________жҷ¶дҪ“гҖӮ (2)д»ЈиЎЁзҹіеўЁзҡ„жҳҜ________пјҢе…¶дёӯжҜҸдёӘжӯЈе…ӯиҫ№еҪўеҚ жңүзҡ„зўіеҺҹеӯҗж•°е№іеқҮдёә________дёӘгҖӮ (3)иЎЁзӨәNaClзҡ„жҳҜ________пјҢжҜҸдёӘNaпјӢе‘ЁеӣҙдёҺе®ғжңҖжҺҘиҝ‘дё”и·қзҰ»зӣёзӯүзҡ„NaпјӢжңү________дёӘгҖӮ (4)д»ЈиЎЁCsClзҡ„жҳҜ________пјҢе®ғеұһдәҺ________жҷ¶дҪ“пјҢжҜҸдёӘCsпјӢдёҺ________дёӘClпјҚзҙ§йӮ»гҖӮ (5)д»ЈиЎЁе№ІеҶ°зҡ„жҳҜ________пјҢе®ғеұһдәҺ________жҷ¶дҪ“пјҢжҜҸдёӘCO2еҲҶеӯҗдёҺ________дёӘCO2еҲҶеӯҗзҙ§йӮ»гҖӮ (6)е·ІзҹҘзҹіеўЁдёӯзўізўій”®зҡ„й”®й•ҝжҜ”йҮ‘еҲҡзҹідёӯзўізўій”®зҡ„й”®й•ҝзҹӯпјҢеҲҷдёҠиҝ°дә”з§Қзү©иҙЁзҶ”зӮ№з”ұй«ҳеҲ°дҪҺзҡ„жҺ’еҲ—йЎәеәҸ дёә________________________________________гҖӮВ В В В В В В
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
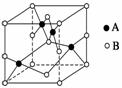
еҰӮеӣҫпјҢзӣҙзәҝдәӨзӮ№еӨ„зҡ„еңҶеңҲдёәNaClжҷ¶дҪ“дёӯNaпјӢжҲ–ClпјҚжүҖеӨ„зҡ„дҪҚзҪ®пјҢ иҝҷдёӨз§ҚзҰ»еӯҗеңЁз©әй—ҙдёүдёӘдә’зӣёеһӮзӣҙзҡ„ж–№еҗ‘дёҠйғҪжҳҜзӯүи·қзҰ»жҺ’еҲ—зҡ„гҖӮ
NaClжҷ¶дҪ“з»“жһ„зӨәж„ҸеӣҫгҖӮ(2еҲҶ) В (2)жҷ¶дҪ“дёӯпјҢеңЁжҜҸдёӘNaпјӢзҡ„е‘ЁеӣҙдёҺе®ғжңҖжҺҘиҝ‘зҡ„дё”и·қзҰ»зӣёзӯүзҡ„NaпјӢе…ұжңү________дёӘгҖӮ(2еҲҶ) (3)жҷ¶дҪ“дёӯжҜҸдёҖдёӘйҮҚеӨҚзҡ„з»“жһ„еҚ•е…ғеҸ«жҷ¶иғһгҖӮеңЁNaClжҷ¶иғһдёӯжӯЈе…ӯйқўдҪ“зҡ„йЎ¶зӮ№дёҠгҖҒйқўдёҠгҖҒжЈұдёҠзҡ„NaпјӢжҲ–ClпјҚдёәиҜҘжҷ¶иғһдёҺе…¶зӣёйӮ»зҡ„жҷ¶иғһжүҖе…ұжңүпјҢдёҖдёӘжҷ¶иғһдёӯClпјҚзҡ„дёӘж•°зӯүдәҺ________пјҢеҚі(еЎ«и®Ўз®—ејҸ)_____В _____пјӣNaпјӢзҡ„дёӘж•°зӯүдәҺ________пјҢеҚі(еЎ«и®Ўз®—ејҸ)_________В В В В В В __гҖӮ(4еҲҶ) (4)и®ҫNaClзҡ„ж‘©е°”иҙЁйҮҸдёәMr gВ·molпјҚ1пјҢйЈҹзӣҗжҷ¶дҪ“зҡ„еҜҶеәҰдёәПҒ gВ·cmпјҚ3пјҢйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјдёәNAгҖӮйЈҹзӣҗжҷ¶дҪ“дёӯдёӨдёӘи·қзҰ»жңҖиҝ‘зҡ„й’ зҰ»еӯҗдёӯеҝғй—ҙзҡ„и·қзҰ»дёә______cmгҖӮ(2еҲҶ)
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
(1)еҶҷеҮәеҹәжҖҒCuпјӢзҡ„ж ёеӨ–з”өеӯҗжҺ’еёғејҸпјҡ____________пјӣCгҖҒNгҖҒOдёүз§Қе…ғзҙ зҡ„第дёҖ з”өзҰ»иғҪз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜ_____________________________________ (2)еҰӮеӣҫжҳҜй“ңзҡ„жҹҗз§Қж°§еҢ–зү©зҡ„жҷ¶иғһзӨәж„ҸеӣҫпјҢиҜҘж°§еҢ–зү©зҡ„еҢ–еӯҰејҸдёә__________гҖӮ (3)еҗ‘зЎ«й…ёй“ңжә¶ж¶Ідёӯж»ҙеҠ ж°Ёж°ҙдјҡз”ҹжҲҗи“қиүІжІүж·ҖпјҢеңЁж»ҙеҠ ж°Ёж°ҙиҮіжІүж·ҖеҲҡеҘҪе…ЁйғЁжә¶и§Јж—¶еҸҜеҫ—еҲ°и“қиүІжә¶ж¶ІпјҢ 继з»ӯеҗ‘е…¶дёӯеҠ е…ҘжһҒжҖ§иҫғе°Ҹзҡ„д№ҷйҶҮеҸҜд»Ҙз”ҹжҲҗж·ұи“қиүІзҡ„[Cu(NH3)4]SO4В·H2OжІүж·ҖгҖӮиҜҘж·ұи“қиүІжІүж·Җдёӯзҡ„NH3 йҖҡиҝҮ ________й”®дёҺдёӯеҝғзҰ»еӯҗCu2пјӢз»“еҗҲпјӣNH3еҲҶеӯҗдёӯNеҺҹеӯҗзҡ„жқӮеҢ–ж–№ејҸжҳҜ_____________________пјӣ дёҺNH3еҲҶеӯҗдә’дёәзӯүз”өеӯҗдҪ“зҡ„дёҖз§Қеҫ®зІ’жҳҜ____________(д»»еҶҷдёҖз§Қ)гҖӮ (4)CuOзҡ„зҶ”зӮ№жҜ”CuClзҡ„зҶ”зӮ№________(еЎ«вҖңй«ҳвҖқжҲ–вҖңдҪҺвҖқ)гҖӮ (5)CuOеңЁй«ҳжё©дёӢжҳ“иҪ¬еҢ–дёәCu2OпјҢе…¶еҺҹеӣ жҳҜ________________________________гҖӮ
|
|
- еҗүе®үеёӮй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•иҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- й«ҳдёҖеҢ–еӯҰдёӢеҶҢеҚ•е…ғжөӢиҜ•ж‘ёеә•иҖғиҜ•йўҳеҗҢжӯҘи®ӯз»ғ
- йІҒ科зүҲйҖүжӢ©жҖ§еҝ…дҝ®1第2з« еҢ–еӯҰеҸҚеә”зҡ„ж–№еҗ‘гҖҒйҷҗеәҰдёҺйҖҹзҺҮ第3иҠӮеҢ–еӯҰеҸҚеә”зҡ„йҖҹзҺҮ
- 2019еұҠй«ҳдёүеҢ–еӯҰйўҳејҖеҚ·жңүзӣҠпјҲйҷ•иҘҝзңҒиҘҝе®үеёӮпјү
- еӣӣе·қй«ҳдәҢеҢ–еӯҰ2018е№ҙдёҠеҶҢжңҲиҖғжөӢйӘҢиҜ•еҚ·еёҰи§ЈжһҗеҸҠзӯ”жЎҲ
- дёҙй«ҳеҺҝдёҙй«ҳдёӯеӯҰй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•еңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ
- жҷҜеҫ·й•ҮдёҖдёӯй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•иҖғиҜ•е®Ңж•ҙзүҲ
- 2018-2019е№ҙй«ҳдёҖдёҠеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲеҶ…и’ҷеҸӨиҮӘжІ»еҢәе‘је’Ңжө©зү№еёӮ第е…ӯдёӯеӯҰпјү