дёҙй«ҳеҺҝдёҙй«ҳдёӯеӯҰй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•еңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ
| 1. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁжҢүз…§й…ёгҖҒзўұгҖҒзӣҗзҡ„йЎәеәҸжҺ’еҲ—зҡ„жҳҜ( ) A.зЎ«й…ёгҖҒзәҜзўұгҖҒйЈҹзӣҗ B.ж¬Ўж°Ҝй…ёгҖҒзғ§зўұгҖҒзЎ«й…ёй“ң C.зўій…ёгҖҒж°§еҢ–й“ҒгҖҒзўій…ёй’ D.йҶӢй…ёгҖҒзҶҹзҹізҒ°гҖҒиӢӣжҖ§й’ |
|
| 2. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҜҸз»„зү©иҙЁдёӯеҗ«жңүзҡ„еҢ–еӯҰй”®зұ»еһӢзӣёеҗҢзҡ„жҳҜ( ) AпјҺNaClгҖҒHClгҖҒH2OгҖҒNaOH BпјҺCl2гҖҒNa2SгҖҒHClгҖҒSO2 CпјҺHBrгҖҒCO2 гҖҒH2OгҖҒCS2 DпјҺNa2O2гҖҒH2O2гҖҒH2OгҖҒO3 |
|
| 3. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іеҢ–еӯҰз”ЁиҜӯиЎЁзӨәжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A. B.иҙЁеӯҗж•°дёә53гҖҒдёӯеӯҗж•°дёә78зҡ„зўҳеҺҹеӯҗпјҡ C.N2зҡ„з»“жһ„ејҸпјҡNвүЎN D.H2O2зҡ„з”өеӯҗејҸпјҡ |
|
| 4. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
иҠӮж—ҘзҮғж”ҫзҡ„дә”еҪ©зјӨзә·зҡ„зғҹиҠұдёҺй«ҳдёӯеҢ–еӯҰдёӯвҖңз„°иүІиҜ•йӘҢвҖқзҹҘиҜҶзӣёе…ігҖӮдёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A.з„°иүІиҜ•йӘҢжҳҜеҢ–еӯҰеҸҳеҢ– B.з”ЁзЁҖзӣҗй…ёжё…жҙ—еҒҡз„°иүІиҜ•йӘҢзҡ„й“Ӯдёқ(жҲ–й“Ғдёқ) C.з„°иүІиҜ•йӘҢеқҮеә”йҖҸиҝҮи“қиүІй’ҙзҺ»з’ғи§ӮеҜҹ D.з„°иүІиҜ•йӘҢеҸҜеҢәеҲҶNaClдёҺNa2CO3еӣәдҪ“ |
|
| 5. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ( ) A.2gH2еҗ«2molH B.еңЁе‘ЁжңҹиЎЁзҡ„иҝҮжёЎе…ғзҙ дёӯеҜ»жүҫеҚҠеҜјдҪ“жқҗж–ҷ C.2molH2Oзҡ„ж‘©е°”иҙЁйҮҸжҳҜ1molH2Oж‘©е°”иҙЁйҮҸзҡ„дёӨеҖҚ D.1HгҖҒ2HгҖҒ 3Hдә’дёәеҗҢзҙ ејӮеҪўдҪ“ |
|
| 6. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жә¶ж¶Ідёӯжә¶иҙЁзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә1molВ·LпјҚ1зҡ„жҳҜ(гҖҖгҖҖ) A.е°Ҷ40gж°ўж°§еҢ–й’ жә¶и§ЈдәҺ1Lж°ҙдёӯ B.е°Ҷ22.4Lж°ҜеҢ–ж°ўж°”дҪ“жә¶дәҺж°ҙй…ҚжҲҗ1Lжә¶ж¶І C.е°Ҷ1L10molВ·LпјҚ1зҡ„жө“зӣҗй…ёдёҺ9Lж°ҙж··еҗҲ D.е°Ҷ10.6gзўій…ёй’ жә¶и§ЈдәҺж°ҙеҫ—еҲ°100mLжә¶ж¶І |
|
| 7. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗе…ғзҙ йҳізҰ»еӯҗпјҲXпјӢпјүзҡ„иҙЁйҮҸж•°дёә23пјҢеҺҹеӯҗж ёеҶ…жңү12дёӘдёӯеӯҗпјҢиҜҘйҳізҰ»еӯҗзҡ„ж ёеӨ–з”өеӯҗж•°дёә A.13 B.12 C.11 D.10 |
|
| 8. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
иҝҗз”Ёе…ғзҙ е‘ЁжңҹеҫӢеҲҶжһҗдёӢйқўзҡ„жҺЁж–ӯпјҢе…¶дёӯдёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A.HBrO4зҡ„й…ёжҖ§жҜ”HIO4зҡ„й…ёжҖ§ејұ B.й’ дёҺж°ҙеҸҚеә”жҜ”й”Ӯ(Li)дёҺж°ҙеҸҚеә”еү§зғҲ C.з №(At2)еҚ•иҙЁдёәжңүиүІеӣәдҪ“пјҢAgAtйҡҫжә¶дәҺж°ҙд№ҹдёҚжә¶дәҺзЁҖзЎқй…ё D.еңЁж°§ж°”дёӯпјҢй“·(Rb)зҡ„зҮғзғ§дә§зү©жҜ”й’ зҡ„зҮғзғ§дә§зү©жӣҙеӨҚжқӮ |
|
| 9. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ( ) A.Fe(OH)3иғ¶дҪ“еҸҜд»ҘйҖҸиҝҮж»Өзәё B.ж°ҜеҢ–й’ жә¶ж¶ІеҸҜд»Ҙдә§з”ҹдёҒиҫҫе°”ж•Ҳеә” C.BaSO4дёәејәз”өи§ЈиҙЁ D.ејәз”өи§ЈиҙЁзҡ„еҜјз”өиғҪеҠӣдёҖе®ҡжҜ”ејұз”өи§ЈиҙЁзҡ„ејә |
|
| 10. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁNAиЎЁзӨәйҳҝдјҸеҫ·зҪ—еёёж•°пјҢдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ ( ) A. ж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4LH2Oеҗ«жңүзҡ„еҲҶеӯҗж•°дёә1 NA B. еёёжё©еёёеҺӢдёӢ,1.06g Na2CO3еҗ«жңүзҡ„Na+зҰ»еӯҗж•°дёә0.01NA C. ж ҮеҮҶзҠ¶еҶөдёӢпјҢ1 NAдёӘCO2еҲҶеӯҗеҚ жңүзҡ„дҪ“з§ҜеӨ§зәҰдёә22.4L D. зү©иҙЁзҡ„йҮҸжө“еәҰдёә0.6mol/Lзҡ„MgCl2жә¶ж¶ІдёӯпјҢеҗ«жңүCl- дёӘж•°дёә1.2 NAдёӘ |
|
| 11. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е®һйӘҢе®Өз”ЁдёӢеҲ—дёӨз§Қж–№жі•еҲ¶ж°Ҝж°”пјҡв‘ з”Ёеҗ«жңүHCl4mol зҡ„жө“зӣҗй…ёдёҺи¶ійҮҸзҡ„MnO2еҸҚеә”пјҢв‘Ўз”Ё1molMnO2дёҺи¶ійҮҸзҡ„жө“зӣҗй…ёеҸҚеә”гҖӮжүҖеҫ—зҡ„ж°Ҝж°”( ) A.в‘ жҜ”в‘ЎеӨҡ B.в‘ЎжҜ”в‘ еӨҡ C.дёҖж ·еӨҡ D.ж— жі•жҜ”иҫғ |
|
| 12. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
жңүе…іж°Ҝж°”е’Ңж°Ҝж°ҙжҖ§иҙЁзҡ„еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜ(гҖҖгҖҖ) A.еҗ‘FeCl2жә¶ж¶Ідёӯж»ҙеҠ ж°Ҝж°ҙпјҢжә¶ж¶ІйўңиүІеҸҳжҲҗжЈ•й»„иүІпјҢиҜҙжҳҺж°Ҝж°ҙдёӯеҗ«жңүHClO B.йҘұе’Ңж°Ҝж°ҙд№…зҪ®ж—¶ClпјҚеўһеӨҡпјҢй…ёжҖ§еўһејә C.иҝҮйҮҸзҡ„й“ҒеңЁж°Ҝж°”дёӯзҮғзғ§еҸҜз”ҹжҲҗж°ҜеҢ–дәҡй“Ғ D.з”ЁpHиҜ•зәёж— жі•жөӢе®ҡеҮәж°Ҝж°ҙзҡ„pH |
|
| 13. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёӢеҲ—жә¶ж¶ІдёӯеҠ е…ҘKSCNжә¶ж¶ІпјҢжә¶ж¶ІдёҚдјҡжҳҫзәўиүІзҡ„жҳҜ(гҖҖгҖҖ) A.еҠ е…Ҙи¶ійҮҸй“ҒзІүеҗҺзҡ„Fe2(SO4)3жә¶ж¶І B.FeеңЁCl2дёӯзҮғзғ§жүҖеҫ—дә§зү©зҡ„ж°ҙжә¶ж¶І C.й•ҝжңҹжҡҙйңІеңЁз©әж°”дёӯзҡ„з»ҝзҹҫжә¶ж¶І D.еҠ е…Ҙй«ҳй”°й…ёй’ҫжә¶ж¶ІеҗҺзҡ„FeSO4жә¶ж¶І |
|
| 14. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||
дёӢиЎЁжҳҜйғЁеҲҶзҹӯе‘Ёжңҹе…ғзҙ зҡ„еҺҹеӯҗеҚҠеҫ„еҸҠдё»иҰҒеҢ–еҗҲд»·гҖӮ
|
|||||||||||||||||||
| 15. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
ж №жҚ®иҰҒжұӮеӣһзӯ”дёӢеҲ—й—®йўҳгҖӮ в‘ CaBr2гҖҖв‘ЎH2OгҖҖв‘ўNH4ClгҖҖв‘ЈH2O2гҖҖв‘ӨNa2O2гҖҖв‘ҘCa(OH)2гҖҖв‘ҰHClOгҖҖ⑧CO2 (1)еҶҷеҮәNa2O2зҡ„з”өеӯҗејҸ________пјҢеӯҳеңЁзҡ„еҢ–еӯҰй”®зұ»еһӢжңү________________гҖӮ (2)еҶҷеҮәHClOз”өеӯҗејҸ________________,еҶҷеҮәCO2зҡ„з»“жһ„ејҸ_______гҖӮ (3)еҗ«жңүе…ұд»·й”®зҡ„зҰ»еӯҗеҢ–еҗҲзү©жҳҜ_______(еЎ«еәҸеҸ·) (4)з”Ёз”өеӯҗејҸиЎЁзӨәCaBr2зҡ„еҪўжҲҗиҝҮзЁӢ_________________________________ гҖӮ |
|
| 16. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
3CuпјӢ8HNO3(зЁҖ)пјқ3Cu(NO3)2пјӢ2NOвҶ‘пјӢ4H2O (1)иҝҳеҺҹдә§зү©дёә______пјҢзЁҖHNO3дҪ“зҺ°зҡ„жҖ§иҙЁ______гҖӮиҝҳеҺҹеүӮе’Ңж°§еҢ–еүӮзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”_____гҖӮ (2)жҜҸеҪ“з”ҹжҲҗ1molзҡ„NOпјҢиҪ¬з§»зҡ„з”өеӯҗж•°зӣ®дёә_____дёӘгҖӮ |
|
| 17. жҺЁж–ӯйўҳ | иҜҰз»ҶдҝЎжҒҜ |
д»ҘдёӢжҳҜе…ғзҙ е‘ЁжңҹиЎЁдёӯеүҚ18еҸ·жҹҗз§ҚйҮ‘еұһе…ғзҙ еҜ№еә”зҡ„еҚ•иҙЁеҸҠе…¶еҢ–еҗҲзү©д№Ӣй—ҙзҡ„иҪ¬еҢ–е…ізі»(вҖңвҶ’вҖқжүҖжҢҮзҡ„иҪ¬еҢ–йғҪжҳҜдёҖжӯҘе®ҢжҲҗ)гҖӮ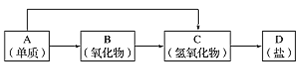 (1)иӢҘBдёәе‘јеҗёйқўе…·дёӯзҡ„дҫӣж°§еүӮпјҢе…¶дҫӣж°§ж—¶жҜҸз”ҹжҲҗ1molO2пјҢеҸҚеә”иҝҮзЁӢдёӯиҪ¬з§»зҡ„з”өеӯҗж•°дёә_____пјҢAдёҺFeCl3жә¶ж¶ІеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ________________________гҖӮ (2)еҶҷеҮәдёҖдёӘвҖңCвҶ’DвҖқиҪ¬еҢ–зҡ„еҢ–еӯҰж–№зЁӢејҸ_________________________________ гҖӮ |
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
е·Ҙдёҡеёёз”ЁFeCl3жә¶ж¶Іи…җиҡҖйҷ„еңЁз»қзјҳжқҝдёҠзҡ„й“ңз®”пјҢеҲ¶йҖ еҚ°еҲ·з”өи·ҜжқҝгҖӮ (1)еҶҷеҮәFeCl3жә¶ж¶ІдёҺйҮ‘еұһй“ңеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ____________________ (2)жҹҗе°Ҹз»„йҮҮеҸ–дёӢеҲ—жӯҘйӘӨд»ҺдҪҝз”ЁиҝҮзҡ„и…җиҡҖеәҹж¶Ідёӯеӣһ收й“ңпјҢ并йҮҚж–°иҺ·еҫ—FeCl3жә¶ж¶ІгҖӮ 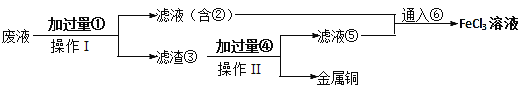 ж“ҚдҪңв… е’Ңв…Ўзҡ„ж“ҚдҪңдҪҝз”ЁеҲ°зҡ„дё»иҰҒзҺ»з’ғд»ӘеҷЁжңү____пјҢж»ӨжёЈв‘ўеҗ«жңүзҡ„еҚ•иҙЁжңү______гҖӮйҖҡе…Ҙж°”дҪ“в‘Ҙзҡ„еҢ–еӯҰејҸдёә______гҖӮ (3)иӢҘжҹҗи…җиҡҖж¶Ідёӯеҗ«1.5molВ·LпјҚ1CuCl2гҖҒ3.0molВ·LпјҚ1FeCl2гҖҒ1.0molВ·LпјҚ1FeCl3пјҢеҸ–200mLи…җиҡҖж¶ІжҢүдёҠиҝ°жӯҘйӘӨеӣһ收й“ңпјҢдёәе……еҲҶеӣһ收й“ңпјҢеҠ е…Ҙв‘ зҡ„иҙЁйҮҸжңҖе°Ҹдёә______гҖӮ |
|
| 19. жҺЁж–ӯйўҳ | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||||||||
дёӢиЎЁдёәзҹӯе‘Ёжңҹе…ғзҙ пјҢиЎЁдёӯжүҖеҲ—еәҸеҸ·еҲҶеҲ«д»ЈиЎЁдёҖз§Қе…ғзҙ гҖӮ(йҷӨиҜҙжҳҺеӨ–йғҪз”ЁеҢ–еӯҰз”ЁиҜӯеЎ«з©ә)
|
|||||||||||||||||||||||||||
| 20. е®һйӘҢйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
жңүдёҖеҢ…зҷҪиүІеӣәдҪ“пјҢе®ғеҸҜиғҪжҳҜKClгҖҒK2CO3гҖҒKNO3дёӯзҡ„дёҖз§ҚжҲ–еҮ з§ҚпјҢиҝӣиЎҢдёӢеҲ—е®һйӘҢпјҡ в‘ жә¶дәҺж°ҙпјҢеҫ—ж— иүІжә¶ж¶Іпјӣ в‘ЎеңЁжүҖеҫ—жә¶ж¶Ідёӯж»ҙе…ҘAgNO3жә¶ж¶ІпјҢз”ҹжҲҗзҷҪиүІжІүж·Җпјӣ в‘ўеҶҚж»ҙеҠ зЁҖзЎқй…ёпјҢжІүж·ҖйҮҸеҮҸе°‘дҪҶдёҚе®Ңе…Ёж¶ҲеӨұпјҢеҗҢж—¶жңүж°”жіЎз”ҹжҲҗгҖӮ ж №жҚ®дёҠиҝ°зҺ°иұЎеҲӨж–ӯпјҡ (1)зҷҪиүІеӣәдҪ“дёҖе®ҡеҗ«жңүзҡ„жҲҗеҲҶжҳҜ___________пјҢеҸҜиғҪеҗ«жңүзҡ„жҲҗеҲҶжҳҜ___________пјӣ (2)иҜ·еҶҷеҮәдёҠиҝ°е®һйӘҢдёӯжңүе…іеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡ______________________гҖӮ |
|
- 2018еұұдёңй«ҳдёүдёҠеӯҰжңҹйІҒ科зүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
- 2018еҗүжһ—й«ҳдёүдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
- 2018жұҹиҘҝй«ҳдәҢдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
- 2020еӣӣе·қй«ҳдәҢдёҠеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
- 2019еҗүжһ—й«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹдёӯиҖғиҜ•
- й«ҳдёӯеҢ–еӯҰ2020е№ҙе№ҙжң«е‘Ёз»ғзҹҘиҜҶзӮ№вҖ”вҖ”з”өи§ЈеҺҹзҗҶи®ӯз»ғйўҳпјҲ1пјүгҖҗеҗ«иҜҰи§ЈгҖ‘
- 2018й«ҳдәҢдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹдёӯиҖғиҜ•
- 2016жұҹиӢҸй«ҳдёүдёӢеӯҰжңҹиӢҸж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·



