2018е№ҝиҘҝй«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ A.зҹіжІ№ж¶ІеҢ–ж°”гҖҒжұҪжІ№гҖҒең°жІҹжІ№еҠ е·ҘеҲ¶жҲҗзҡ„з”ҹзү©жҹҙжІ№йғҪжҳҜзўіж°ўеҢ–еҗҲзү© B.зҹіжІ№йҖҡиҝҮеӮ¬еҢ–иЈӮеҢ–иҝҮзЁӢе°ҶйҮҚжІ№иЈӮеҢ–дёәжұҪжІ№ C.иҒҡд№ҷзғҜеЎ‘ж–ҷеҸҜз”ЁдәҺйЈҹе“ҒеҢ…иЈ…пјҢиҜҘеЎ‘ж–ҷзҡ„иҖҒеҢ–жҳҜеӣ дёәеҸ‘з”ҹеҠ жҲҗеҸҚеә” D.еҢ»з”Ёй…’зІҫе’Ңи‘Ўиҗ„зі–жіЁе°„ж¶ІеҸҜз”ЁдәҺдёҒиҫҫе°”ж•Ҳеә”еҢәеҲҶ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
зғғзғғ A.4з§ҚВ В В В В В В В В B.5з§ҚВ В В В В В В В В C.6з§ҚВ В В В В В В В D.7з§Қ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҝҮзЁӢзҡ„зҰ»еӯҗж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜ A.CuдёҺAgNO3жә¶ж¶ІеҸҚеә”:Cu+Ag+=Ag+Cu2+ B.йҶӢй…ёдёҺж°ўж°§еҢ–й’ жә¶ж¶ІеҸҚеә”:CH3COOH+OH-=CH3COO-+H2O C.зўій…ёж°ўй’ дёҺзЎ«й…ёеҸҚеә”:CO32-+2H+=CO2вҶ‘+H2O D.й“ҒдёҺи¶ійҮҸзЁҖзЎқй…ёеҸҚеә”:3Fe+8H++2NO3-=2NOвҶ‘+3Fe2++4H2O
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ A.N2зҡ„з”өеӯҗејҸжҳҜ: C.1mol14NH4+еҗ«жңүдёӯеӯҗ7molВ В В В В В В D.е‘ЁжңҹиЎЁдёӯ第13зәөиЎҢжҳҜв…ўAе…ғзҙ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗж— иүІжә¶ж¶ІдёӯеҠ е…Ҙй“қзүҮжңүж°ўж°”дә§з”ҹпјҢеҲҷиҜҘжә¶ж¶ІдёӯдёҖе®ҡиғҪеӨ§йҮҸе…ұеӯҳзҡ„зҰ»еӯҗз»„жҳҜ A .Cl-гҖҒNO3-гҖҒBa2+гҖҒFe3+В В В В В В В В В В В В В B. SO42- гҖҒH+гҖҒHCO3-гҖҒNa+ C Na+гҖҒK+гҖҒSO42- гҖҒCl-В В В В В В В В В В В В В В В В В В В В В В D. NH4+гҖҒBa 2+гҖҒCl-гҖҒNO3-
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAд»ЈиЎЁйҳҝдјҸдјҪеҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A.еёёжё©дёӢ28gN2еҗ«жңүзҡ„з”өеӯҗж•°дёә10NA B.ж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4LH2Oеҗ«жңүзҡ„еҲҶеӯҗж•°жҳҜNA C.е®Өжё©дёӢ44gCO2еҗ«жңүзҡ„еҲҶеӯҗж•°жҳҜNA D.100mL1molВ·L-1зӣҗй…ёдёӯеҗ«жңүзҡ„HClеҲҶеӯҗж•°жҳҜ0.1NA
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘з»қзғӯжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯйҖҡе…ҘSO2е’ҢN2пјҢеңЁдёҖе®ҡжқЎд»¶дёӢдҪҝеҸҚеә”SO2(g)+NO(g)
A.еҸҚеә”еңЁcзӮ№иҫҫеҲ°е№іиЎЎзҠ¶жҖҒ B.еҸҚеә”зү©жө“еәҰпјҡaзӮ№е°ҸдәҺbзӮ№ C.еҸҚеә”зү©зҡ„жҖ»иғҪйҮҸдҪҺдәҺз”ҹжҲҗзү©зҡ„жҖ»иғҪйҮҸ D.в–іt1=в–іt2ж—¶пјҢSO2зҡ„иҪ¬еҢ–зҺҮпјҡa~bж®өе°ҸдәҺb~cж®ө
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
зҹӯе‘Ёжңҹе…ғзҙ WгҖҒXгҖҒYгҖҒZзҡ„еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§пјҢWдёҺYгҖҒXдёҺZдҪҚдәҺеҗҢдёҖдё»ж—ҸпјҢWдёҺXеҸҜеҪўжҲҗе…ұд»·еҢ–еҗҲзү©WX2пјҢYеҺҹеӯҗзҡ„еҶ…еұӮз”өеӯҗжҖ»ж•°жҳҜе…¶жңҖеӨ–еұӮз”өеӯҗж•°зҡ„2.5еҖҚгҖӮдёӢеҲ—еҸҷиҝ°дёҚжӯЈзЎ®зҡ„жҳҜ A.еҺҹеӯҗеҚҠеҫ„зҡ„еӨ§е°ҸйЎәеәҸдёәX<W<Y<ZВ В В В В В B.WX2гҖҒYXе’ҢZX2еқҮеҸӘеҗ«е…ұд»·й”® C.WгҖҒXгҖҒYгҖҒZжңҖеӨ–еұӮз”өеӯҗж•°д№Ӣе’Ңдёә20В В В D.Zзҡ„ж°”жҖҒж°ўеҢ–зү©жҜ”Yзҡ„зЁіе®ҡ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
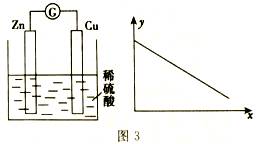
жҺ§еҲ¶йҖӮеҗҲзҡ„жқЎд»¶пјҢе°ҶеҸҚеә”2Fe3++2I-=2Fe2++I2и®ҫи®ЎжҲҗеҰӮеӣҫ2жүҖзӨәзҡ„еҺҹз”өжұ гҖӮдёӢеҲ—еҲӨж–ӯдёҚжӯЈзЎ®зҡ„жҳҜ
A.еҸҚеә”ејҖе§Ӣж—¶пјҢд№ҷдёӯзҹіеўЁз”өжһҒдёҠеҸ‘з”ҹж°§еҢ–еҸҚеә” B.еҸҚеә”ејҖе§Ӣж—¶пјҢз”ІдёӯзҹіеўЁз”өжһҒдёҠFe3+иў«иҝҳеҺҹ C.з”өжөҒи®ЎиҜ»ж•°дёәйӣ¶ж—¶пјҢеҸҚеә”иҫҫеҲ°еҢ–еӯҰе№іиЎЎзҠ¶жҖҒ D.з”өжөҒи®ЎиҜ»ж•°дёәйӣ¶еҗҺпјҢеңЁз”Ідёӯжә¶е…ҘFeCl2еӣәдҪ“пјҢд№ҷдёӯзҹіеўЁз”өжһҒдёәиҙҹжһҒжә¶ж¶І
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
зғғе®Ңе…ЁзҮғзғ§ж—¶пјҢж¶ҲиҖ—зҡ„ж°§ж°”дёҺз”ҹжҲҗзҡ„CO2дҪ“з§ҜжҜ”дёә3:2пјҢиҜҘзғғиғҪдҪҝй…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶ІиӨӘиүІпјҢд№ҹиғҪдҪҝжәҙж°ҙиӨӘиүІпјҢеҲҷиҜҘзғғзҡ„еҲҶеӯҗејҸеҸҜиғҪдёә A C3H4В В В В В В В В В B.C2H4В В В В В В В C. C2H6В В В В В В В В D. C6H6
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
еӣҫ3дёӯе·ҰеӣҫжҳҜй“ңй”ҢеҺҹз”өжұ зӨәж„ҸеӣҫпјҢеҸіеӣҫдёӯxиҪҙиЎЁзӨәе®һйӘҢж—¶жөҒе…ҘжӯЈжһҒзҡ„з”өеӯҗзҡ„зү©иҙЁзҡ„йҮҸпјҢyиҪҙиЎЁзӨә
A.й“ңжЈ’зҡ„иҙЁйҮҸВ В В В В B .c(H+)В В В В В В В C.c(SO42-)В В В В В D. C(Zn2+)
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
зҹӯе‘Ёжңҹе…ғзҙ XгҖҒYгҖҒZеҺҹеӯҗеәҸж•°е’Ңдёә36пјҢXгҖҒYеңЁеҗҢдёҖе‘ЁжңҹпјҢX+гҖҒZ2-е…·жңүзӣёеҗҢзҡ„ж ёеӨ–з”өеӯҗеұӮз»“жһ„гҖӮдёӢеҲ—жҺЁжөӢдёҚжӯЈзЎ®зҡ„жҳҜ A.еҗҢе‘Ёжңҹе…ғзҙ дёӯXзҡ„йҮ‘еұһжҖ§жңҖејәВ В В В В В В B.XгҖҒZеҪўжҲҗзҡ„еҢ–еҗҲзү©еҸӘеҗ«жңүзҰ»еӯҗй”® C.еҗҢж—Ҹе…ғзҙ дёӯZзҡ„ж°ўеҢ–зү©зЁіе®ҡжҖ§жңҖй«ҳВ В В D.еҗҢе‘Ёжңҹе…ғзҙ дёӯYзҡ„жңҖй«ҳд»·еҗ«ж°§й…ёзҡ„й…ёжҖ§жңҖејә
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
еҸҜйҖҶеҸҚеә”:X(s)+Y(g) в‘ еҚ•дҪҚж—¶й—ҙеҶ…з”ҹжҲҗ1molXзҡ„еҗҢж—¶ж¶ҲиҖ—2molZВ В В В в‘ЎZзҡ„дҪ“з§ҜеҲҶж•°дёҚеҶҚеҸҳеҢ– в‘ўдҪ“зі»зҡ„еҺӢејәдёҚеҶҚж”№еҸҳВ В В В В В В В В В В В В В В В В В В В В В В в‘ЈYгҖҒZзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰжҜ”дёә1:2 в‘ӨYзҡ„иҪ¬еҢ–зҺҮдёҚеҶҚж”№еҸҳзҡ„зҠ¶жҖҒВ В В В В В В В В В В В В В В В В в‘Ҙж··еҗҲж°”дҪ“зҡ„еҜҶеәҰдёҚеҶҚж”№еҸҳзҡ„зҠ¶жҖҒ A.д»…в‘ в‘ЈВ В В В В В В B.в‘ в‘ўв‘ЈВ В В В В В C.в‘ в‘Јв‘ӨВ В В В В В В В В В D.в‘Ўв‘ўв‘Өв‘Ҙ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
жө·еёҰдёӯжҸҗеҸ–зўҳеҚ•иҙЁпјҢжҲҗзҶҹзҡ„е·ҘиүәжөҒзЁӢеҰӮдёӢ
дёӢеҲ—е…ідәҺжө·ж°ҙеҲ¶зўҳзҡ„иҜҙжі•пјҢжӯЈзЎ®зҡ„жҳҜ A.е®һйӘҢе®ӨеңЁи’ёеҸ‘зҡҝдёӯзҒјзғ§е№Іжө·еёҰпјҢ并且用зҺ»з’ғжЈ’жҗ…жӢҢ B.еҸҜз”Ёй…’зІҫиҗғеҸ–зўҳж°ҙдёӯзҡ„I2 C.жІёж°ҙжөёжіЎжө·еёҰзҒ°зҡ„зӣ®зҡ„жҳҜдёәдәҶеҠ еҝ«I-зҡ„жә¶и§ЈпјҢ并дҪҝд№Ӣжә¶и§Јжӣҙе……еҲҶ D.еҗ«I-зҡ„ж»Өж¶ІдёӯеҠ е…ҘзЁҖзЎ«й…ёе’ҢеҸҢж°§ж°ҙеҗҺпјҢзўҳе…ғзҙ еҸ‘з”ҹиҝҳеҺҹеҸҚеә”
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
д»Ҡжңүдә”з§Қжңүжңәзү©:в‘ CH2OH(CHOH)4CHOпјҢв‘ЎCH3(CH2)3OHпјҢв‘ўCH2=CHвҖ”CH2OHпјҢв‘ЈCH2=CH-COOCH3пјҢв‘ӨCH2=CH-COOHгҖӮе…¶дёӯж—ўиғҪеҸ‘з”ҹеҠ жҲҗеҸҚеә”гҖҒеҠ иҒҡеҸҚеә”гҖҒй…ҜеҢ–еҸҚеә”пјҢеҸҲиғҪеҸ‘з”ҹж°§еҢ–еҸҚеә”зҡ„жҳҜ A.в‘ўв‘ӨВ В В В В В B.в‘ в‘Ўв‘ӨВ В В В В В В C.в‘Ўв‘ЈВ В В В В В D.в‘ўв‘Ј
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
дёӢеҲ—з”ұе®һйӘҢеҫ—еҮәзҡ„з»“и®әжӯЈзЎ®зҡ„жҳҜ
|
||||||||||||||||
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
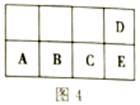
зҹӯе‘Ёжңҹе…ғзҙ AгҖҒBгҖҒCгҖҒDгҖҒEеңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®еҰӮеӣҫ4жүҖзӨәпјҢAгҖҒBгҖҒCгҖҒDдҪҚдәҺиҝһз»ӯзҡ„еӣӣдёӘдё»ж—ҸпјҢDгҖҒEзҡ„иҙЁеӯҗж•°е’ҢжҳҜ20гҖӮ
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүCе…ғзҙ еңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®жҳҜ_______пјӣEе…ғзҙ зҡ„еҗҚз§°жҳҜ_______гҖӮ пјҲ2пјүAе…ғзҙ дёҺж°§е…ғзҙ еҪўжҲҗзҡ„еҺҹеӯҗдёӘж•°жҜ”жҳҜ1:1зҡ„еҢ–еҗҲзү©зҡ„еҢ–еӯҰејҸжҳҜ_______пјҢиҜҘеҢ–еҗҲзү©еҗ«жңүзҡ„еҢ–еӯҰй”®зұ»еһӢжҳҜ_______гҖӮ пјҲ3пјүBеҺҹеӯҗз»“жһ„зӨәж„ҸеӣҫжҳҜ_______пјҢд»ҺеҺҹеӯҗз»“жһ„и§’еәҰеҲҶжһҗпјҢBжҜ”Cжҙ»жіјжҖ§еӨ§зҡ„еҺҹеӣ жҳҜ_______гҖӮ пјҲ4пјүе…ғзҙ DжҜ”е…ғзҙ Eзҡ„йқһйҮ‘еұһжҖ§ејәзҡ„зҗҶз”ұжҳҜ_______пјҲз”ЁеҢ–еӯҰж–№зЁӢејҸиЎЁзӨәпјүгҖӮ пјҲ5пјүAгҖҒBгҖҒCгҖҒDзҰ»еӯҗеҚҠеҫ„з”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜ_________пјҲеЎ«еҶҷзҰ»еӯҗз¬ҰеҸ·пјүгҖӮ пјҲ6пјүе°ҶBгҖҒCзҡ„еҚ•иҙЁеҺӢжҲҗи–„зүҮз”ЁеҜјзәҝиҝһжҺҘеҗҺжөёдәәзЁҖзЎ«й…ёдёӯпјҢиғҪйҮҸдё»иҰҒиҪ¬еҢ–ж–№ејҸжҳҜ_________пјҢжӯЈжһҒеҸҚеә”ејҸжҳҜ_________гҖӮ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
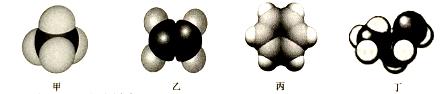
пјҲ1пјүжҹҗжңүжңәзү©з”ұCгҖҒHгҖҒOдёүз§Қе…ғзҙ з»„жҲҗпјҢзҗғжЈҚжЁЎеһӢеҰӮеӣҫ7жүҖзӨәпјҡ
в‘ еҗ«жңүзҡ„е®ҳиғҪеӣўеҗҚз§°жҳҜ_______пјӣ в‘ЎеҶҷеҮәжӯӨжңүжңәзү©дёҺйҮ‘еұһй’ еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ_______гҖӮ пјҲ2пјүеӣӣз§Қеёёи§Ғжңүжңәзү©еҲҶеӯҗзҡ„жҜ”дҫӢжЁЎеһӢзӨәж„ҸеӣҫеҰӮдёӢпјҢе…¶дёӯз”ІгҖҒд№ҷгҖҒдёҷдёәзғғпјҢдёҒдёәзғғзҡ„иЎҚз”ҹзү©гҖӮ
в‘ еҸҜд»ҘйүҙеҲ«з”Іе’Ңд№ҷзҡ„иҜ•еүӮдёә_________пјӣ a.В В В В В В зЁҖзЎ«й…ёВ В В В В В В b.жәҙзҡ„еӣӣж°ҜеҢ–зўіжә¶ж¶ІВ В В В В c.ж°ҙВ В В В В В В d.й…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶І в‘ЎдёҠиҝ°зү©иҙЁдёӯжңүжҜ’гҖҒжңүзү№ж®Ҡж°”е‘іпјҢдё”дёҚжә¶дәҺж°ҙгҖҒеҜҶеәҰжҜ”ж°ҙе°Ҹзҡ„жҳҜ_________пјҲеЎ«еҗҚз§°пјүпјҢе°Ҷе…¶еҠ е…Ҙжәҙж°ҙдёӯпјҢжҢҜиҚЎеҗҺйқҷзҪ®пјҢи§ӮеҜҹеҲ°зҡ„зҺ°иұЎжҳҜ_______гҖӮ в‘ўд№ҷе’ҢдёҒзҡ„зү©иҙЁзҡ„йҮҸе…ұ1.5molпјҢе®Ңе…ЁзҮғзғ§йңҖиҰҒзҡ„ж°§ж°”зҡ„зү©иҙЁзҡ„йҮҸжҳҜ_______гҖӮ В пјҲ3пјүд№ій…ёпјҲ в‘ 1molд№ій…ёдёҺи¶ійҮҸзҡ„NaеҸҚеә”з”ҹжҲҗж°ўж°”зҡ„зү©иҙЁзҡ„йҮҸжҳҜ_______гҖӮ в‘Ўд№ій…ёдёҺй“ҒзІүеҸҚеә”з”ҹжҲҗд№ій…ёдәҡй“ҒпјҢеҸҜз”ЁдәҺжІ»з–—зјәй“ҒжҖ§иҙ«иЎҖгҖӮеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜ_______________гҖӮ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
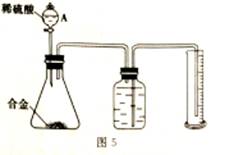
жҹҗе®һйӘҢе°Ҹз»„жөӢе®ҡй•ҒгҖҒй“қеҗҲйҮ‘дёӯй•Ғзҡ„иҙЁйҮҸеҲҶж•°гҖӮз”Іе°Ҹз»„еҗҢеӯҰз§°йҮҸ3.9gеҗҲйҮ‘жҢүз…§еӣҫ5иҝӣиЎҢе®һйӘҢгҖӮ
пјҲ1пјүд»ӘеҷЁAзҡ„еҗҚз§°жҳҜ_________гҖӮ пјҲ2пјүжЈҖжҹҘиЈ…зҪ®ж°”еҜҶжҖ§зҡ„ж–№жі•жҳҜ_________гҖӮ пјҲ3пјүжЈҖжҹҘиЈ…зҪ®ж°”еҜҶжҖ§еҘҪеҗҺејҖе§Ӣе®һйӘҢпјҢж»ҙеҠ зЁҖзЎ«й…ёж—¶ејҖе§ӢжІЎжңүж°”жіЎдә§з”ҹпјҢдҪ и®ӨдёәеҸҜиғҪзҡ„еҺҹеӣ жҳҜ____гҖӮ пјҲ4пјүиӢҘжөӢеҫ—ж°”дҪ“зҡ„дҪ“з§ҜжҳҜ4.48LпјҲиҪ¬еҢ–дёәж ҮеҮҶзҠ¶еҶөдёӢпјүпјҢеҲҷеҗҲйҮ‘дёӯй•Ғзҡ„иҙЁйҮҸеҲҶж•°жҳҜ_______пјҢиӢҘиҜ»ж•°ж—¶жІЎжңүеҶ·еҚҙеҲ°е®Өжё©иҜ»ж•°пјҢжөӢеҫ—еҗҲйҮ‘дёӯй•Ғзҡ„иҙЁйҮҸеҲҶж•°_____пјҲеЎ«еҶҷвҖңеҒҸеӨ§вҖқжҲ–вҖңеҒҸе°ҸвҖқпјүгҖӮ пјҲ5пјүдёӢеҲ—е®һйӘҢж–№жЎҲдёӯиғҪжөӢе®ҡй•Ғзҡ„иҙЁйҮҸеҲҶж•°зҡ„жҳҜ_________гҖӮ A.W1gMgгҖҒAlеҗҲйҮ‘йҮҸ B.W1gMgгҖҒAlеҗҲйҮ‘ C. W1gMgгҖҒAlеҗҲйҮ‘ D.W1gMgгҖҒAlеҗҲйҮ‘
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
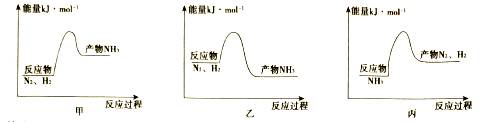
е·ҘдёҡдёҠеҗҲжҲҗж°ЁеҸҚеә”дёәпјҡN2+3H2 пјҲ1пјүеҸҚеә”иҝҮзЁӢдёӯжӢҶејҖзҡ„еҢ–еӯҰй”®жҳҜ_______пјӣ пјҲ2пјүеҸҚеә”ж”ҫзғӯпјҢд»Һд»·й”®и§’еәҰеҲҶжһҗпјҢеҸҚеә”ж”ҫзғӯзҡ„еҺҹеӣ жҳҜ_______пјҢдёӢеҲ—еӣҫеғҸжӯЈзЎ®зҡ„жҳҜ_______гҖӮ
пјҲ3пјүеңЁдҪ“з§ҜжҳҜ2Lзҡ„еҜҶй—ӯе®№еҷЁдёӯејҖе§ӢеҠ е…Ҙ1molN2пјҢ3molH2пјҢеҸҚеә”иҝҮзЁӢжө“еәҰ дёӯпјҢзү©иҙЁзҡ„жө“еәҰдёҺж—¶й—ҙзҡ„е…ізі»еҰӮеӣҫ6жүҖзӨәгҖӮ
в‘ t1ж—¶з”ҹжҲҗNH3зҡ„зү©иҙЁзҡ„йҮҸжҳҜ_______пјӣз”ЁH2иЎЁзӨәзҡ„еҢ–еӯҰеҸҚеә”йҖҹзҺҮvпјҲH2пјү=_______гҖӮ в‘ЎдёӢеҲ—еҗ„йЎ№иғҪиЎЁжҳҺеҸҚеә”иҫҫеҲ°еҢ–еӯҰе№іиЎЎзҠ¶жҖҒзҡ„жҳҜ_______гҖӮ A.е®№еҷЁдёӯж°”дҪ“зҡ„еҜҶеәҰдҝқжҢҒдёҚеҸҳ B.е®№еҷЁдёӯж°”дҪ“зҡ„еҺӢејәдёҚеҸҳ C.ж°Ёж°”зҡ„еҗ«йҮҸдёҚеҸҳ D.жӢҶејҖ3molHвҖ”Hй”®еҗҢж—¶еҪўжҲҗ6molNвҖ”Hй”® пјҲ4пјүдёӢеҲ—жҺӘж–ҪдёӯиғҪжҸҗй«ҳеҗҲжҲҗж°ЁеҸҚеә”еҢ–еӯҰеҸҚеә”йҖҹзҺҮзҡ„жҳҜ_______гҖӮ A.дҪҝз”Ёй«ҳж•ҲеӮ¬еҢ–еүӮВ В В В В В B.жҒ’жё©жҒ’е®№еҶҚе……е…Ҙж°ўж°”В В В C.йҷҚдҪҺеҸҚеә”жё©еәҰВ В В D.жү©еӨ§е®№еҷЁдҪ“з§Ҝ
|
|
- й«ҳдёҖдёҠеӯҰжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·еңЁзәҝжЈҖжөӢпјҲ2019-2020е№ҙеұұиҘҝзңҒеӨӘеҺҹеёӮ第дә”дёӯеӯҰпјү
- еү‘е·қеҺҝ第дёҖдёӯеӯҰй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•еҲ·йўҳи®ӯз»ғ
- дә‘еҚ—2019е№ҙй«ҳдёҖдёҠеҶҢеҢ–еӯҰжңҹдёӯиҖғиҜ•еёҰзӯ”жЎҲдёҺи§Јжһҗ
- е®үдёҳеёӮй«ҳдёүеҢ–еӯҰжңҲиҖғжөӢйӘҢпјҲ2018е№ҙдёҠеҶҢпјүеңЁзәҝзӯ”йўҳ
- 2016-2017е№ҙй«ҳдёҖжңҹдёӯеҢ–еӯҰиҖғиҜ•пјҲдёҠжө·еёӮжөҰдёңж–°еҢәе»әе№ідёӯеӯҰпјү
- 2019-2020е№ҙй«ҳдәҢдёҠеӯҰжңҹ第дёҖйҳ¶ж®өиҖғиҜ•еҢ–еӯҰиҜ•еҚ·пјҲзҰҸе»әзңҒжҷӢжұҹеёӮеҚ—дҫЁдёӯеӯҰпјү
- 2019-2020е№ҙй«ҳдёҖдёҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰдё“йўҳи®ӯз»ғпјҲйҮҚеәҶеёӮйғЁеҲҶеҢәпјү
- 2020еұҠй«ҳдёүеҢ–еӯҰеӨ§дәҢиҪ®еўһеҲҶејәеҢ–з»ғ-- ж— жңәз»јеҗҲжҺЁж–ӯйўҳ