2019辽宁高二下学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
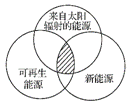
“能源分类相关图”如图所示,下面四组能源选项中,全部符合图中阴影部分的能源是( )
A. 煤炭、石油、潮汐能 B. 水能、生物质能、天然气 C. 太阳能、风能、沼气 D. 地热能、海洋能、核能
|
|
| 2. | 详细信息 |
|
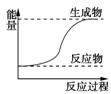
化学反应过程中,除有新物质生成外,一定还有( ) A. 体积发生变化 B. 能量发生变化 C. 质量发生变化 D. 物质状态发生变化
|
|
| 3. | 详细信息 |
|
下列化学反应属于吸热反应的是( ) A. 碘的升华 B. 生石灰溶于水 C. 镁与稀盐酸反应 D. 熟石灰与NH4Cl晶体混合制取氨气
|
|
| 4. | 详细信息 |
|
关于化学反应的说法错误的是( )
A. 如图所示的反应为放热反应 B. 化学反应中有物质变化也有能量变化 C. 需要加热的化学反应不一定是吸热反应 D. 化学键断裂吸收能量,化学键形成放出能量
|
|
| 5. | 详细信息 |
|
下列说法正确的是( ) A. 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量 B. 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据 C. 书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态 D. 凡是化合反应都是放热反应,分解反应都是吸热反应
|
|
| 6. | 详细信息 |
|
已知反应:H2S(g) + aO2(g) ===X + cH2O(l) ΔH,若ΔH表示H2S的燃烧热,则X为( ) A. S(s) B. SO2(g) C. SO3(g) D. SO3(l)
|
|
| 7. | 详细信息 |
|
反应2H2(g)+O2(g)===2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是( )
A. ΔH1<0 B. ΔH2为该反应的反应热 C. ΔH3不是H2的燃烧热 D. ΔH2=ΔH1+ΔH3
|
|
| 8. | 详细信息 |
|
有关原电池的下列说法中正确的是( ) A. C. 阳离子向正极方向移动 D. 原电池中正极一定
|
|
| 9. | 详细信息 |
|
下列有关金属腐蚀和防护的说法正确的是( ) A. 金属腐蚀的本质是金属被还原 B. 使用物品久置表面变暗主要是化学腐蚀的结果 C. 镀锡铁板比镀锌铁板更耐腐蚀 D. 在海轮外壳连接锌块采用的是牺牲阳极的阴极保护法
|
|
| 10. | 详细信息 |
|
已建立化学平衡的可逆反应,当改变条件使化学反应向正反应方向移动时,下列有关叙述中,正确的是( ) ①生成物的质量分数一定增加 ②生成物的产量一定增加 ③反应物的转化率一定增大 ④反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂 A. ①② B. ②⑤ C. ③⑤ D. ④⑥
|
|
| 11. | 详细信息 |
|
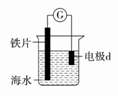
研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )
A. d为石墨,铁片腐蚀加快 B. d为石墨,石墨上电极反应为:O2+2H2O+4e-=4OH- C. d为锌块,铁片不易被腐蚀 D. d为锌块,铁片上电极反应为:2H++2e-=H2↑
|
|
| 12. | 详细信息 |
|
25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol。下列热化学方程式书写正确的是( ) A. 2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-57.3kJ/mol B. KOH(aq)+ C. C8H18(l)+ D. 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1) ΔH=-5518kJ/mol
|
|
| 13. | 详细信息 |
|
对已达到化学平衡的反应2X(g)+Y(g) A. 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 B. 逆反应速率减小,正反应速率增大,平衡向正反应方向移动 C. 正、逆反应速率都减小,平衡向逆反应方向移动 D. 正、逆反应速率都增大,平衡向正反应方向移动
|
|
| 14. | 详细信息 |
|
钢铁生锈过程发生如下反应: ①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O。 下列说法正确的是( ) A. 反应①②中电子转移数目相等 B. 与铜质水龙头连接处的钢质水管不易发生腐蚀 C. 反应①中氧化剂是氧气和水 D. 钢铁在潮湿的空气中不能发生电化学腐蚀
|
|
| 15. | 详细信息 |
|
某一反应物的浓度是2.0mol·L-1,经过4min后,它的浓度变成1.68mol·L-1,则在这4min内它的平均反应速率为( ) A. 0.2mol·L-1·min-1 B. 0.1mol·L-1·min-1 C. 0.04mol·L-1·min-1 D. 0.08mol·L-1·min-1
|
|
| 16. | 详细信息 |
|
某反应2A(g)===3B(g)其浓度随时间的变化如图所示,则2 min内反应速率表示正确的是( )
A. v(A)=0.1mol/(L·min) B. v(B)=0.2mol/(L·min) C. v(A)=v(B)=0.5mol/(L·min) D. v(A)=v(B)=0.3mol/(L·min)
|
|
| 17. | 详细信息 |
|
下列叙述正确的是( ) ①锌跟稀硫酸反应制H2,加入少量硫酸铜溶液能加快反应速率 ②镀层破损后,白口铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀 ③电镀时,应把镀件置于电解槽的阴极 ④冶炼铝时,把氧化铝加入液态冰晶石中熔融后电解 ⑤钢铁表面常易腐蚀生成Fe2O3·nH2O A. 全部 B. ①③④⑤ C. ①③⑤ D. ②④
|
|
| 18. | 详细信息 |
|
下列说法正确的是( ) A. ΔH<0的反应均是自发反应 B. ΔS为负值的反应均不能自发进行 C. 冰在室温下自动融化成水,是熵增的重要结果 D. 高锰酸钾加热分解是一个熵减小的过程
|
|
| 19. | 详细信息 |
|
在其他条件不变时,改变某一条件对aA(g)+bB(g)
(1)在反应Ⅰ中,若p1>p2,则此正反应为___(填“吸热”或“放热”)反应,也是一个气体分子数____(填“减小”或“增大”)的反应,由此判断,此反应自发进行必须满足的条件是___。 (2)在反应Ⅱ中,T1______T2(填“>”“<”或“=”),该正反应为______(填“吸热”或“放热”)反应。 (3)在反应Ⅲ中,若T1>T2,则该正反应能否自发进行?_________。
|
|
| 20. | 详细信息 |
|
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。总反应为:2Li+2H2O=2LiOH+H2↑。 (1)该电池的负极是______,负极反应式是___________。 (2)正极现象是_______________。 (3)放电时OH-向______移动(填“正极”或“负极”)。
|
|
| 21. | 详细信息 |
|
氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)===2H2O(1) ΔH=-572kJ·mol-1。请回答下列问题: (1)生成物能量总和_____(填“大于”“小于”或“等于”)反应物能量总和。 (2)若2 mol氢气燃烧生成水蒸气,则放出的热量______(填“大于”“小于”或“等于”)572kJ。 (3)H2的标准燃烧热ΔH=_____。 (4)反应2H2+O2
已知拆开1molH2、1molO2和1 mol H—O中的化学键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)_____(填“吸收”或“放出”)_____kJ。
|
|
| 22. | 详细信息 |
|
取6根铁钉,6支干净的试管及其他材料,如图所示。
试管①放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触; 试管②在试管底部放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触; 试管③先放入一根铁钉,趁热倒入煮沸的蒸馏水(已赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触; 试管④中放入铁钉注入食盐水,使铁钉和空气及食盐水接触; 试管⑤放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片; 试管⑥放入相连的铁钉和铜丝,注入自来水,浸没铁钉和铜丝。 把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况。 (1)上述实验中铁钉发生了电化学腐蚀的是____(填试管序号);在电化学腐蚀中,负极反应是____,正极反应是______。 (2)从铁钉被腐蚀的情况可知引起和促进铁钉被腐蚀的条件是_________。 (3)为防止铁的锈蚀,工业上普遍采用的方法是____________(答两种方法)。
|
|