2019й»‘йҫҷжұҹй«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹдёӯиҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ғзҙ жҖ§иҙЁе‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ–зҡ„еҶіе®ҡеӣ зҙ жҳҜпјҲВ В пјү A.В е…ғзҙ еҺҹеӯҗеҚҠеҫ„еӨ§е°Ҹе‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ– B.В е…ғзҙ зӣёеҜ№еҺҹеӯҗиҙЁйҮҸдҫқж¬ЎйҖ’еўһ C.В е…ғзҙ еҺҹеӯҗжңҖеӨ–еұӮз”өеӯҗжҺ’еёғе‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ– D.В е…ғзҙ зҡ„жңҖй«ҳжӯЈеҢ–еҗҲд»·е‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ– В |
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ғзҙ е‘ЁжңҹиЎЁдёӯжҹҗеҢәеҹҹзҡ„дёҖдәӣе…ғзҙ еӨҡз”ЁдәҺеҲ¶йҖ еҚҠеҜјдҪ“жқҗж–ҷпјҢе®ғ们жҳҜпјҲВ В пјү A.В е·ҰдёӢж–№еҢәеҹҹзҡ„йҮ‘еұһе…ғзҙ В В B.В йҮ‘еұһе…ғзҙ е’ҢйқһйҮ‘еұһе…ғзҙ еҲҶз•Ңзәҝйҷ„иҝ‘зҡ„е…ғзҙ C.В еҸідёҠж–№еҢәеҹҹзҡ„йқһйҮ‘еұһе…ғзҙ В В В В В D.В зЁҖжңүж°”дҪ“е…ғзҙ В |
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺв…ҰAж—Ҹе…ғзҙ зҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү A.В в…ҰAж—Ҹе…ғзҙ жҳҜеҗҢе‘ЁжңҹдёӯеҺҹеӯҗеҚҠеҫ„жңҖеӨ§зҡ„е…ғзҙ B.В в…ҰAж—Ҹе…ғзҙ жҳҜеҗҢе‘ЁжңҹдёӯйқһйҮ‘еұһжҖ§жңҖејұзҡ„е…ғзҙ C.В в…ҰAж—Ҹе…ғзҙ зҡ„жңҖй«ҳжӯЈд»·йғҪжҳҜ+7д»· D.В в…ҰAж—Ҹе…ғзҙ е…¶з®ҖеҚ•йҳҙзҰ»еӯҗзҡ„ж ёеӨ–з”өеӯҗеұӮж•°зӯүдәҺиҜҘе…ғзҙ жүҖеңЁзҡ„е‘Ёжңҹж•° В |
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„е…ғзҙ жҖ§иҙЁйҖ’еҸҳжғ…еҶөй”ҷиҜҜзҡ„жҳҜпјҲВ В В пјү A.В LiгҖҒBeгҖҒBеҺҹеӯҗжңҖеӨ–еұӮз”өеӯҗж•°йҖҗжёҗеўһеӨҡ B.В В NгҖҒOгҖҒFеҺҹеӯҗеҚҠеҫ„дҫқж¬ЎеўһеӨ§ C.В В PгҖҒSгҖҒClжңҖй«ҳжӯЈд»·дҫқж¬ЎеҚҮй«ҳ D.В В LiгҖҒNaгҖҒKгҖҒRbзҡ„йҮ‘еұһжҖ§дҫқж¬Ўеўһејә В |
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯпјҢжңүжһҒжҖ§е…ұд»·й”®зҡ„жҳҜпјҲВ В В В пјү A.В еҚ•иҙЁзўҳВ В В В В B. ж°ҜеҢ–й•ҒВ В В В В В В C. жәҙеҢ–й’ҫВ В В В D. ж°ҙ В |
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺеҢ–еӯҰй”®зҡ„иҜҙжі•дёӯдёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү A. еҢ–еӯҰй”®жҳҜдёҖз§ҚдҪңз”ЁеҠӣВ В B. еҢ–еӯҰй”®еҸҜд»ҘдҪҝзҰ»еӯҗзӣёз»“еҗҲпјҢд№ҹеҸҜд»ҘдҪҝеҺҹеӯҗзӣёз»“еҗҲ C. еҢ–еӯҰеҸҚеә”иҝҮзЁӢдёӯпјҢеҸҚеә”зү©еҲҶеӯҗеҶ…зҡ„еҢ–еӯҰй”®ж–ӯиЈӮпјҢдә§зү©еҲҶеӯҗдёӯзҡ„еҢ–еӯҰй”®еҪўжҲҗ D. йқһжһҒжҖ§й”®дёҚжҳҜеҢ–еӯҰй”® В |
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺй“·зҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү A. е®ғдҪҚдәҺе‘ЁжңҹиЎЁдёӯ第4е‘ЁжңҹВ B. ж°ўж°§еҢ–й“·жҳҜејұзўұ C. еңЁй’ гҖҒй’ҫгҖҒй“·дёүз§ҚеҚ•иҙЁдёӯпјҢй“·зҡ„зҶ”зӮ№жңҖй«ҳВ D. зЎқй…ёй“·жҳҜзҰ»еӯҗеҢ–еҗҲзү© В |
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢдёӯпјҢдёҚиғҪи§ӮеҜҹеҲ°жҳҺжҳҫеҸҳеҢ–зҡ„жҳҜпјҲВ В пјү A.В жҠҠдёҖж®өжү“зЈЁиҝҮеҫ—й•ҒжқЎж”ҫе…Ҙе°‘йҮҸеҶ·ж°ҙдёӯВ В В В В В B.В жҠҠCl2йҖҡе…ҘFeCl2жә¶ж¶Ідёӯ C.В жҠҠз»ҝиұҶеӨ§зҡ„й’ҫжҠ•е…Ҙе°‘йҮҸж°ҙдёӯВ В В В В В В В В В В В В В D.В жҠҠжәҙж°ҙж»ҙеҠ еҲ°ж·ҖзІүзўҳеҢ–й’ҫжә¶ж¶Ідёӯ В |
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘеҗҢе‘ЁжңҹXгҖҒYгҖҒZдёүз§Қе…ғзҙ зҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©й…ёжҖ§з”ұејәеҲ°ејұзҡ„йЎәеәҸ В В В дёәHXO4пјһH2YO4пјһH3ZO4пјҢеҲҷдёӢеҲ—еҲӨж–ӯдёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү В В A. е…ғзҙ йқһйҮ‘еұһжҖ§жҢүXгҖҒYгҖҒZзҡ„йЎәеәҸеҮҸејұ В В B. йҳҙзҰ»еӯҗзҡ„иҝҳеҺҹжҖ§жҢүXгҖҒYгҖҒZзҡ„йЎәеәҸеҮҸејұ В В C. ж°”жҖҒж°ўеҢ–зү©зҡ„зЁіе®ҡжҖ§жҢүXгҖҒYгҖҒZзҡ„йЎәеәҸеўһејә В В D. еҚ•иҙЁзҡ„ж°§еҢ–жҖ§жҢүXгҖҒYгҖҒZзҡ„йЎәеәҸеўһејә В |
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёӯй”ҷиҜҜзҡ„жҳҜпјҲВ В пјү A.В еҢ–еӯҰеҸҚеә”еҝ…然дјҙйҡҸеҸ‘з”ҹиғҪйҮҸеҸҳеҢ–В В B. еҢ–еӯҰеҸҳеҢ–дёӯзҡ„иғҪйҮҸеҸҳеҢ–дё»иҰҒжҳҜз”ұеҢ–еӯҰй”®еҸҳеҢ–еј•иө·зҡ„В В C.В еҢ–еӯҰеҸҳеҢ–дёӯиғҪйҮҸеҸҳеҢ–зҡ„еӨ§е°ҸдёҺеҸҚеә”зү©зҡ„иҙЁйҮҸзҡ„еӨҡе°‘ж— е…і D.В иғҪйҮҸеҸҳеҢ–жҳҜеҢ–еӯҰеҸҚеә”зҡ„еҹәжң¬зү№еҫҒд№ӢдёҖ В |
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
йҮ‘еҲҡзҹіе’ҢзҹіеўЁжҳҜзўіе…ғзҙ зҡ„дёӨз§Қз»“жһ„дёҚеҗҢзҡ„еҚ•иҙЁпјҢеңЁ100kPaж—¶пјҢ1moLзҹіеўЁиҪ¬еҢ–дёә В йҮ‘еҲҡзҹіпјҢиҰҒеҗёж”¶1.895kJзҡ„зғӯиғҪгҖӮжҚ®жӯӨеҲӨж–ӯеңЁ100kPaеҺӢејәдёӢпјҢдёӢеҲ—з»“и®әжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү A.В зҹіеўЁжҜ”йҮ‘еҲҡзҹізЁіе®ҡВ В В В В В В B.В йҮ‘еҲҡзҹіжҜ”зҹіеўЁзЁіе®ҡ C.В 1moLзҹіеўЁжҜ”1moLйҮ‘еҲҡзҹізҡ„жҖ»иғҪйҮҸй«ҳВ В D.В зҹіеўЁдёҺйҮ‘еҲҡзҹідә’дёәеҗҢдҪҚзҙ В |
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
еҜ№дәҺ100mL 1mol/Lзӣҗй…ёдёҺй”ҢзІ’зҡ„еҸҚеә”пјҢйҮҮеҸ–дёӢеҲ—жҺӘж–ҪиғҪдҪҝеҸҚеә”йҖҹзҺҮеҠ еҝ«зҡ„жҳҜпјҲВ В В пјү В В в‘ еҚҮй«ҳжё©еәҰпјӣв‘Ўж”№з”Ё100mL 3mol/Lзӣҗй…ёпјӣв‘ўеӨҡз”Ё300mL 1mol/Lзӣҗй…ёпјӣ В В в‘Јз”ЁзӯүйҮҸй”ҢзІүд»Јжӣҝй”ҢзІ’ В В A.В в‘ в‘ўв‘ЈВ В В В В В В В В В B.В в‘ в‘Ўв‘ЈВ В В В В В В В В C.В в‘Ўв‘ўв‘ЈВ В В В В В В В В В D.В в‘ в‘Ўв‘ў В |
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„еҸҳеҢ–дёӯпјҢеұһдәҺеҺҹз”өжұ еҸҚеә”зҡ„жҳҜпјҲВ В В пјү В В A. еңЁз©әж°”дёӯйҮ‘еұһй“қиЎЁйқўиҝ…йҖҹж°§еҢ–жҲҗдҝқжҠӨеұӮ В В B. зҷҪй“ҒпјҲеҗ«й”ҢпјүиЎЁйқўжңүеҲ’жҚҹж—¶пјҢд№ҹиғҪйҳ»жӯўй“Ғиў«ж°§еҢ– В В C. зәўзғӯзҡ„й“ҒдёқдёҺж°ҙжҺҘи§ҰиЎЁйқўеҪўжҲҗзҡ„дҝқжҠӨеұӮ В В D. й“ҒдёҺH2SO4еҸҚеә”ж—¶пјҢеҠ е…Ҙе°‘йҮҸZnSO4жә¶ж¶Іж—¶пјҢеҸҜдҪҝеҸҚеә”еҠ йҖҹ В |
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁ2A+B == 3C+4DеҸҚеә”дёӯпјҢиЎЁзӨәиҜҘеҸҚеә”йҖҹзҺҮжңҖеҝ«зҡ„жҳҜВ пјҲВ В В пјү A.В vпјҲAпјү=0.5 molВ·L-1В·s-1В В В В В В В В B.В vпјҲBпјү=0.3 molВ·L-1В·s-1 C.В vпјҲCпјү=0.8 molВ·L-1В·s-1В В В В В В В В D.В vпјҲDпјү=1 molВ·L-1В·s-1 В |
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҜҸз»„зҡ„дёүз§Қзү©иҙЁдёӯпјҢдёӨиҫ№зҡ„еӣәдҪ“еқҮжңүеҜјзәҝиҝһжҺҘпјҢжҸ’е…Ҙдёӯй—ҙзҡ„ж¶ІдҪ“дёӯпјҢ е…¶дёӯиғҪз»„жҲҗеҺҹз”өжұ зҡ„жҳҜпјҲВ В В пјү A.В Zn | H2SO4(зЁҖ) | CВ В В В В В В В В В В В В В В В В В В В В В В B.В Cu | й…’зІҫ | Ag C.В Zn | CCl4 | CuВ В В В В В В В В В В В В В В В В В В В В В В В В В В D.В Fe | H2SO4(зЁҖ) | Fe В |
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁ2Lе®№еҷЁдёӯеҸ‘з”ҹеҸҚеә”N2пјӢ3H2 A.В 6 sВ В В В В В В В В В В В B.В 4 sВ В В В В В В В В В В В В В C.В 3 sВ В В В В В В В В В В В В В В D.В 2 s В |
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
е·Ҙдёҡз”ҹдә§зЎ«й…ёж—¶пјҢе…¶дёӯдёҖжӯҘеҸҚеә”жҳҜ2SO2 + O2 AпјҺеўһеӨ§ж°§ж°”зҡ„жө“еәҰеҸҜжҸҗй«ҳеҸҚеә”йҖҹзҺҮ BпјҺеҚҮй«ҳжё©еәҰеҸҜжҸҗй«ҳеҸҚеә”йҖҹзҺҮ CпјҺдҪҝз”ЁеӮ¬еҢ–еүӮиғҪжҳҫи‘—еўһеӨ§еҸҚеә”йҖҹзҺҮ DпјҺиҫҫеҲ°еҢ–еӯҰе№іиЎЎж—¶жӯЈйҖҶеҸҚеә”йҖҹзҺҮзӣёзӯүдё”йғҪдёәйӣ¶ В |
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—ж°”дҪ“зҡ„дё»иҰҒжҲҗеҲҶдёҚжҳҜз”Ізғ·зҡ„жҳҜпјҲВ В пјү A.В жІјж°”В В В В В В В В В B.В еӨ©з„¶ж°”В В В В В В В В В C.В з…Өж°”В В В В В В В D.В еқ‘йҒ“ж°” В |
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷзӯүзү©иҙЁзҡ„йҮҸзҡ„з”Ізғ·е’Ңж°Ҝж°”ж··еҗҲеҗҺпјҢеңЁжј«е°„е…үзҡ„з…§е°„дёӢе……еҲҶеҸҚеә”пјҢз”ҹжҲҗзү©дёӯзү©иҙЁзҡ„йҮҸжңҖеӨ§зҡ„жҳҜпјҲВ В В В пјүВ A.В CH3ClВ В В В В В B.В CH2Cl2В В В В В В C.В CCl4В В В В В В D. В HCl В |
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
ж°ўж°§зҮғж–ҷз”өжұ е·Із”ЁдәҺиҲӘеӨ©йЈһжңәгҖӮд»Ҙ30%KOHжә¶ж¶Ідёәз”өи§ЈиҙЁзҡ„иҝҷз§Қз”өжұ еңЁдҪҝз”Ёж—¶зҡ„з”өжһҒеҸҚеә”еҰӮдёӢпјҡ2H2пјӢ4OH-пјҚ4e-==4H2OВ В В В В В В В O2пјӢ2H2OпјӢ4e-==4OH- еҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲВ В В пјү AпјҺж°ўж°”йҖҡе…ҘжӯЈжһҒпјҢж°§ж°”йҖҡе…ҘиҙҹжһҒ BпјҺзҮғж–ҷз”өжұ зҡ„иғҪйҮҸиҪ¬еҢ–зҺҮдёҚиғҪиҫҫеҲ°100% CпјҺдҫӣз”өж—¶зҡ„жҖ»еҸҚеә”дёәпјҡ2H2пјӢO2 ==== 2H2O DпјҺдә§зү©дёәж— жұЎжҹ“зҡ„ж°ҙпјҢеұһдәҺзҺҜеўғеҸӢеҘҪз”өжұ В |
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
йүҙеҲ«з”Ізғ·гҖҒдёҖж°§еҢ–зўіе’Ңж°ўж°”дёүз§Қж— иүІж°”дҪ“зҡ„ж–№жі•пјҢжҳҜе°Ҷе®ғ们еҲҶеҲ«пјҲВ В В В пјү A.В е…ҲеҗҺйҖҡе…Ҙжәҙж°ҙе’Ңжҫ„жё…зҡ„зҹізҒ°ж°ҙВ В B.В зӮ№зҮғеҗҺзҪ©дёҠеҶ…еЈҒж¶Ӯжңүжҫ„жё…зҹізҒ°ж°ҙзҡ„зғ§жқҜ C.В зӮ№зҮғпјҢе…ҲеҗҺзҪ©дёҠе№ІзҮҘзҡ„еҶ·зғ§жқҜе’ҢеҶ…еЈҒж¶Ӯжңүжҫ„жё…зҹізҒ°ж°ҙзҡ„зғ§жқҜ D.В зӮ№зҮғеҗҺзҪ©дёҠеҶ…еЈҒж¶Ӯжңүжҫ„жё…зҹізҒ°ж°ҙзҡ„зғ§жқҜпјҢйҖҡе…Ҙжәҙж°ҙ В |
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”дёӯпјҢе…үз…§еҜ№еҸҚеә”еҮ д№ҺжІЎжңүеҪұе“Қзҡ„жҳҜпјҲВ В В В пјү A.В ж°Ҝж°”дёҺж°ўж°”зҡ„еҸҚеә”В В В В В В В В В В В В В В B.В ж°Ҝж°”дёҺз”Ізғ·зҡ„еҸҚеә” C.В ж°§ж°”дёҺз”Ізғ·зҡ„еҸҚеә” В В В В В В В В В В В В В В D.В ж¬Ўж°Ҝй…ёзҡ„еҲҶи§Ј В |
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
з ”з©¶иҜҒжҳҺпјҢз”Ёж”ҫе°„жҖ§135В 53IжІ»з–—иӮҝзҳӨеҸҜ收еҲ°дёҖе®ҡз–—ж•ҲпјҢдёӢеҲ—жңүе…і135В 53IеҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺ135В 53IжҳҜзўҳзҡ„дёҖз§ҚеҗҢзҙ ејӮеҪўдҪ“ BпјҺ135В 53IжҳҜдёҖз§Қж–°еҸ‘зҺ°зҡ„е…ғзҙ CпјҺ135В 53IдҪҚдәҺе…ғзҙ е‘ЁжңҹиЎЁдёӯ第4е‘Ёжңҹв…ҰAж—Ҹ DпјҺ135В 53Iж ёеҶ…зҡ„дёӯеӯҗж•°дёҺж ёеӨ–з”өеӯҗж•°д№Ӣе·®дёә29 В |
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
дәҢж°ҹз”Ізғ·жҳҜжҖ§иғҪдјҳејӮзҡ„зҺҜдҝқдә§е“ҒпјҢе®ғеҸҜжӣҝд»Јжҹҗдәӣдјҡз ҙеқҸиҮӯж°§еұӮзҡ„вҖңж°ҹеҲ©жҳӮвҖқдә§е“ҒпјҢз”ЁдҪңз©әи°ғгҖҒеҶ°з®ұе’ҢеҶ·еҶ»еә“зҡ„иҮҙеҶ·еүӮгҖӮиҜ•еҲӨж–ӯдәҢж°ҹз”Ізғ·зҡ„з»“жһ„жңүпјҲ В В В пјү AпјҺ4з§Қ В В В В В В В В BпјҺ3з§ҚВ В В В В В В CпјҺ2з§ҚВ В В В В В В В В В DпјҺ1з§Қ В |
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°иғҪиҜҙжҳҺеҸҚеә”2AпјҲgпјү+BпјҲgпјү в‘ AгҖҒBгҖҒCзҡ„зҷҫеҲҶеҗ«йҮҸзӣёзӯүВ В В В В В В В В В В В В В В В В В В В В В В в‘ЎеҚ•дҪҚж—¶й—ҙпјҢж¶ҲиҖ—a mol BпјҢеҗҢж—¶з”ҹжҲҗ2a mol C в‘ўеҚ•дҪҚж—¶й—ҙпјҢж¶ҲиҖ—a mol AпјҢеҗҢж—¶з”ҹжҲҗ0.5a mol BВ В В в‘ЈеӨ–з•ҢжқЎд»¶дёҚеҸҳж—¶пјҢзү©иҙЁжҖ»иҙЁйҮҸдёҚйҡҸж—¶й—ҙж”№еҸҳ в‘ӨеӨ–з•ҢжқЎд»¶дёҚеҸҳж—¶пјҢж°”дҪ“жҖ»еҲҶеӯҗж•°дёҚеҶҚеҸҳеҢ–В В В В В В В В В В в‘ҘAгҖҒBгҖҒCеҲҶеӯҗж•°д№ӢжҜ”дёә2вҲ¶1вҲ¶2 A.йҷӨв‘ЈеӨ–В В В В В В В В В B.йҷӨв‘Ўв‘ҘеӨ–В В В В В В В В В C.в‘Ўв‘Јв‘ӨВ В В В В В В В В В D.в‘ўв‘Ө В |
|
| 26. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||||||||||||||||||
|
дёӢиЎЁжҳҜе…ғзҙ е‘ЁжңҹиЎЁзҡ„дёҖйғЁеҲҶпјҢй’ҲеҜ№иЎЁдёӯзҡ„в‘ пҪһв‘©дёӯе…ғзҙ пјҢ з”Ёе…ғзҙ з¬ҰеҸ·жҲ–еҢ–еӯҰејҸеЎ«з©әеӣһзӯ”д»ҘдёӢй—®йўҳпјҡ
пјҲ1пјүеңЁиҝҷдәӣе…ғзҙ дёӯпјҢйҮ‘еұһжҖ§жңҖејәзҡ„е…ғзҙ жҳҜВ В гҖҖВ пјҢжңҖжҙ»жіјзҡ„йқһйҮ‘еұһе…ғзҙ жҳҜВ гҖҖгҖҖ пјӣ пјҲ2пјүеҢ–еӯҰжҖ§иҙЁжңҖдёҚжҙ»жіјзҡ„е…ғзҙ жҳҜВ В гҖҖ пјҢе…¶еҺҹеӯҗзҡ„еҺҹеӯҗз»“жһ„зӨәж„ҸеӣҫдёәВ В В В В В пјӣ пјҲ3пјүе…ғзҙ зҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©дёӯй…ёжҖ§жңҖејәзҡ„жҳҜВ В В В В В В В пјҢ зўұжҖ§жңҖејәзҡ„жҳҜгҖҖВ В В В В В пјҢе‘ҲдёӨжҖ§зҡ„ж°ўж°§еҢ–зү©жҳҜВ В В В В В В В В В В В В В В В пјӣ пјҲ4пјүеңЁв‘ўпҪһв‘Ұе…ғзҙ дёӯпјҢеҺҹеӯҗеҚҠеҫ„жңҖеӨ§зҡ„жҳҜВ В В В В пјҢеҺҹеӯҗеҚҠеҫ„жңҖе°Ҹзҡ„жҳҜВ гҖҖВ гҖҖВ пјӣ пјҲ5пјүеңЁв‘ҰдёҺв‘©зҡ„еҚ•иҙЁдёӯпјҢеҢ–еӯҰжҖ§иҙЁиҫғжҙ»жіјзҡ„жҳҜВ В В В В В В пјҢ еҸҜз”Ёд»Җд№ҲеҢ–еӯҰеҸҚеә”иҜҙжҳҺиҜҘдәӢе®һпјҲеҶҷеҮәеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјүВ В В В В В В В В В В В В В В гҖӮ В |
|||||||||||||||||||||||||||||||||||||
| 27. | иҜҰз»ҶдҝЎжҒҜ |
|
AгҖҒBгҖҒCгҖҒDгҖҒEдёәеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§зҡ„зҹӯе‘Ёжңҹе…ғзҙ пјҢе·ІзҹҘAгҖҒBгҖҒE 3з§ҚеҺҹеӯҗжңҖеӨ–еұӮе…ұжңү11дёӘз”өеӯҗпјҢдё”иҝҷ3з§Қе…ғзҙ зҡ„жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©дёӨдёӨзҡҶиғҪеҸ‘з”ҹеҸҚеә”з”ҹжҲҗзӣҗе’Ңж°ҙпјҢCе…ғзҙ зҡ„жңҖеӨ–еұӮз”өеӯҗж•°жҜ”ж¬ЎеӨ–еұӮз”өеӯҗж•°е°‘4пјҢDе…ғзҙ еҺҹеӯҗж¬ЎеӨ–еұӮз”өеӯҗж•°жҜ”жңҖеӨ–еұӮз”өеӯҗж•°еӨҡ3гҖӮ пјҲ1пјүеҶҷеҮәдёӢеҲ—е…ғзҙ з¬ҰеҸ·пјҡ A В В В В В В В В пјҢBВ В В В В В В пјҢ CВ В В В В В В пјҢDВ В В В В В В пјҢEВ В В В В В В В В пјҲ2пјүAдёҺEдёӨе…ғзҙ еҸҜеҪўжҲҗеҢ–еҗҲзү©пјҢз”Ёз”өеӯҗејҸиЎЁзӨәе…¶еҢ–еҗҲзү©зҡ„еҪўжҲҗиҝҮзЁӢпјҡ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ3пјүеҶҷеҮәAгҖҒBдёӨе…ғзҙ жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©зӣёдә’еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В гҖӮ пјҲ4пјүжҜ”иҫғCгҖҒDзҡ„жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©зҡ„й…ёжҖ§пјҡпјҲз”ЁеҢ–еӯҰејҸиЎЁзӨәпјү В В В В В В В В В В В В В В В гҖӮ В |
|
| 28. | иҜҰз»ҶдҝЎжҒҜ |
|
йҖүжӢ©йҖӮе®ңзҡ„жқҗж–ҷе’ҢиҜ•еүӮи®ҫи®ЎдёҖдёӘеҺҹз”өжұ пјҢе®ҢжҲҗдёӢеҲ—еҸҚеә”: Cu+ 2Ag+ = Cu2++2Ag пјҲ1пјүиҙҹжһҒжқҗж–ҷпјҡВ В В В В В В гҖҒжӯЈжһҒжқҗж–ҷпјҡВ В В В В В В В пјӣ з”өи§ЈиҙЁжә¶ж¶ІпјҡВ В В В В В В В В В В В В пјҲ2пјүеҶҷеҮәз”өжһҒеҸҚеә”ејҸпјҡ жӯЈжһҒпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ иҙҹжһҒпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ3пјүеҺҹз”өжұ дёӯз”өеӯҗд»ҺВ В В В жһҒжөҒеҮәпјҢ з”өи§ЈиҙЁжә¶ж¶ІдёӯйҳҙзҰ»еӯҗжөҒеҗ‘В В В В жһҒгҖӮ пјҲеЎ«еҶҷз”өжһҒеҗҚз§°вҖңжӯЈвҖқжҲ–вҖңиҙҹвҖқпјү В |
|
| 29. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||
|
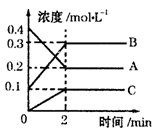
еҢ–еӯҰеҸҚеә”зҡ„еҝ«ж…ўе’ҢйҷҗеәҰеҜ№дәәзұ»з”ҹдә§з”ҹжҙ»жңүйҮҚиҰҒзҡ„ж„Ҹд№үгҖӮ пјҲ1пјүе°ҶеҪұе“ҚеҸҚеә”йҖҹзҺҮжқЎд»¶еЎ«еңЁз©әж јеӨ„гҖӮ
пјҲ2пјүеҰӮеӣҫжүҖзӨәпјҢ800в„ғж—¶AгҖҒBгҖҒCдёүз§Қж°”дҪ“еңЁеҜҶй—ӯе®№еҷЁдёӯеҸҚеә”ж—¶зҡ„жө“еәҰеҸҳеҢ–пјҢеҲҶжһҗеӣҫеғҸпјҢеӣһзӯ”й—®йўҳпјҡ
в‘Ў2minеҶ…пјҢCзҡ„еҸҚеә”йҖҹзҺҮдёәВ В В В В В В В В В В В В В В В В В В гҖӮ в‘ўиҜҘеҸҚеә”зҡ„ж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘ЈеңЁе…¶д»–жқЎд»¶дёӢпјҢжөӢеҫ—Aзҡ„еҸҚеә”йҖҹзҺҮдёә0.05mol/(LВ·s)пјҢ жӯӨж—¶зҡ„еҸҚеә”дёҺ800в„ғж—¶зӣёжҜ”пјҢВ В В В В В В В В В В В В гҖӮ AпјҺжҜ”800в„ғж—¶ж…ўВ В В BпјҺжҜ”800в„ғж—¶еҝ«В В В CпјҺе’Ң800в„ғж—¶йҖҹзҺҮдёҖж · В |
|||||||||||
- 2019еұҠй«ҳдёүдёӢеҶҢ3жңҲзӯүзә§жңҲиҖғеҚ·еҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲпјҲдёҠжө·еёӮеҚ—жұҮдёӯеӯҰпјү
- ж№–еҚ—зңҒиЎЎйҳіеёӮ第дёҖдёӯеӯҰ2021еұҠй«ҳдёүеүҚеҚҠжңҹ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- жұҹиҘҝеёҲиҢғеӨ§еӯҰйҷ„еұһдёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠеҚҠе№ҙжңҹжң«иҖғиҜ•еҢ–еӯҰеңЁзәҝиҖғиҜ•йўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- й«ҳдёүеҢ–еӯҰдёӢеҶҢдё“йўҳз»ғд№ еҲ·йўҳи®ӯз»ғ
- еӨ©жҙҘеёӮй«ҳдёүеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·иҖғиҜ•е®Ңж•ҙзүҲ
- жһ—е·һеёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҲиҖғиҜ•еҚ·жЁЎжӢҹиҖғиҜ•и®ӯз»ғ
- е№ҝе·һеёӮй«ҳдёүеҢ–еӯҰдёӢеҶҢдё“йўҳз»ғд№ еңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ
- 2019-2020е№ҙй«ҳдәҢ10жңҲжңҲиҖғеҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲеұұдёңзңҒж·„еҚҡеёӮж·„е·қеҢәиҲ¬йҳідёӯеӯҰпјү