2020江西高一上学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( ) A.燕馏 B.过滤 C.升华 D.萃取
|
|
| 2. | 详细信息 |
|
下列各组物质按照单质、化合物、混合物顺序排列的是( ) A.石墨 Fe(OH)3胶体 澄清石灰水 B.氮气 干冰 冰水混合物 C.液态氧 CuSO4·5H20 浓硫酸 D.硫粉 碘酒 含氧40%的氧化镁
|
|
| 3. | 详细信息 |
|
下列物质的分类合理的是( ) A.酸性氧化物:CO2 、Si0 2、SO2、CO B.碱:烧碱、纯碱、苛性钾、氢氧化钡 C.混合物:盐酸、浓硫酸、水煤气、氢氧化铁胶体 D.碱性氧化物:Na2O、CaO、MgO、Al2O3
|
|
| 4. | 详细信息 |
|
下列说法中不正确的是( ) ①将硫酸钡放入水中不能导电,硫酸钡是非电解质; ②氨溶于水得到氨水溶液能导电,氨水是电解质; ③固态氯化氢不导电,液态氮化氢可以导电; ④硫酸氢钠电离出的阳离子有H+,硫酸氢钠是酸: ⑤电解质放在水中一定能导电,非电解质放在水中一定不导电. A.仅①④ B.仅①④⑤ C.仅②③ D.①②③④⑤
|
|
| 5. | 详细信息 |
|
关于胶体,下列说法正确的是( ) A.16.25gFeCl3水解形成的Fe(OH)3胶体粒子数是0.1NA B.纳米材料粒子直径一般在10-9m至10-7m之间,因此纳米材料属于胶体 C.Fe(OH)3胶体电泳的实验中,阴极附近颜色加深,阳极附近颜色变浅,证明Fe(OH)3胶体带正电 D.将碳酸钙经过特殊加工制成纳米碳酸钙,化学性质没有明显变化
|
|
| 6. | 详细信息 |
|
日常生活中的许多现象与化学反应有关,下列 现象与氧化还原反应无关的是 ( ) A.铜铸器件上出现铜绿[Cu2(OH)2CO3] B.充有氢气的气球遇明火爆炸 C.大理石雕像被酸雨腐蚀毁坏 D.铁质菜刀生锈
|
|
| 7. | 详细信息 |
|
下列离子方程式书写正确的是( ) A.氧化铜与盐酸反应:O2-+2H+==H2O B.碳酸氢钠溶液与氢氧化钠溶液混合:HCO3-+OH-== H2O+CO32- C.水垢溶解于醋酸中:CaCO3+2H+===Ca2++CO2↑+H2O D.小苏打溶液与稀硫酸混合: CO32+2H+===CO2↑+H2O
|
|
| 8. | 详细信息 |
|
某溶液遇石蕊溶液显红色,下列各组离子能在该溶液中大量共存的是( ) A.Na+、NO3-、Ca2+、Cl- B.K+、SO42-、HCO3-、Na+ C.Fe2+、SO42-、OH-、Ba2+ D.MnO4-、SO42-、NO3-、CO32-
|
|
| 9. | 详细信息 |
|
已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO-+4OH-===2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是( ) A.6 B.5 C.4 D.3
|
|
| 10. | 详细信息 |
|
O2F2可以发生反应H2S+4O2F2===SF6+2HF+4O2,下列说法正确的是( ) A.氧气是氧化产物 B.O2F2既是氧化剂,又是还原剂 C.若生成2.24L HF,则转移0.4mol电子 D.还原剂与氧化剂的物质的量之比为1∶4
|
|
| 11. | 详细信息 |
|
NA为阿伏加德罗常数的值。 下列叙述正确的是( ) A.1.0 mol·L-1的NaHCO3溶液中含有的Na+数为NA B.标准状况下,2.24 L CCl4中含有的分子总数为0.1NA C.金属钠与水反应,生成22.4 L氢气时,转移的电子数为2NA D.1 mol氢氧根离子与1 mol铵根离子所含电子数均为10NA
|
|
| 12. | 详细信息 |
|
精确配制250 mL一定物质的量浓度的NaOH溶液,下列实验操作正确的是( ) A.选择仪器时,使用500 mL容量瓶 B.将称量好的氢氧化钠固体放入容量瓶中,加入少量水溶解 C.在烧杯中溶解氢氧化钠固体后,立即将所得溶液注入容量瓶中 D.将烧杯中的氢氧化钠溶液注入未经干燥的洁净容量瓶中
|
|
| 13. | 详细信息 |
|
用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏高的是( ) A.定容时加水加多了,用滴管吸出溶液至刻度线 B.定容时仰视刻度线 C.没有洗涤溶解NaCl固体的烧杯和玻璃棒 D.称量NaCl固体时砝码上有杂质
|
|
| 14. | 详细信息 |
|
把0.2molKOH固体分别加入到下列100mL的溶液中,溶液的导电能力无变化的是( ) A、蒸馏水 B、0.2mol/L HNO3 C、1mol/L H2SO4 D、2mol/L CH3COOH
|
|
| 15. | 详细信息 | ||||||||||||||||||||
|
为除去下列待提纯物质中的杂质(括号内为杂质),选用的试剂及操作方法均正确的是( )
|
|||||||||||||||||||||
| 16. | 详细信息 |
|
下列关于0.1mol/L Ca(NO3)2溶液的正确说法是( ) A.该溶液可由1L水中溶解0.1moLCa(NO3)2制得 B.1L该溶液中含有Ca2+和NO3-离子总数为3 × 6.02 × 1022个 C.O.5L该溶液中Ca2+离子的物质的量浓度为0.2mol/L D.0.5L该溶液中NO3-离子的物质的量浓度为0.1 mol/L
|
|
| 17. | 详细信息 |
|
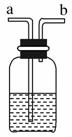
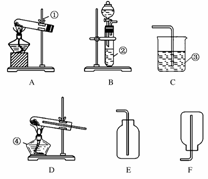
(1)实验室制取并收集氧气时应选择__________和__________相连接,制取并收集氢气时应选择__________和__________相连接。 (2)进行木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是__________________________________。 (3)实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。已知甲烷的密度比空气小,不溶于水。则制取甲烷气体可选用的装置为________,收集甲烷气体时可选用的装置为________。 (4)如图是某学生设计的一种有洗气、贮气等用途的装置。欲除去O2中混有的水蒸气,瓶中可盛________。当用排水法收集氢气时,瓶内先装满水,气体从________(填“a”或“b”,下同)导管口通入。若要用水将瓶中氢气排出,水应从________导管口进入。
|
|
| 18. | 详细信息 |
|
实验室用氯酸钾和二氧化锰制取氧气的反应方程式为: 2KClO3 (1)该反应中被还原的元素名称为 ______ ,生成2molO2时转移电子的数是 ______ . (2)从反应后的固体混合物中分离出难溶于水的MnO2的具体实验操作名称: ______ . (3)分离出的MnO2可用于实验室制取Cl2,化学方程式为:MnO2 + 4HCl(浓) (4)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为__________________. (5)以上两个反应都用到MnO2,其作用分别_____________.
|
|
| 19. | 详细信息 |
|
A、B、C、D、E五瓶透明溶液,分别是HCl,BaCl2,NaHSO4,Na2CO3,AgNO3中的一种.已知:① A与B反应有气体生成;② B与C反应有沉淀生成;③ C与D反应有沉淀生成;④ D与E反应有沉淀生成;⑤ A与E反应有气体生成;⑥ 在②和③的反应中生成的沉淀是同一种物质请填空: (1)在②和③的反应中,生成的沉淀物质的化学式是________. (2)A是_________,B是__________,C是_________,D是______________,E是____________. (3)A与E反应的离子方程式是_____________________________________.
|
|
| 20. | 详细信息 |
|
(1)以下为中学化学中常见的几种物质:①NaOH溶液②铜丝③蔗糖晶体④无水乙醇⑤稀硫酸⑥液氨⑦氨水⑧SO2 ⑨硫酸钡晶体⑩熔融 NaC1,上述状态下可导电的________;上述状态下的电解质不能导电是__________________ (2)写出⑤和⑦发生反应的离子方程式___________________. (3)在aLAl2(SO4)3和(NH4)2SO4的混合溶液中加入bmol BaCl2,恰好使溶液中的SO42-完全沉淀;若加入足量NaOH 并加热可得到c molNH3,则原溶液中 A13+的物质的量浓度为_____________________.
|
|
| 21. | 详细信息 |
|
(1)在标准状况下,10.2g PH3 与标况下_______L CH4 含有相同的H原子。 (2)某气体氧化物化学式RO2,在标准状况下,1.28g 该氧化物的体积为448mL,则该氧化物的摩尔质量为_______________,R的相对原子质量为_______________.
|
|
- 2019-2020年高一上半年第二次月考化学专题训练(河北省邢台市第八中学)
- 2018至2019年高二下学期期中考试化学试卷带参考答案和解析(四川省成都市棠湖中学)
- 广西壮族自治区桂林市第十八中学2021届高三前半期第一次月考理综化学试卷在线练习
- 高一下半年期末考试化学试卷在线练习(2019-2020年广东省潮州市潮安区)
- 合肥市高一化学月考测验(2019年上半年)无纸试卷
- 2018-2019年高一下册期中考试化学免费试卷完整版(内蒙古北京八中乌兰察布分校)
- 2018-2019年高一上学期期中考试化学免费试卷完整版(湖北省黄石市第三中学)
- 吉化第一高级中学校高二化学2019年上册期中考试在线做题
 今有
今有