2017广东高一下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列各组指定原子序数的元素,能形成AB2型离子化合物的是( ) A.6和8 B.16和8 C.12和9 D.11和6
|
|
| 2. | 详细信息 |
|
下列化学用语正确的是( ) A.CO2的电子式: C.Na2O的电子式:Na
|
|
| 3. | 详细信息 |
|
下列各组中属于同位素关系的是( ) A.
|
|
| 4. | 详细信息 |
|
下列说法正确的是( ) A.Li是最活泼金属,F是最活泼非金属 B.Mg(OH)2碱性比Ca(OH)2强 C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 D.X2+的核外电子数目为18,则X在第四周期第ⅡA族
|
|
| 5. | 详细信息 |
|
X元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为( ) A.HX B.H2X C.XH4 D.XH3
|
|
| 6. | 详细信息 |
|
下列物质中,含有非极性共价键的是( ) A.N2 B.CO2 C.NaOH D.CH4
|
|
| 7. | 详细信息 |
|
根据元素在周期表中的位置判断,下列元素中原子半径最小的是( ) A.氧 B.氮 C.碳 D.氟
|
|
| 8. | 详细信息 |
|
已知某粒子ZARn+,则元素R的原子序数是( ) A.Z B.A﹣Z C.Z﹣n D.Z+n
|
|
| 9. | 详细信息 |
|
下列各组中,性质比较不正确的是( ) A.酸性:HClO4>HBrO4>HIO4 B.碱性:NaOH>Mg(OH)2>Al(OH)3 C.稳定性:PH3>H2S>HCl D.非金属性:F>O>S
|
|
| 10. | 详细信息 |
|
下列各组元素性质递变情况错误的是( ) A. B、C、N、O、F原子半径依次增大 B. P、S、Cl元素最高正化合价依次升高 C. H、Be、B原子最外层电子数依次增多 D. Li、Na、K、Rb的金属性依次增强
|
|
| 11. | 详细信息 |
|
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
A.原子半径 B.气态氢化物的稳定性:X>Z C.Z、W均可与Mg形成离子化合物 D.最高价氧化物对应水化物的酸性:Y>W
|
|
| 12. | 详细信息 |
|
下列事实不能作为实验判断依据的是( ) A.钠和镁分别与冷水反应,判断金属活动性强弱 B.铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱 C.酸性H2CO3<H2SO4,判断硫与碳的非金属性强弱 D.F2与Cl2分别与H2反应,判断氟与氯的非金属性强弱
|
|
| 13. | 详细信息 |
|
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是 A.原子半径A>B>D>C B.原子序数d>c>b>a C.离子半径C>D>B>A D.单质的还原性A>B>D>C
|
|
| 14. | 详细信息 |
|
元素周期表里金属元素和非金属元素分界线附近能找到 A.新制农药元素 B.制催化剂元素 C.制半导体元素 D.制耐高温合金元素
|
|
| 15. | 详细信息 |
|
运用元素周期律分析下面的推断,其中不正确的是( ) A.锂(Li)与水反应比钠与水反应剧烈 B.砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 C.在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 D.HBrO4的酸性比HIO4的酸性强
|
|
| 16. | 详细信息 |
|
.元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( ) A.元素原子的最外层电子数等于元素的最高化合价 B.多电子原子中,在离核较近的区域内运动的电子能量较高 C.P、S、Cl得电子能力和最高价氧化物对应水化 D.
|
|
| 17. | 详细信息 |
|
A、B、C、D、E是同周期的五种主族元素。A和B的最高价氧化物 A. B<A<D<C<E B. C<D<A<B<E C. A<B<C<D<E D. E<C<D<B<A
|
|
| 18. | 详细信息 |
|
下列属于吸热反应的是( ) A.金属钠与水的反应 B.氢气燃烧 C.浓硫酸的稀释 D.Ba(OH)2·8H2O和NH4Cl(固体)混合
|
|
| 19. | 详细信息 |
|
已知反应X+Y===M+N为放热反应,对该反应的说法正确的是( ) A.X的能量一定高于M B.Y的能量一定高于N C.X和Y的总能量一定高于M和N的总能量 D.因为该反应为放热反应,故不必加热就可发生
|
|
| 20. | 详细信息 |
|
下列过程一定释放出能量的是( ) A.化合反应 B.分解反应 C.分子拆成原子 D.原子形成分子
|
|
| 21. | 详细信息 |
|
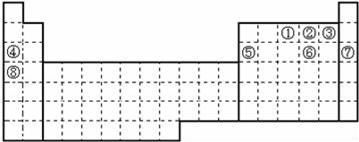
元素①~⑧在元素周期表中的位置如下,回答有关问题:
(1)画出⑦的原子结构示意图 . (2)写出②含有10个中子的核素的化学符号 . (3)②和③氢化物的稳定性由强到弱的顺序为 (填化学式). (4)写出①的氢化物发生催化氧化的化学方程式 . (5)表中能形成两性氢氧化物的元素是 (填元素符号),写出该元素的单质与 ⑧的最高价氧化物的水化物反应的离子方程式 .
|
|
| 22. | 详细信息 |
|
A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处于同一周期,A、C处于同一主族。C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的4倍。试回答下列问题: (1)这四种元素分别是A________,B______,C________,D________。 (2)这四种元素中能形成的气态氢化物的稳定性由大到小的顺序是________。 (3)A与B形成的三原子分子的化学式是______________________________________, B与D形成的原子个数之比为1∶1的化合物的化学式是______________。 (4)A元素的某氧化物与D元素的某氧化物反应生成单质的化学方程式是________。
|
|
| 23. | 详细信息 | ||||||||||
|
现有部分短周期元素的性质或原子结构如下表:
(1)元素T在周期表中的位置是________周期________族。 (2)元素X的一种同位素可测定文物年代,这种同位素的符号是________。 (3)元素Y与氢元素形成一种分子YH3,写出该粒子的化学式:________。 (4)元素Z与元素T相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是________。 a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定 c.一定条件下Z和T的单质都能与氢氧化钠溶液反应 (5)T、X、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是____________________________________________________________(用化学式表示)。
|
|||||||||||