2017安徽高一下学期人教版高中化学期中考试
| 1. | 详细信息 |
|
下列关于硅的化合物叙述正确的是 A.二氧化硅晶体是由SiO2分子构成的,它的熔点低、硬度大 B.由SiO2不能与水反应生成H2SiO3,可知SiO2不是H2SiO3的酸酐 C.将硫酸和碳酸钠反应产生的气体通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3 D.SiO2既能与NaOH溶液反应又能与氢氟酸反应,所以SiO2是两性氧化物 |
|
| 2. | 详细信息 |
|
下列有关说法正确的是 A. HClO是弱酸,所以NaClO是弱电解质 B.Cl2具有很强的氧化性,在化学反应中只能作氧化剂 C.1.12 L Cl2含有1.7NA个质子(NA 表示阿伏加德罗常数) D.过量的铁粉与氯气反应生成FeCl3 |
|
| 3. | 详细信息 |
|
常温下,将等物质的量的铜片、铁片、铝片、银片 的浓硝酸,放出NO2气体的体积最多的是 A.银片 B . |
|
| 4. | 详细信息 |
|
下列说法正确的是 A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色 B.装满SO2气体的试管倒立在滴有紫色石蕊的水槽中,进入试管的液体呈红色 C.SO2、漂白粉、活性碳、Na2O2都能使红墨水褪色,其原理相同 D.SO2和Cl2等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果更好 |
|
| 5. | 详细信息 |
|
一定能在下列溶液中大量共存的离子组为 A.含有大量Fe2+的溶液:Na+、NH4+、ClO-、SO42- B.含有大量AlO2-的溶液:Na+、K+、NO3-、CO32- C.含有大量氨水的溶液:Ca2+、Mg2+、Ba2+、NO3- D.含有大量NO3 |
|
| 6. | 详细信息 |
|
有关下列实验各装置图的叙述,不正确的是
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2等 C.装置③中X为苯,可用于吸收氨气或氯化氢 D.装置④中可用于收集氨气,并吸收多余的氨气 |
|
| 7. | 详细信息 |
|
下列过程中,最终的白色沉淀不一定是BaSO4的是 A.Ba(NO3)2溶液 B. 无色溶液 C.Ba(NO3)2溶液 D. Fe(NO3)2溶液 |
|
| 8. | 详细信息 |
|
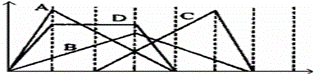
中学常见无机物A、B、C、D、E、X均由短周期元素组成,且存在如下图转化关系(部分反应物、生成物和反应条件略去)。下列推断不正确的是
A. 若D为白色沉淀,且与A的摩尔质量相等,则X一定是铝盐 B.若A是单质,B和D的反应是OH-+ HCO3-=H2O+CO32-, 则E一定能还原CuO C.若B、X均为单质,D为CO,C能和E反应,则E为NaOH D.若X是Na2SO3,C是能使品红溶液褪色的气体,则A可能是氯气,且D和E不反应 |
|
| 9. | 详细信息 |
|
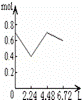
下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列反应对应的曲线错误的是
A.向NaAlO2溶液中滴入HCl至过量 B.向澄清石灰水中通入CO2至过量 C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失 |
|
| 10. | 详细信息 |
|
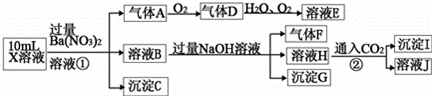
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32ˉ、SO32ˉ、SO42ˉ、C1ˉ中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法不正确的是
A.X中肯定存在Fe2+、A13+、NH4+、SO42ˉ B.X中不能确定的离子是 A13+和C1ˉ C.溶液E和气体F能发生化学反应 D.气体A是NO |
|
| 11. | 详细信息 |
|
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH ①第一份加入AgNO3溶液有沉淀产生; ②第二份加足量NaOH溶液加热后, ③第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是 A.K+一定存在 B.100 mL溶液中含0.01 mol CO C.Cl-一定存在 D.Ba2+一定不存在,Mg2+可能存在 |
|
| 12. | 详细信息 |
|
下列离子方程式正确的是 A. 碳 B. 将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-=2Fe2++S↓ C. 向Fe(NO3) 2稀溶液中加入盐酸:3Fe2++ 4H+ + NO3-=3Fe3++2H2O+NO↑ D. 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
|
| 13. | 详细信息 |
|
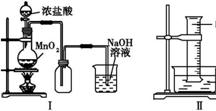
某同学用下列装置制备并检验Cl2的性质。下列说法正确的是
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗 B.Ⅱ图中:如果倒置的量筒充满了氯气,水槽内装满水,经足够长的时间光照,量筒内最后剩余气体为HCl和氧气 C.Ⅲ图中:生成蓝色的烟 D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2 |
|
| 14. | 详细信息 |
|
对下列事实的解释正确的是 A.氯 B.分别用盛满HCl气体和盛满NO2气体的烧瓶做喷泉实验,喷泉结束后,所得溶液的物质 的量浓度相同 C.向50 mL 18 mol·L-1 的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol D.常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应 |
|
| 15. | 详细信息 |
|
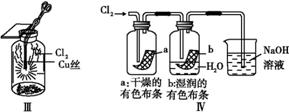
如图所示,A处通入干燥的Cl2,关闭B阀时,C处湿的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是
A.浓H2SO4 B.NaOH溶液 C.浓盐酸 D.饱和NaCl溶液 |
|
| 16. | 详细信息 |
|
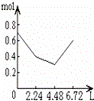
往含0.2mol NaOH和0.1mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(标况)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计) A. |
|
| 17. | 详细信息 | ||||||||||||||||||||||||||
|
.下表中a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是:
|
|||||||||||||||||||||||||||
| 18. | 详细信息 |
|
把一定量的锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体Y 3 A.气体Y是SO2和H2的混合物 B.气体Y是SO2和H2的体积比为4:1 C.反应中共消耗锌97.5 g D.反应中共转移电子3 mol |
|
| 19. | 详细信息 |
|
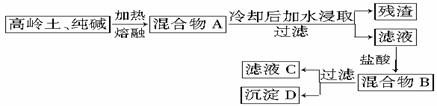
某学习兴趣小组想利用高岭土(其主要成分是Al2O3·2SiO2·2H2O)制备新型的净水
其中滤液C就是欲制备的净水剂。试完成下列问题: (1)写出混合物A、B,滤液C、沉淀D的主要成分: A ;B ;C________;D________。 (2)写出高岭土与纯碱加热熔融的两个化学方程式: 、
(3)该实验中,熔融高岭土、纯碱的混合物可以选用的坩埚有________。 A.玻璃坩埚 B.瓷坩埚 C.氧化铝坩埚 D.铁坩埚 |
|
| 20. | 详细信息 |
|
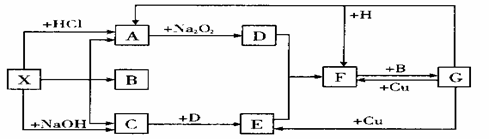
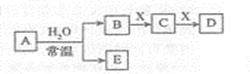
下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X和H是固体,B和G是液体,其余均为气体,1 mol X分解得到A、B、C各1 mol。
试回答下列各题: (1)写出下列物质的化学式:X______________,B__________ (2)写出下列反应的化学方程式: ①G+H→A+F: __________________________。 ②C+D→E:___________________________________________________________。 (3)写出下列反应的离子方程式: G+Cu→E:___________________________________________________________________。 |
|
| 21. | 详细信息 |
|
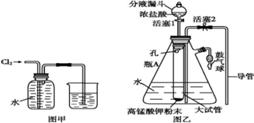
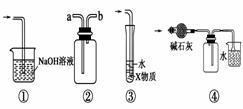
(1)氯水需临时配制的原因是: (用化学方程式表示)。 (2)图甲所示装置中,烧杯内的液体 (3)用图乙所示装置配制氯水时,操作步骤如下: ①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活塞1,将少量浓盐酸注入大试管内。 ②关闭活塞1,盖上分液漏斗上口玻璃塞。浓盐酸和大试管内的高锰酸钾粉末反应产生氯气。 ③轻轻摇动瓶A,使氯气不断溶入水中。 用图乙装置能在较短时间内得到饱和氯水。除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是 (4)配制氯水完成后,不必拆卸装置即可从瓶A中取用少量氯水,方法是 |
|
| 22. | 详细信息 | ||||||||
|
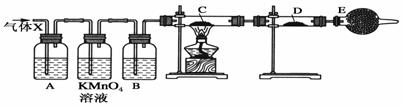
某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证哪位同学的判断正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,气体发生装置略去)。试回答:
(1)上述反应中生成二氧化硫的化学方程式为 。 (2)乙同学认为还可能产生氢气的理由是 。 (3) A中加入的试剂可能是________,作用是__________________;B中加入的试剂可能是________,作用是__________________; (4) 可以证明气体X中含有氢气的实验现象是:C中:________,D中:________。 (5) II.该小组同学将收集的SO2气体通入0.1mol·L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设: 假设一:溶液中的NO3- 假设二:溶液中溶解的O2 该小组设计实 (5)请在下表空白处填写相关实验现象
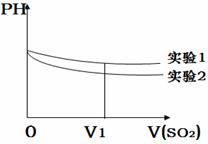
中溶液的pH随通入SO2体积的变化曲线如右图,实 验1中溶液pH变小的原因是 V1时,实验2中溶液pH小于实验1的原因是(用离 子方程式表示) 。 |
|||||||||
 B
B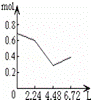 C
C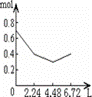 D
D