2018届高三第六次考试理综化学考题带答案和解析(河南省南阳市第一中学)
| 1. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列叙述正确的是( ) A. 2.24 L乙烷中含有的共价键数为0.7NA B. 1L0.1mol?L-1NaHCO3溶液中,HCO3- 和CO32- 离子数之和为0.1NA C. 11g超重水(3H216O)中含有的中子数为6NA D. 0.1mol N2 与0.3 mol H2 在一定条件下充分反应后,生成NH3 分子数为0.2NA |
|
| 2. | 详细信息 | |||||||||||||||
下列实验方案能达到实验目的的是
|
||||||||||||||||
| 3. | 详细信息 |
|
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成,取该溶液进行如下实验: ①取适量试液,加入过量盐酸,有气体生成,并得到澄清溶液 ②在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成;同时析出白色沉淀甲; ③在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。 根据对上述实验的分析判断,最后得出的结论合理的是( ) A. 不能判断溶液中是否存在SO42- B. 溶液中一定不存在CO32- C. 不能判断溶液中是否存在Ag+ D. 不能判断是否含有AlO2-离子 |
|
| 4. | 详细信息 |
有机物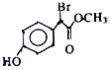 是一种扁桃酸衍生物,下列关于该有机物的说法正确的是 是一种扁桃酸衍生物,下列关于该有机物的说法正确的是A. 该有机物的分子式为C9H10O3Br B. 分子中所有的碳原子一定在同一平面内 C. 1mol该有机物最多与2 molNaOH 反应 D. 该有机物的同分异构体中,属于一元羧酸和酚类化合物且苯环上只有2 个取代基的有12种 |
|
| 5. | 详细信息 |
在初始温度为500℃、容积恒定为10L的三个密闭容器中,如图充料发生反应:CO2(g)+3H2(g)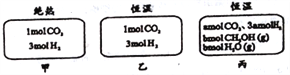 A. 刚开始反应时速率:甲>乙 B. 平衡后反应放热:甲>乙 C. 500℃下该反应平衡常数:K=3×102 D. 若a≠0,则0.9<b<l |
|
| 6. | 详细信息 |
298 K时,某种甲酸(HCOOH)和甲酸钠的混合溶液中HCOOH、HCOO- 的浓度存在关系式c(HCOO-)+c(HCOOH)=0.100mol?L-1,含碳元素的粒子的浓度与pH的关系如图所示。下列说法正确的是( )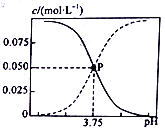 A. 298 K时,HCOOH 的电离常数Ka=1.0×10-10.25 B. 0.1mol?L -1HCOONa溶液中有c(HCOO-)+c(HCOOH)+c(OH- )<c(H+ )+0.1 C. 298 K时,加蒸馏水稀释P点溶液,溶液中n(H+)?n(OH- )增大 D. 0.1mol?L-1 HCOONa溶液和0.1mol?L-1 HCOOH 溶液等体积混合后,溶液的pH=3.75(混合后溶液体积变化忽略不计) |
|
| 7. | 详细信息 | ||||||||||
|
新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4 某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。 实验(一)制备流程:  实验(二) Li2FeSiO4含量测定: 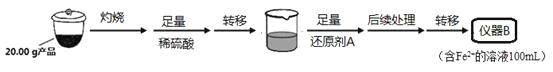 从仪器B中取20.00 mL溶液至锥形瓶中,另取0.2000 mol?Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
|
|||||||||||
| 8. | 详细信息 |
硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如下图所示。 (1)为提高锌灰的浸取率,可采用的方法是____________(填序号)。 ①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌 (2)步骤Ⅱ所得滤渣中的物质是_______________(写化学式)。 (3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂X应为____________。 (4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。 ①检验ZnS固体是否洗涤干净的方法是_________________。 ②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取。化学反应方程式为_______________________________; (5)若步骤Ⅱ加入的ZnCO3为bmol,步骤Ⅲ所得Cd为dmol,最后得到VL、物质的量浓度为cmol/L的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为____________。 |
|
| 9. | 详细信息 | ||||||||
|
化学反应原理在科研和生产中有广泛应用。 (1)用生物质热解气(主要成分为CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟气脱硫。已知: ①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ?mol-1 ②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ?mol-1 ③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ?mol-1 CO将SO2 还原为单质硫的热化学方程式为_____________________________________。 (2)CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)
|
|||||||||
| 10. | 详细信息 |
|
(1)按已知的原子结构规律,27号元素在周期表中的位置是____________,其价电子的轨道排布图为_____________________________。 (2)若en代表乙二胺( (3)BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在。它们的结构简式如下,指出Be的杂化轨道类型。 ①Cl-Be-Cl ____________。 ② ③ (4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。 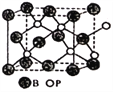 ①画出三溴化硼和三溴化磷的空间结构式(必须体现出分子立体结构)。 三溴化硼____________________。 三溴化磷____________________。 ②在BP晶胞中B的堆积方式为____________。 ③计算当晶胞参数为478pm(即图中立方体的每条边长为478pm)时磷化硼中硼原子和磷原子之间的最近距离____________。 |
|



