2019河北高二下学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
下列表示不正确的是 A.次氯酸的电子式 C.乙烯的结构简式CH2=CH2 D.原子核内有8个中子的碳原子146C
|
|
| 2. | 详细信息 |
|
化学与人类生活密切相关,下列说法不正确的是( ) A. 化石燃料燃烧和工业废气中的氮氧化物是导致“雾霾天气”的原因之一 B. 铝制餐具不宜长时间存放酸性、碱性和咸的食物 C. 用含有铁粉的透气小袋与食品一起密封包装来防止食品氧化 D. 化学药品着火,都要立即用水或泡沫灭火器灭火
|
|
| 3. | 详细信息 |
|
下列叙述中,不正确的是( ) A.CaCO3、Ca(HCO3)2、Cu2(OH)2CO3都属于碳酸盐 B.HCl、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 C.蓝矾(CuSO4·5H2O)和干冰属于化合物,铁矿石属于混合物 D.通过化学反应,可由Ba(OH)2一步转化生成NaOH
|
|
| 4. | 详细信息 |
|
下列变化一定属于化学变化的是( ) ① 工业制O2 ② 爆炸 ③ 缓慢氧化 ④ 品红褪色 ⑤ 无水硫酸铜由白变蓝 ⑥ 久置浓硝酸变黄 ⑦ O2转化为O3 ⑧ 海水中提取金属镁 A. ①②③⑧ B. ④⑤⑥⑧ C. ③⑤⑥⑦⑧ D. ③④⑤
|
|
| 5. | 详细信息 |
|
下列能量转化过程与氧化还原反应无关的是 A.硅太阳能电池工作时,光能转化成电能 B.锂离子电池放电时,化学能转化成电能 C.电解质溶液导电时,电能转化成化学能 D.葡萄糖为人类生命活动提供能量时,化学能转化成热能
|
|
| 6. | 详细信息 |
|
25℃时,下列各组离子在指定溶液中一定能大量共存的是( ) A.pH=1的无色溶液中:Na+、Cu2+、Cl-、CO B.使酚酞呈红色的溶液中:K+、Na+、NO C.0.1mol·L-1的FeCl2溶液中:H+、Al3+、SO D.由水电离出的c(H+)=1×10-10mol·L-1的溶液中:Mg2+、NH
|
|
| 7. | 详细信息 |
|
某溶液X呈无色,且仅可能含有Ba2+、Na+、NH A.肯定不含Cl- B.肯定不含H+ C.肯定不含NH
|
|
| 8. | 详细信息 | |||||||||||||||
|
下列各组离子能大量共存且满足相应要求的是( )
|
||||||||||||||||
| 9. | 详细信息 |
|
某溶液可能含有Cl-、SO A.至少存在5种离子 B.Cl-一定存在,且c(Cl-)≥0.4mol·L-1 C.SO
|
|
| 10. | 详细信息 |
|
能正确表示下列反应的离子方程式的是( ) A.用过量氨水吸收工业尾气中的SO2: 2NH3·H2O+SO2===2NH B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO C.磁性氧化铁溶于足量稀硝酸: Fe3O4+8H+===Fe2++2Fe3++4H2O D.明矾溶液中滴入Ba(OH)2溶液使SO
|
|
| 11. | 详细信息 | |||||||||||||||
|
下列离子方程式的书写及评价均合理的是( )
|
||||||||||||||||
| 12. | 详细信息 |
|
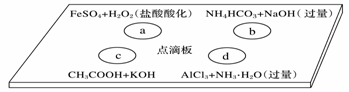
在下图点滴板上进行四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )
A.a反应:Fe2++2H++H2O2===Fe3++2H2O B.b反应:HCO C.c反应:H++OH-===H2O D.d反应:Al3++3NH3·H2O===Al(OH)3↓+3NH
|
|
| 13. | 详细信息 |
|
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是( ) A.标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA B.标准状况下,44.8LNO与22.4LO2混合后气体中分子总数等于2NA C.NO2和H2O反应每生成2molHNO3时转移的电子数目为2NA D.1molFe在氧气中充分燃烧失去3NA个电子
|
|
| 14. | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列说法正确的是( ) A.27g铝加入1mol·L-1的NaOH溶液中,转移电子数是3NA B.56gN2与CO的混合物中原子总数是4NA C. 常温常压下,124 g P4中所含P—P键数目为4NA D.常温下,1LpH=1的H2SO4溶液中的H+数为0.2NA
|
|
| 15. | 详细信息 | |||||||||||||||
|
下列实验中的颜色变化,与氧化还原反应无关的是
|
||||||||||||||||
| 16. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.14 g乙烯和丙烯的混合物完全燃烧时,产生的CO2分子数目为0.5NA B.1 L 0.1 mol/L的CH3COONa溶液中含有的CH3COO-数目为0.1NA C.6 g石英晶体中含有的Si—O键数目为0.4NA D.标准状况下,5.6 L O2和O3混合物中含有的氧原子数目为0.5NA
|
|
| 17. | 详细信息 | |||||||||||||||
|
下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是
|
||||||||||||||||
| 18. | 详细信息 |
|
阿伏加德罗常数的值为NA,实验室制备联氨(N2H4)的化学方程式为:2NH3+NaClO===N2H4+NaCl+H2O。下列说法正确的是( ) A.0.1molN2H4中所含质子数为1.8NA B.0.1mol·L-1的NaClO溶液中,ClO-的数量为0.1NA C.消耗4.48LNH3时,转移电子数为0.2NA D.1.6gN2H4中存在共价键总数为0.2NA
|
|
| 19. | 详细信息 |
|
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( ) A.1∶4 B.1∶2 C.2∶1 D.4∶1
|
|
| 20. | 详细信息 |
|
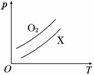
如图表示1 g O2与1 g X气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )
A.C2H4 B.CH4 C.CO2 D.NO
|
|
| 21. | 详细信息 |
|
下列有关溶液配制的说法正确的是( ) A.在50 mL量筒中配制0.100 0 mol/L碳酸钠溶液 B.仅用烧杯、量筒、玻璃棒就可配制100 mL0.100 0 mol/L K2Cr2O7溶液 C.用100 mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管和pH=1的盐酸配制100 mL pH=2的盐酸 D.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余液体吸出
|
|
| 22. | 详细信息 |
|
.某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480 mL含NaClO 25%,密度为1.19 g/cm3的消毒液。下列说法正确的是( ) A.配制过程只需要三种仪器即可完成 B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制 C.所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小 D.需要称量NaClO固体的质量为140 g
|
|
| 23. | 详细信息 |
|
下列有关物质分类的说法中,正确的是( ) A. SiO2不能和水反应,所以它不是酸性氧化物 B. 只由一种元素组成的物质必然是纯净物 C. 烧碱、冰醋酸、石墨均为电解质 D. 海水、氯水、氨水均为混合物
|
|
| 24. | 详细信息 |
|
向100 mL的FeBr2溶液中,通入标准状况下Cl2 5.04 L,Cl2全部被还原,测得溶液中c(Br-)=c(Cl-),则原FeBr2溶液的物质的量浓度是( ) A.0.75mol·L- B.1.5mol·L-1C.2mol·L-1 D.3mol·L-1
|
|
| 25. | 详细信息 |
|
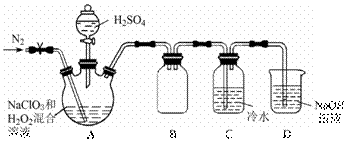
二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题: (1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,该反应的离子方程式是_______。(2分) (2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是____________________(1分)。 ②装置B的作用是__________________。(2分) ③装置A用于生成ClO2气体,该反应的化学方程式是_________________________(2分) (3)测定装置C中ClO2溶液的浓度:取10.00 mL C中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入_________(1分)作指示剂,用0.100 0 mol
|
|
| 26. | 详细信息 |
|
近年来,人类生产、生活所产生的污染,如机动车、燃煤、工业生产等排放的废气,使灰霾天气逐渐增多。灰霾粒子比较小,平均直径在1 000~2 000 nm。下列有关说法正确的是( ) A.灰霾是一种分散系 B.灰霾能发生丁达尔效应 C.灰霾形成的是非常稳定的体系 D.灰霾属于胶体
|
|
| 27. | 详细信息 |
|
现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液 ⑦硝酸亚铁溶液。 (1)上述物质中属于电解质的物质序号为______ 。 (2)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是______。 (3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。 (4)能导电的物质序号为_______________。 (5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)___________________________。 (6)实验室用⑤制备胶体的化学方程式为_______________________。
|
|
| 28. | 详细信息 |
|
用18 mol/L浓硫酸配制100 mL 3.0 mol/L稀硫酸的实验步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解、冷却 ④转移、洗涤 ⑤定容、摇匀 回答下列问题: (1)所需浓硫酸的体积是___(1分)_mL ,量取浓硫酸所用的量筒的规格是_______(1分)。 (从下列规格中选用:A.10 mL B.25 mL C.50 mL D.100 mL) (2)第③步实验的操作是________________________________________________(2分)。 (3)第⑤步实验的操作是_________________________________________________(2分)。 (4)下列情况对所配制的稀硫酸浓度有何影响(用“偏大”“偏小”或“无影响”填写)?(各2分) A.所用的浓硫酸长时间放置在密封不好的容器中_________。 B.容量瓶用蒸馏水洗涤后残留有少量的水________。 C.所用过的烧杯、玻璃棒未洗涤________________。 D.定容时俯视溶液的凹液面________________。
|
|
| 29. | 详细信息 |
|
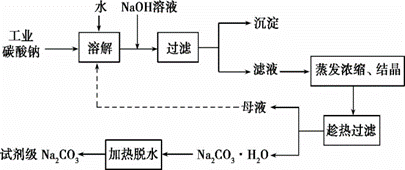
工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Cl-和S等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的简要工艺流程如图:
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
(1)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释 。 (2分) (2)“趁热过滤”时的温度应控制在 。(2分) (3)已知:Na2CO3·10H2O(s) Na2CO3·10H2O(s) 写出Na2CO3·H2O脱水反应的热化学方程式: 。(3分) (4)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用,请你分析实际生产中是否可行: ,(2分)其理由是 (2分)
|
|