2019-2020年高一上册第一次月考化学试卷(陕西省渭南市大荔县同州中学)
| 1. 选择题 | 详细信息 |
|
“雾霾”“PM2.5”已成为电视、新闻热词,下列做法不符合“环境友好”的是( ) A.使用清洁能源,减少煤的燃烧 B.减轻交通压力,提倡私家车出行 C.道路、建筑工地定期喷洒水,减少扬尘 D.种植沙漠防护林,减少沙尘暴 |
|
| 2. 选择题 | 详细信息 |
某试剂瓶标签上安全标志如图,该试剂是( )  A. 氨水 B. 乙酸 C. 氢氧化钠 D. 硝酸 |
|
| 3. 选择题 | 详细信息 |
|
我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑, 蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指 ( ) A. 萃取 B. 过滤 C. 蒸馏 D. 分液 |
|
| 4. 选择题 | 详细信息 |
|
下列常用实验仪器中,一般不用于混合物分离或提纯的是( ) A. |
|
| 5. 选择题 | 详细信息 |
|
下列有关说法正确的是( ) A.容量瓶使用前必须干燥,否则将引起误差 B.蒸馏实验结束后,先停止通冷凝水,再停止加热 C.含硫酸的废液倒入水槽,用水冲入下水道 D.不慎将酒精灯打翻在桌上失火时,立即用湿抹布盖灭 |
|
| 6. 选择题 | 详细信息 |
|
下列有关说法正确的是( ) A.摩尔是表示物质中含有粒子数目多少的一个物理量 B.SO42-的摩尔质量是98g/mol C.22.4L氧气的物质的量为1mol D.标况下,1.12L氢气中含有氢原子个数为6.02×1022 |
|
| 7. 选择题 | 详细信息 |
|
已知NA是阿伏加德罗常数的值,下列说法错误的是( ) A.标况下,16gCH4含有分子数目为NA个 B.0.1 mol·L−1氯化钠溶液含有的Na+数目为0.1NA C.1 molH2O中含有质子数为10NA个 D.标况下,22.4L空气中含有分子总数为NA个 |
|
| 8. 选择题 | 详细信息 |
“宏观-微观-符号”是学习化学的重要内容和方法。下列有关说法错误的是( ) A.甲乙容器中所给物质的组成微粒均为分子 B.甲乙容器可以得出结论为:凡是化学反应,反应前后分子总数不会发生变化 C.此反应后碳元素的化合价升高 D.图甲所示物质中碳、氢元素的质量比是3:1 |
|
| 9. 选择题 | 详细信息 |
|
对1 mol·L-1的MgCl2溶液的有关叙述中,正确的是 A. 该溶液中Cl-浓度为2 mol·L-1 B. 该溶液中Mg2+的物质的量是1 mol C. 可使用250 mL容量瓶分两次完成490 mL该浓度的MgCl2溶液的配制 D. 该溶液可由95g MgCl2·6H2O固体在水中溶解并稀释至1L获得。 |
|
| 10. 选择题 | 详细信息 |
|
下列装置所示的实验中,能达到实验目的的是( ) A.  除去CO2中的HCl 除去CO2中的HClB.  分离碘和酒精 分离碘和酒精C. 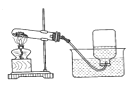 实验室制氧气 实验室制氧气D.  排水法收集氢气 排水法收集氢气 |
|
| 11. 选择题 | 详细信息 |
|
已知MnO2为黑色难溶于水的固体,实验室制取氧气的反应为2KClO3 A. 溶解、过滤、蒸发、洗涤 B. 溶解、过滤、洗涤、加热 C. 溶解、蒸发、洗涤、过滤 D. 溶解、洗涤、过滤、加热 |
|
| 12. 选择题 | 详细信息 |
|
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当它们的体积比为3:2:1时,三种溶液Cl-的浓度比应是( ) A.1:2:3 B.1:1:1 C.3:2:1 D.3:4:3 |
|
| 13. 选择题 | 详细信息 |
|
将100 mL 0.3 mol·L-1和300 mL 0.25 mol·L-1的硫酸注入500 mL容量瓶中,加水稀释至刻度线,该混合溶液中硫酸的物质的量浓度是( ) A.0.21 mol·L-1 B.0.42 mol·L-1 C.0.56 mol·L-1 D.0.26 mol·L-1 |
|
| 14. 选择题 | 详细信息 |
|
①加热试管时,先均匀加热,后局部加热 ②做H2还原CuO实验时,先通H2,后加热CuO,反应完毕后,先撤酒精灯待试管冷却,后停止通H2 ③制取气体时,先检查装置气密性,后装药品 ④点燃可燃性气体如H2、CO等时,先检验气体纯度,后点燃 ⑤制取蒸馏水时,先通冷却水,后加热烧瓶 ⑥进行分液操作时,先从上口倒出上层液体,后从通过下端活塞放出下层液体 A. ①②③④ B. ①②③④⑤ C. ①②③④⑥ D. 全部 |
|
| 15. 选择题 | 详细信息 | |||||||||||||||
下列实验操作规范且能达到目的的是( )
|
||||||||||||||||
| 16. 填空题 | 详细信息 |
化学是一门以实验为基础的学科,实验是进行科学探究的重要方式,认识常见的化学实验仪器是学生必备的学科素养之一。写出题中指定的化学实验仪器的名称。 A.________B.________C.________D.________E.________F.________ |
|
| 17. 计算题 | 详细信息 |
|
化学计量在化学中占有重要地位,根据相关计算填空: ①3gHe是________ molHe,含有的质子数为_______个。 ②1.204×1023个NH3含________mol氨分子,在标准状况下的体积为________L。 ③29.4克硫酸中含有原子总数为________ mol,与_______克NH3含有相同数目的氢原子。 ④在标准状况下,1.6g某气态氧化物RO2体积为0.56L,该气体的物质的量是________ ,摩尔质量是________ ,R的相对原子量为________ 。 ⑤已知Wg气体A含有a个分子,那么在标准状况下,bg气体A所占的体积是________ (其中阿伏加德罗常数用NA表示)。 |
|
| 18. 实验题 | 详细信息 |
海水中蕴藏着丰富的资源,某学习小组在实验室模拟从海水提取氯化钠晶体,其实验流程如下: 通过查阅资料可知:粗盐中含有CaCl2、MgCl2、Na2SO4等杂质。该学习小组通过讨论,设计实验在从粗盐精制得到食盐水的过程为: ①取一定量的粗盐溶解; ②向粗盐水中依次加入过量的Na2CO3溶液、加入过量的NaOH、加入过量的BaCl2溶液; ③过滤; ④向滤液中加入适量盐酸。 回答: (1)溶解时需要的仪器有________。 (2)加入过量的Na2CO3溶液时观察到的现象是________;反应的化学方程式为_______________________________。 (3)实验后,通过进一步反复论证,向老师求证,发现在粗盐精制得到食盐水的设计方案中________(“有”或“没有”)不妥之处,理由是______________________。 (4)该学习小组同学要从食盐水得到氯化钠晶体时,还要进行________、______、过滤。 (5)该学习小组同学用实验得到的晶体配制1mol·L-1的NaCl溶液500mL,在配制过程中,下列操作会引起浓度偏高的是________。 ①没有洗涤烧杯和玻璃棒 ②容量瓶不干燥,含有少量蒸馏水 ③定容时仰视刻度线 ④定容时俯视刻度线 |
|
| 19. 实验题 | 详细信息 |
|
(1)某学生用98%的浓硫酸(密度为1.84 g/cm3)配制100 mL1mol/L的稀硫酸。其实验过程如下: ①该学生所用的98%的浓硫酸(密度为1.84 g/cm3)的物质的量浓度为_______; ②配制稀硫酸时所需要浓硫酸体积为_______mL,用_______量筒(“100 mL”或 “10 mL”)量取浓硫酸; ③将量取的浓硫酸沿烧杯内壁慢慢注入盛有约20mL水的烧杯里,并不断搅拌; ④将____________的上述溶液沿玻璃棒注入100 mL的容量瓶中,并用50mL蒸馏水分2~3次洗涤烧杯,洗涤液也注入容量瓶中,并摇匀; ⑤加水至距刻度线1~2cm时,改用_____________加水,使溶液凹液面跟刻度相平。 (2)该学生通过查阅资料可知,溶液的浓度还可用体积比法表示,如:1:10的硫酸就是将1体积的浓硫酸与10体积的水混合,计算体积比为1:10的硫酸的溶质质量分数为__________(列出计算式即可)。(已知:浓硫酸的质量分数为98%,密度为1.84 g/cm3) |
|
| 20. 填空题 | 详细信息 |
(1)根据如图所示的电解水原理进行实验,观察不同时间试管内的气体体积变化,则甲试管生成的气体是_______。 (2)假设电解了36g水,根据电解水的化学反应式计算生成氢气、氧气质量各为__________g;若在标况下,生成氢气、氧气体积各为_______________? (3)根据实验观察和推算_______(“能”或“否”)得出初步结论:在相同温度和压强下,不同体积的O2和H2的其体积比等于其物质的量之比。 |
|
最近更新



