2018жұҹиӢҸй«ҳдёүдёҠеӯҰжңҹиӢҸж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
ж°®ж°§еҢ–еҗҲзү©еҜ№зҺҜеўғзҡ„жҚҹе®ідҪңз”ЁжһҒеӨ§гҖӮдёӢеҲ—зҺҜеўғй—®йўҳдёӯж°®ж°§еҢ–еҗҲзү©дёҚжҳҜвҖңйҮҚиҰҒжҲҗе‘ҳвҖқзҡ„жҳҜ A.й…ёйӣЁВ В В В В В В В В В В В B.е…үеҢ–еӯҰзғҹйӣҫВ В В В В В C.иҮӯж°§з©әжҙһВ В В В В В В В D.жё©е®Өж•Ҳеә”
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–е·Ҙз”ҹдә§иҝҮзЁӢдёӯпјҢжңӘж¶үеҸҠж°§еҢ–иҝҳеҺҹеҸҚеә”зҡ„жҳҜ A.жө·еёҰжҸҗзўҳВ В В В В В В В B.ж°Ҝзўұе·ҘдёҡВ В В В В В В В C.ж°Ёзўұжі•еҲ¶зўұВ В В В В В D.жө·ж°ҙжҸҗжәҙ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…ізү©иҙЁзҡ„жҖ§иҙЁдёҺз”ЁйҖ”е…·жңүеҜ№еә”е…ізі»зҡ„жҳҜ В A.SO2е…·жңүж°§еҢ–жҖ§пјҢеҸҜз”ЁдәҺжјӮзҷҪзәёжөҶ В B.NaHCO3иғҪдёҺзўұеҸҚеә”пјҢеҸҜз”ЁдҪңз„ҷеҲ¶зі•зӮ№зҡ„иҶЁжқҫеүӮ В C.Fe2(SO4)3жҳ“жә¶дәҺж°ҙпјҢеҸҜз”ЁдҪңеҮҖж°ҙеүӮ В D.ж¶Іж°ЁжұҪеҢ–ж—¶еҗёж”¶еӨ§йҮҸзҡ„зғӯпјҢеҸҜз”ЁдҪңеҲ¶еҶ·еүӮ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
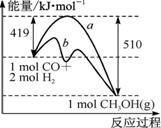
|
зӣ®еүҚеӣҪйҷ…з©әй—ҙз«ҷеӨ„зҗҶCO2зҡ„дёҖдёӘйҮҚиҰҒж–№жі•жҳҜе°ҶCO2иҝҳеҺҹпјҢжүҖж¶үеҸҠзҡ„еҸҚеә”ж–№зЁӢејҸдёәпјҡCO2 (g)+4H2(g) A.жӯЈеҸҚеә”йҖҹзҺҮеҮҸе°ҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В B.йҖҶеҸҚеә”йҖҹзҺҮеўһеӨ§В В C.е№іеқҮзӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёҚеҸҳВ В В В В В В В В В В В В В В В В В В В В D.иҪ¬еҢ–зҺҮеўһеӨ§
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҢҮе®ҡеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜ A.еҗ‘FeCl3жә¶ж¶Ідёӯж»ҙеҠ HIжә¶ж¶ІпјҡFe3пјӢпјӢ2IпјҚ===Fe2пјӢпјӢI2 B.з”Ёй“ңз”өжһҒз”өи§Јж°ҜеҢ–й’ жә¶ж¶Іпјҡ2ClпјҚ+2H2O C.еҗ‘Al2(SO4)3жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙпјҡAl3+пјӢ3NH3В·H2O===Al(OH)3вҶ“пјӢ3NH4пјӢ D.еҗ‘Na2SiO3жә¶ж¶Ідёӯж»ҙеҠ зЁҖзӣҗй…ёпјҡNa2SiO3пјӢ2HпјӢ===H2SiO3вҶ“пјӢ2 Na+
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…із”өеҢ–еӯҰзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A.й“ңзҡ„йҮ‘еұһжҙ»жіјжҖ§жҜ”й“ҒејұпјҢеҸҜеңЁжө·иҪ®еӨ–еЈідёҠ镶е…ҘиӢҘе№Ій“ңеқ—д»ҘеҮҸзј“й“Ғи…җиҡҖ B.еҺҹз”өжұ дёӯпјҢдёҖе®ҡз”ұжҙ»жіјжҖ§ејәзҡ„йҮ‘еұһдҪңиҙҹжһҒпјҢеҸ‘з”ҹж°§еҢ–еҸҚеә” C.еҺҹз”өжұ ж”ҫз”өж—¶зҡ„иҙҹжһҒе’Ңз”өи§Јжұ е……з”өж—¶зҡ„йҳҙжһҒеқҮеҸ‘з”ҹж°§еҢ–еҸҚеә” D.еҸҜе……з”өз”өжұ е……з”өж—¶пјҢиҙҹжһҒдёҺз”өжәҗиҙҹжһҒзӣёиҝһпјҢжӯЈжһҒдёҺз”өжәҗжӯЈжһҒзӣёиҝһ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—дҫқжҚ®зғӯеҢ–еӯҰж–№зЁӢејҸеҫ—еҮәзҡ„з»“и®әжӯЈзЎ®зҡ„жҳҜ A.е·ІзҹҘ2H2(g)пјӢO2(g)===2H2O(g)гҖҖО”HпјқпјҚ483.6 kJВ·molпјҚ1пјҢеҲҷж°ўж°”зҡ„зҮғзғ§зғӯдёә241.8 kJВ·molпјҚ1 B.е·ІзҹҘNaOH(aq)пјӢHCl(aq)===NaCl(aq)пјӢH2O(l)гҖҖО”HпјқпјҚ57.3 kJВ·molпјҚ1пјҢеҲҷеҗ«40.0g NaOHзҡ„зЁҖжә¶ж¶ІдёҺзЁҖйҶӢй…ёе®Ңе…Ёдёӯе’ҢпјҢж”ҫеҮәзҡ„зғӯйҮҸе°ҸдәҺ57.3 kJ C.е·ІзҹҘ2C(s)пјӢ2O2(g)===2CO2(g)гҖҖО”HпјқaпјҢ2C(s)пјӢO2(g)===2CO(g)гҖҖО”HпјқbпјҢеҲҷaпјһb D.е·ІзҹҘCH4(g)пјӢH2O(g) ===В CO(g)пјӢ3 H2(g)В О”H=+206.1 kJВ·molвҖ“1пјҢеҸҚеә”иҝҮзЁӢдёӯдҪҝз”ЁеӮ¬еҢ–еүӮпјҢО”HеҮҸе°Ҹ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
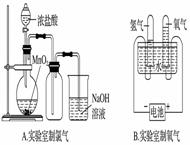
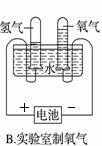
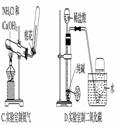
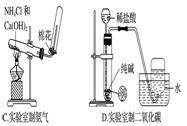
е®һйӘҢе®ӨеҲ¶еҸ–дёӢеҲ—ж°”дҪ“зҡ„е®һйӘҢжӯЈзЎ®зҡ„жҳҜ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁз»ҷе®ҡзҡ„жқЎд»¶дёӢпјҢдёӢеҲ—йҖүйЎ№жүҖзӨәзҡ„зү©иҙЁй—ҙиҪ¬еҢ–еқҮиғҪе®һзҺ°зҡ„жҳҜ A. S B. NH3 C. SiO2
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еӣҫзӨәдёҺеҜ№еә”зҡ„еҸҷиҝ°дёҚзӣёз¬ҰеҗҲзҡ„жҳҜ
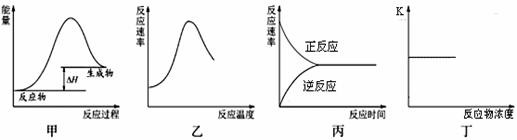
A.еӣҫз”ІиЎЁзӨәзҮғж–ҷзҮғзғ§еҸҚеә”зҡ„иғҪйҮҸеҸҳеҢ– B.еӣҫд№ҷиЎЁзӨәй…¶еӮ¬еҢ–еҸҚеә”зҡ„еҸҚеә”йҖҹзҺҮйҡҸеҸҚеә”жё©еәҰзҡ„еҸҳеҢ– C.еӣҫдёҷиЎЁзӨәеҸҜйҖҶеҸҚеә”д»ҺеҠ е…ҘеҸҚеә”зү©ејҖе§Ӣе»әз«ӢеҢ–еӯҰе№іиЎЎзҡ„иҝҮзЁӢ D.еӣҫдёҒиЎЁзӨәеҸҜйҖҶеҸҚеә”зҡ„е№іиЎЎеёёж•°йҡҸеҸҚеә”зү©жө“еәҰзҡ„еҸҳеҢ–
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ | |||
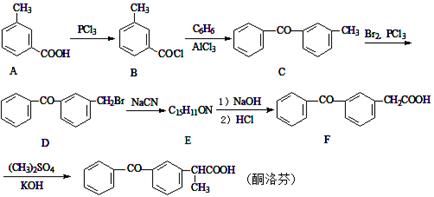
|
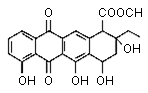
йҳҝе…ӢжӢүй…®жҳҜеҗҲжҲҗжҹҗз§ҚжҠ—зҷҢиҚҜзҡ„йҮҚиҰҒдёӯй—ҙдҪ“пјҢе…¶з»“жһ„еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—е…ідәҺйҳҝе…ӢжӢүй…®зҡ„жҖ§иҙЁзҡ„жҸҸиҝ°пјҢдёҚжӯЈзЎ®зҡ„жҳҜ AпјҺйҳҝе…ӢжӢүй…®зҡ„еҲҶеӯҗејҸдёәC22H22O8 BпјҺеҲҶеӯҗдёӯеҗ«жңү3дёӘжүӢжҖ§зўіеҺҹеӯҗ CпјҺиҜҘеҲҶеӯҗдёҖе®ҡжқЎд»¶дёӢиғҪеҸ‘з”ҹеҸ–д»ЈгҖҒж°§еҢ–гҖҒж¶ҲеҺ»еҸҚеә” DпјҺ1 molиҜҘзү©иҙЁжңҖеӨҡеҸҜдёҺ3 mol NaOHеҸҚеә”
|
||||
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©дёӢпјҢдёӢеҲ—еҗ„з»„зҰ»еӯҗеңЁжҢҮе®ҡжә¶ж¶ІдёӯдёҖе®ҡиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜВ В В В В В В В В В В В В A.0.1 molВ·LпјҚ1 KSCNжә¶ж¶ІдёӯпјҡFe3пјӢгҖҒNH4пјӢ гҖҒBrпјҚгҖҒSO42 пјҚ B. C.иғҪдҪҝз”Іеҹәж©ҷеҸҳзәўзҡ„жә¶ж¶ІдёӯпјҡCu2+гҖҒMg2+гҖҒSO42 пјҚгҖҒClпјҚ D.0.1 molВ·LпјҚ1 Ca(NO3)2жә¶ж¶ІдёӯпјҡNaпјӢгҖҒNH4пјӢ гҖҒCO32 пјҚгҖҒCH3COOпјҚ
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||||||
|
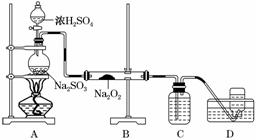
дёӢеҲ—ж°”дҪ“зҡ„еҲ¶еӨҮе’ҢжҖ§иҙЁе®һйӘҢдёӯпјҢз”ұзҺ°иұЎеҫ—еҮәзҡ„з»“и®әй”ҷиҜҜзҡ„жҳҜ
|
||||||||||||||||||||||||||
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
25в„ғж—¶пјҢдёӢеҲ—жңүе…іжә¶ж¶Ідёӯеҫ®зІ’зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰе…ізі»жӯЈзЎ®зҡ„жҳҜ AпјҺ0.1 molВ·LпјҚ1 (NH4)2Fe(SO4)2жә¶ж¶Ідёӯпјҡc(SO42пјҚ)пјһc(NH4+)пјһc(Fe2+)пјһc(H+) BпјҺpHпјқ11зҡ„ж°Ёж°ҙе’ҢpHпјқ3зҡ„зӣҗй…ёжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲпјҢжүҖеҫ—жә¶ж¶Ідёӯпјҡ c(ClпјҚ)пјһc(NH4+)пјһc(OHпјҚ)пјһc(H+) CпјҺеңЁ0.1 molВ·LпјҚ1 Na2CO3жә¶ж¶Ідёӯпјҡ2c(Na+)пјқc(CO DпјҺ0.1 molВ·LпјҚ1зҡ„йҶӢй…ёй’ жә¶ж¶І20 mLдёҺ0.1 molВ·LпјҚ1зӣҗй…ё10 mLж··еҗҲеҗҺжә¶ж¶Іжҳҫй…ёжҖ§пјҡ c(CH3COOпјҚ)пјһc(ClпјҚ)пјһc(CH3COOH)пјһc(H+)
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||
|
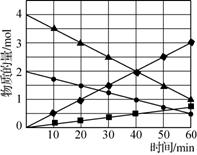
еңЁжё©еәҰT1е’ҢT2ж—¶пјҢеҲҶеҲ«е°Ҷ0.50 mol CH4е’Ң1.20 mol NO2е……е…ҘдҪ“з§Ҝдёә1 Lзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢеҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡCH4(g)пјӢ2NO2(g)
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A. T1ж—¶0пҪһ10 min NO2зҡ„е№іеқҮеҸҚеә”йҖҹзҺҮдёә0.15 molВ·L-1В·min -1 B. T2ж—¶CH4зҡ„е№іиЎЎиҪ¬еҢ–зҺҮдёә70.0% C.дҝқжҢҒе…¶д»–жқЎд»¶дёҚеҸҳпјҢT1ж—¶еҗ‘е№іиЎЎдҪ“зі»дёӯеҶҚе……е…Ҙ0.30 mol CH4е’Ң0.80 mol H2O(g)пјҢе№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁ D.дҝқжҢҒе…¶д»–жқЎд»¶дёҚеҸҳпјҢT1ж—¶еҗ‘е№іиЎЎдҪ“зі»дёӯеҶҚе……е…Ҙ0.50 mol CH4е’Ң1.20 mol NO2пјҢдёҺеҺҹе№іиЎЎзӣёжҜ”пјҢиҫҫж–°е№іиЎЎж—¶N2зҡ„жө“еәҰеўһеӨ§
|
||||||||||||||||||||||
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
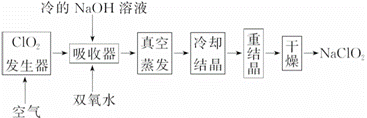
NaClO2зҡ„жјӮзҷҪиғҪеҠӣжҳҜжјӮзҷҪзІүзҡ„4пҪһ5еҖҚпјҢ NaClO2е№ҝжіӣз”ЁдәҺйҖ зәёе·ҘдёҡгҖҒжұЎж°ҙеӨ„зҗҶзӯүгҖӮе·ҘдёҡдёҠз”ҹдә§NaClO2зҡ„е·ҘиүәжөҒзЁӢеҰӮдёӢпјҡ
(1)ClO2еҸ‘з”ҹеҷЁдёӯзҡ„еҸҚеә”дёәпјҡ2NaClO3пјӢSO2пјӢH2SO4===2ClO2пјӢ2NaHSO4гҖӮе®һйҷ…е·Ҙдёҡз”ҹдә§дёӯпјҢеҸҜз”ЁзЎ«й»„гҖҒжө“зЎ«й…ёд»ЈжӣҝеҺҹж–ҷдёӯзҡ„SO2пјҢе…¶еҺҹеӣ дёә__________________(з”ЁеҢ–еӯҰж–№зЁӢејҸиЎЁзӨә)гҖӮ (2)еҸҚеә”з»“жқҹеҗҺпјҢеҗ‘ClO2еҸ‘з”ҹеҷЁдёӯйҖҡе…ҘдёҖе®ҡйҮҸз©әж°”зҡ„зӣ®зҡ„пјҡ________________________гҖӮ (3)еҗёж”¶еҷЁдёӯз”ҹжҲҗNaClO2зҡ„зҰ»еӯҗеҸҚеә”ж–№зЁӢејҸдёә________________________________гҖӮ (4)жҹҗеҢ–еӯҰе…ҙи¶Је°Ҹз»„з”ЁеҰӮдёӢеӣҫжүҖзӨәиЈ…зҪ®еҲ¶еӨҮSO2并жҺўз©¶SO2дёҺNa2O2зҡ„еҸҚеә”пјҡ
в‘ зӣӣж”ҫжө“H2SO4д»ӘеҷЁеҗҚз§°дёә____________гҖӮ в‘ЎDдёӯ收йӣҶеҲ°зҡ„ж°”дҪ“еҸҜдҪҝеёҰдҪҷзғ¬зҡ„жңЁжқЎеӨҚзҮғпјҢBдёӯеҸ‘з”ҹзҡ„еҸҚеә”еҸҜиғҪдёә__________________гҖҒNa2O2пјӢSO2===Na2SO4гҖӮ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||||||
|
з”ІйҶҮжҳҜдёҖз§ҚйҮҚиҰҒеҢ–е·ҘеҺҹж–ҷпјҢеҸҲжҳҜдёҖз§ҚеҸҜеҶҚз”ҹиғҪжәҗпјҢе…·жңүејҖеҸ‘е’Ңеә”з”Ёзҡ„е№ҝйҳ”еүҚжҷҜгҖӮ (1)е·ІзҹҘпјҡCH3OH(g) ===HCHO(g)+H2(g)гҖҖО”H=+84 kJВ·mol-1 2H2(g)+O2(g) ===2H2O(g)гҖҖВ В В О”H=-484 kJВ·mol-1 е·ҘдёҡдёҠеёёд»Ҙз”ІйҶҮдёәеҺҹж–ҷеҲ¶еҸ–з”ІйҶӣпјҢиҜ·еҶҷеҮәCH3OH(g)дёҺO2(g)еҸҚеә”з”ҹжҲҗHCHO(g)е’ҢH2O(g)зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸпјҡгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖӮ (2)е·ҘдёҡдёҠеҸҜз”ЁеҰӮдёӢж–№жі•еҗҲжҲҗз”ІйҶҮпјҢеҢ–еӯҰж–№зЁӢејҸдёәCO(g)+2H2(g)
в‘ иҜҘеҸҚеә”зҡ„О”SгҖҖгҖҖгҖҖгҖҖ(еЎ«вҖң>вҖқжҲ–вҖң<вҖқ)0гҖӮеҸіеӣҫдёӯжӣІзәҝaеҲ°жӣІзәҝbзҡ„жҺӘж–ҪжҳҜгҖҖВ В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘Ўе·ІзҹҘCOдёӯзҡ„CдёҺOд№Ӣй—ҙдёәдёүй”®пјҢе…¶й”®иғҪдёәx kJВ·mol-1пјҢеҲҷx=гҖҖгҖҖгҖҖгҖҖгҖӮ (3)з”ұз”ІйҶҮгҖҒж°§ж°”е’ҢNaOHжә¶ж¶Іжһ„жҲҗзҡ„ж–°еһӢжүӢжңәз”өжұ пјҢеҸҜдҪҝжүӢжңәиҝһз»ӯдҪҝз”ЁдёҖдёӘжңҲжүҚе……дёҖж¬Ўз”өгҖӮ в‘ иҜҘз”өжұ иҙҹжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёәгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖӮ в‘ЎиӢҘд»ҘиҜҘз”өжұ дёәз”өжәҗпјҢз”ЁзҹіеўЁдҪңз”өжһҒз”өи§Ј200 mLеҗ«жңүеҰӮдёӢзҰ»еӯҗзҡ„жә¶ж¶ІгҖӮ
з”өи§ЈдёҖж®өж—¶й—ҙеҗҺпјҢеҪ“дёӨжһҒ收йӣҶеҲ°зӣёеҗҢдҪ“з§Ҝ(зӣёеҗҢжқЎд»¶дёӢ)зҡ„ж°”дҪ“ж—¶(еҝҪз•Ҙжә¶ж¶ІдҪ“з§Ҝзҡ„еҸҳеҢ–еҸҠз”өжһҒдә§зү©еҸҜиғҪеӯҳеңЁзҡ„жә¶и§ЈзҺ°иұЎ)йҳіжһҒдёҠ收йӣҶеҲ°ж°§ж°”зҡ„иҙЁйҮҸдёәгҖҖгҖҖгҖҖгҖҖгҖӮ
(4)з”өи§Јж°ҙи’ёж°”е’ҢCO2дә§з”ҹеҗҲжҲҗж°”(H2+CO)гҖӮиҫғй«ҳжё©еәҰдёӢ(700~1 000 в„ғ)пјҢеңЁSOECдёӨдҫ§з”өжһҒдёҠж–ҪеҠ дёҖе®ҡзҡ„зӣҙжөҒз”өеҺӢпјҢH2Oе’ҢCO2еңЁж°ўз”өжһҒеҸ‘з”ҹиҝҳеҺҹеҸҚеә”дә§з”ҹO2вҲ’пјҢO2вҲ’з©ҝиҝҮиҮҙеҜҶзҡ„еӣәдҪ“ж°§еҢ–зү©з”өи§ЈиҙЁеұӮеҲ°иҫҫж°§з”өжһҒпјҢеңЁж°§з”өжһҒеҸ‘з”ҹж°§еҢ–еҸҚеә”еҫ—еҲ°зәҜO2гҖӮз”ұдёҠеӣҫеҸҜзҹҘAдёәзӣҙжөҒз”өжәҗзҡ„гҖҖ гҖҖгҖҖгҖҖ(еЎ«вҖңжӯЈжһҒвҖқжҲ–вҖңиҙҹжһҒвҖқ)пјҢиҜ·еҶҷеҮәд»ҘH2OдёәеҺҹж–ҷз”ҹжҲҗH2зҡ„з”өжһҒеҸҚеә”ејҸпјҡгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖӮ
|
|||||||||||||||||||||||||
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
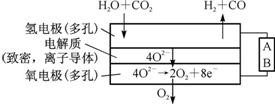
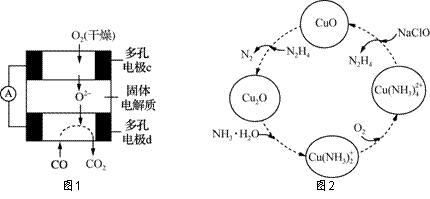
COе’ҢиҒ”ж°Ё(N2H4)зҡ„жҖ§иҙЁеҸҠеә”з”Ёзҡ„з ”з©¶жҳҜиғҪжәҗејҖеҸ‘гҖҒзҺҜеўғдҝқжҠӨзҡ„йҮҚиҰҒиҜҫйўҳгҖӮ (1)в‘ з”ЁCOгҖҒO2е’ҢKOHжә¶ж¶ІеҸҜд»ҘеҲ¶жҲҗзўұжҖ§зҮғж–ҷз”өжұ пјҢеҲҷиҜҘз”өжұ еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘Ўз”ЁCOгҖҒO2е’ҢеӣәдҪ“з”өи§ЈиҙЁиҝҳеҸҜд»ҘеҲ¶жҲҗеҰӮдёӢеӣҫ1жүҖзӨәзҡ„зҮғж–ҷз”өжұ пјҢеҲҷз”өжһҒdзҡ„з”өжһҒеҸҚеә”ејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ (2)иҒ”ж°Ёзҡ„жҖ§иҙЁзұ»дјјдәҺж°Ёж°”пјҢе°ҶиҒ”ж°ЁйҖҡе…ҘCuOжөҠж¶ІдёӯпјҢжңүе…ізү©иҙЁзҡ„иҪ¬еҢ–еҰӮеӣҫ2жүҖзӨәгҖӮ В В В В В В В
в‘ еңЁеӣҫзӨә2зҡ„иҪ¬еҢ–дёӯпјҢеҢ–еҗҲд»·дёҚеҸҳзҡ„е…ғзҙ жҳҜВ В В В В В В В (еЎ«е…ғзҙ еҗҚз§°)гҖӮ в‘ЎеңЁиҪ¬еҢ–иҝҮзЁӢдёӯйҖҡе…Ҙж°§ж°”еҸ‘з”ҹеҸҚеә”еҗҺпјҢжә¶ж¶Ізҡ„pHе°ҶВ В В В В В В (еЎ«вҖңеўһеӨ§вҖқгҖҒвҖңеҮҸе°ҸвҖқжҲ–вҖңдёҚеҸҳвҖқ)гҖӮ иҪ¬еҢ–дёӯеҪ“жңү1 mol N2H4еҸӮдёҺеҸҚеә”ж—¶пјҢйңҖиҰҒж¶ҲиҖ—O2зҡ„зү©иҙЁзҡ„йҮҸдёәВ В В В В В В гҖӮ в‘ўеҠ е…ҘNaClOж—¶еҸ‘з”ҹзҡ„еҸҚеә”дёәпјҡ Cu(NH3)
В В еӣҫ3 (3)COдёҺSO2еңЁй“қзҹҫеңҹдҪңеӮ¬еҢ–еүӮгҖҒ773 KжқЎд»¶дёӢеҸҚеә”з”ҹжҲҗCO2е’ҢзЎ«и’ёж°”пјҢиҜҘеҸҚеә”еҸҜз”ЁдәҺд»ҺзғҹйҒ“ж°”дёӯеӣһ收硫пјҢеҸҚеә”дҪ“зі»дёӯеҗ„з»„еҲҶзҡ„зү©иҙЁзҡ„йҮҸдёҺеҸҚеә”ж—¶й—ҙзҡ„е…ізі»еҰӮеӣҫ3жүҖзӨәпјҢеҶҷеҮәиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
й…®жҙӣиҠ¬жҳҜдёҖз§ҚиүҜеҘҪзҡ„жҠ—зӮҺй•Үз—ӣиҚҜпјҢеҸҜд»ҘйҖҡиҝҮд»ҘдёӢж–№жі•еҗҲжҲҗпјҡ
(1)й…®жҙӣиҠ¬дёӯеҗ«ж°§е®ҳиғҪеӣўзҡ„еҗҚз§°дёәВ В В В В В В В е’ҢВ В В В В гҖҖгҖӮ (2)еҢ–еҗҲзү©Eзҡ„з»“жһ„з®ҖејҸдёәВ В В В В В гҖҖпјӣз”ұCвҶ’Dзҡ„еҸҚеә”зұ»еһӢжҳҜВ В В В В гҖҖгҖӮ (3)еҶҷеҮәBвҶ’Cзҡ„еҸҚеә”ж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ (4)еҶҷеҮәеҗҢж—¶ж»Ўи¶ідёӢеҲ—жқЎд»¶зҡ„Aзҡ„дёҖз§ҚеҗҢеҲҶејӮжһ„дҪ“зҡ„з»“жһ„з®ҖејҸВ В В В В В В В В В В В В В В В В гҖҖгҖӮ в‘ иғҪеҸ‘з”ҹ银й•ңеҸҚеә”пјӣв‘ЎдёҺFeCl3еҸ‘з”ҹжҳҫиүІеҸҚеә”пјӣв‘ўеҲҶеӯҗдёӯеҗ«жңү5з§ҚдёҚеҗҢеҢ–еӯҰзҺҜеўғзҡ„ж°ўгҖӮ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
зўұејҸзўій…ёй’ й“қ[NaaAlb(OH)c(CO3)d]еҸҜз”ЁдҪңйҳ»зҮғеүӮгҖҒжҠ—й…ёеүӮзӯүгҖӮ В В В е…¶еҲ¶еӨҮж–№жі•жҳҜпјҡжҺ§еҲ¶жё©еәҰгҖҒpHпјҢеҗ‘NaHCO3зЁҖжә¶ж¶ІдёӯеҠ е…ҘAl(OH)3пјҢ并жҗ…жӢҢпјҢе……еҲҶеҸҚеә”еҗҺиҝҮж»ӨгҖҒжҙ—ж¶ӨгҖҒе№ІзҮҘпјҢеҫ—зўұејҸзўій…ёй’ й“қгҖӮ (1) зўұејҸзўій…ёй’ й“қ[NaaAlb(OH)c(CO3)d]дёӯaгҖҒbгҖҒcгҖҒdд№Ӣй—ҙзҡ„е…ізі»дёә________гҖӮ (2) зўұејҸзўій…ёй’ й“қдҪңдёәйҳ»зҮғеүӮзҡ„еҸҜиғҪеҺҹеӣ пјҡв‘ еңЁеҲҶи§ЈиҝҮзЁӢдёӯеӨ§йҮҸеҗёзғӯпјӣв‘Ўжң¬иә«еҸҠдә§зү©ж— жҜ’дё”дёҚеҸҜзҮғпјӣ в‘ўВ В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ (3) иӢҘpHиҝҮй«ҳпјҢеҲҷеҜ№дә§е“Ғзҡ„еҪұе“ҚжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В гҖӮ (4) дёәзЎ®е®ҡзўұејҸзўій…ёй’ й“қзҡ„з»„жҲҗпјҢиҝӣиЎҢеҰӮдёӢе®һйӘҢпјҡ в‘ еҮҶзЎ®з§°еҸ–2.880 gж ·е“Ғз”Ёи¶ійҮҸзЁҖзЎқй…ёжә¶и§ЈпјҢеҫ—еҲ°CO2 0.448 L(е·ІжҚўз®—жҲҗж ҮеҮҶзҠ¶еҶөдёӢ)гҖӮеңЁжүҖеҫ—жә¶ж¶ІдёӯеҠ иҝҮйҮҸж°Ёж°ҙпјҢеҫ—еҲ°зҷҪиүІжІүж·ҖпјҢз»ҸиҝҮж»ӨгҖҒжҙ—ж¶ӨжІүж·ҖгҖҒе……еҲҶзҒјзғ§еҫ—еҲ°1.02gеӣәдҪ“гҖӮ в‘ЎеҠ зғӯиҮі340 в„ғд»ҘдёҠж—¶ж ·е“Ғиҝ…йҖҹеҲҶи§ЈпјҢеҫ—еҲ°йҮ‘еұһж°§еҢ–зү©гҖҒCO2е’ҢH2OгҖӮеҪ“ж ·е“ҒеҲҶи§Је®Ңе…Ёж—¶пјҢж ·е“Ғзҡ„еӣәдҪ“ж®Ӣз•ҷзҺҮдёә56.9%пјҢж №жҚ®д»ҘдёҠе®һйӘҢж•°жҚ®зЎ®е®ҡзўұејҸзўій…ёй’ й“қзҡ„з»„жҲҗ(еҶҷеҮәи®Ўз®—иҝҮзЁӢ)гҖӮ
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
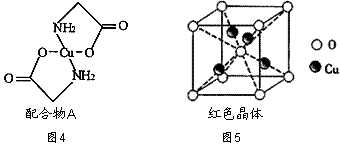
е·ІзҹҘпјҡзЎ«й…ёй“ңжә¶ж¶Ідёӯж»ҙе…Ҙж°Ёеҹәд№ҷй…ёй’ (H2NпјҚCH2пјҚCOONa)еҚіеҸҜеҫ—еҲ°й…ҚеҗҲзү©AгҖӮе…¶з»“жһ„еҰӮеӣҫ4жүҖзӨәпјҡ В В В В В В В
В (1)Cuе…ғзҙ еҹәжҖҒеҺҹеӯҗзҡ„еӨ–еӣҙз”өеӯҗжҺ’еёғејҸдёәВ В В В В В В В В В В В В гҖӮ (2)е…ғзҙ CгҖҒNгҖҒOзҡ„第дёҖз”өзҰ»иғҪз”ұеӨ§еҲ°е°ҸжҺ’еҲ—йЎәеәҸдёәВ В В В В В В В В В В В В В гҖӮ (3)й…ҚеҗҲзү©AдёӯзўіеҺҹеӯҗзҡ„иҪЁйҒ“жқӮеҢ–зұ»еһӢдёәВ В В В В В В В В В В В В В В В В В В В В В гҖӮ (4)1molж°Ёеҹәд№ҷй…ёй’ (H2NпјҚCH2пјҚCOONa)еҗ«жңү (5)ж°Ёеҹәд№ҷй…ёй’ еҲҶи§Јдә§зү©д№ӢдёҖдёәдәҢж°§еҢ–зўігҖӮеҶҷеҮәдәҢж°§еҢ–зўізҡ„дёҖз§Қзӯүз”өеӯҗдҪ“пјҡВ В В В В В В В В В В (еҶҷеҢ–еӯҰејҸ)гҖӮ (6)е·ІзҹҘпјҡзЎ«й…ёй“ңзҒјзғ§еҸҜд»Ҙз”ҹжҲҗдёҖз§ҚзәўиүІжҷ¶дҪ“пјҢе…¶з»“жһ„еҰӮеӣҫ5жүҖзӨәпјҢеҲҷиҜҘеҢ–еҗҲзү©зҡ„еҢ–еӯҰејҸжҳҜВ В В В В В В В В В В В гҖӮ
|
|
- 2019-2020е№ҙеәҰй«ҳдёҖдёҠеҚҠжңҹ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰиҜ•еҚ·е®Ңж•ҙзүҲпјҲиҙөе·һзңҒиҙөйҳідёҖдёӯпјү
- жұҹиҘҝзңҒе®ңжҳҘеёӮдёҠй«ҳдәҢдёӯ2020еұҠй«ҳдёүдёҠеҚҠжңҹ第еӣӣж¬ЎжңҲиҖғзҗҶз»јеҢ–еӯҰиҖғиҜ•
- й»”еҚ—еёғдҫқж—ҸиӢ—ж—ҸиҮӘжІ»е·һиҙөе®ҡеҺҝ第дәҢдёӯеӯҰй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•ж‘ёеә•иҖғиҜ•йўҳеҗҢжӯҘи®ӯз»ғ
- й«ҳдёүеҢ–еӯҰдёҠеҶҢдё“йўҳз»ғд№ еңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ
- 2018-2019е№ҙй«ҳдәҢдёҠеҚҠжңҹ第дёүж¬ЎжңҲиҖғеҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·WordзүҲеҗ«зӯ”жЎҲпјҲеұұдёңзңҒжІӮж°ҙеӨ–еӣҪиҜӯпјү
- й«ҳдёҖ6жңҲжңҲиҖғеҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲ2019-2020е№ҙиҫҪе®ҒзңҒжІҲйҳіеёӮеӣһж°‘дёӯеӯҰпјү
- 2019-2020е№ҙй«ҳдёҖдёӢеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•йўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲжұҹиӢҸзңҒиӢҸе·һеёӮеҗҙжұҹеҢәжұҫж№–й«ҳзә§дёӯеӯҰпјү
- 2018-2019е№ҙй«ҳдёҖ第дәҢеӯҰжңҹе…ҘеӯҰиҖғиҜ•еҢ–еӯҰиҖғйўҳеҗҢжӯҘи®ӯз»ғпјҲзҰҸе»әзңҒдёүжҳҺеёӮе°ӨжәӘеҺҝ第дёҖдёӯеӯҰпјү