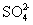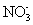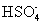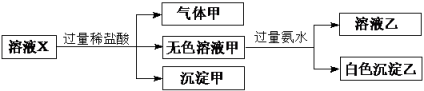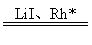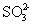河南省名校2022届高三上学期第一次调研考试化学试题含详解
| 1. | 详细信息 |
|
《天工开物》中记载: “ 石胆 - 名胆矾者,亦出晋、隰等州,乃山石穴中自结成者,故绿色带宝光。烧铁器淬于胆矾水中,即成铜色也。 ” 《本草纲目》记载: “ 灵砂亦名二气砂,乃水银、硫磺合炼而成 ” 古文中 “ 石胆 ” 和 “ 灵砂 ” 的主要成分分别是 A . CuSO 4 ·5H 2 O 、 HgS B . CuSO 4 、 S C . KAl(SO 4 ) 2 ·12H 2 O 、 FeO D . CuSO 4 ·2H 2 O 、 FeS |
|
| 2. | 详细信息 | ||||||||
|
邮票记载了我国发展历程,形象地呈现了人类与化学相互依存的关系,下列邮票相关的叙述中没有发生化学变化的是
A . A B . B C . C D . D |
|||||||||
| 3. | 详细信息 |
|
在实验室采用如图所示装置进行气体的制备、收集、尾气处理,合理的是 A . 用氢氧化钙与氯化铵制备氨气 B . 用浓硝酸与铝制备二氧化氮 C . 用二氧化锰与浓盐酸制备氯气 D . 用 70% 浓硫酸与亚硫酸钠制备二氧化硫 |
|
| 4. | 详细信息 |
|
化学与生活、生产及科技密切相关,下列有关说法错误的是 A . 用水玻璃浸泡过的纺织品可防火 B . 纳米铁粉主要通过物理吸附作用除去污水中的 Cu 2+ 、 Ag + 、 Hg 2+ C . 中国 “ 奋斗者 ” 号万米载人潜水器的钛合金材料是金属材料 D . 75%( 体积分数 ) 的酒精、含氯消毒剂均可以有效灭活新型冠状病毒 |
|
| 5. | 详细信息 |
|
甲、乙、丙、丁对应的物质与图示类别相符的是 A . 甲 —— 氧化钠 B . 乙 —— 氯化钾 C . 丙 —— 次氯酸钠 D . 丁 —— 氢氧化钠 |
|
| 6. | 详细信息 |
|
下列物质鉴别或除杂的方法错误的是 A . 可用 NaOH 溶液除去氧化镁中的硅单质 B . 可用 AgNO 3 溶液鉴别二氧化氮和溴蒸气 C . 可用饱和 NaHCO 3 溶液除去氯气中的氯化氢 D . 可用稀盐酸鉴别 K 2 CO 3 和 NaHCO 3 两种溶液 |
|
| 7. | 详细信息 | ||||||||||||||||||||
|
甲、乙、丙三种物质中均含有某种相同的元素,它们之间具有如图所示的转化关系 ( 反应条件及部分产物已略去 ) ,不能按箭头指示一步实现的是
A . A B . B C . C D . D |
|||||||||||||||||||||
| 8. | 详细信息 |
|
下列离子方程式书写错误的是 A . 将 SO 2 通入碘水中: I 2 +SO 2 +2H 2 O=4H + + B . 过量铁粉与稀硝酸反应: Fe+4H + + C . 工业上制备漂白液: 2OH - +Cl 2 =Cl - +ClO - +H 2 O D . Na 2 O 2 与足量盐酸反应: 2Na 2 O 2 +4H + =4Na + +O 2 ↑+2H 2 O |
|
| 9. | 详细信息 | ||||||||||||||||||||
|
下列由实验操作和现象得出的结论正确的是
A . A B . B C . C D . D |
|||||||||||||||||||||
| 10. | 详细信息 |
|
设阿伏加德罗常数的值为 N A , NaOCN 与 NaClO 发生反应: 2NaOCN+3NaClO=Na 2 CO 3 +3NaCl+CO 2 ↑+N 2 ↑ 。下列有关说法正确的是 A . 常温下, pH=12 的 Na 2 CO 3 溶液中含 OH - 数目为 0.01N A B . 每消耗 1 mol NaOCN ,上述反应中转移的电子数目为 6N A C . 1 mol NaClO 和 NaOCN 的混合物中含 Na + 离子和 O 原子数目均为 N A D . 若有 11.2LN 2 生成,则上述反应中生成的 CO 2 中含质子数目为 11N A |
|
| 11. | 详细信息 |
|
雾霾微颗粒中硫酸盐的生成可能存在三个阶段的转化,其主要过程的示意图如下。下列说法正确的是 A . B . 第 I 阶段的反应中 NO 2 被氧化 C . HNO 2 、 NO 2 、 H 2 O 均为电解质 D . 第 II 、 III 阶段总反应的化学方程式为 |
|
| 12. | 详细信息 |
|
某混合物粉末由两种物质组成,为鉴别其成分进行如下实验: ①取少量样品于试管中,加入足量稀盐酸,有气泡产生,振荡后固体全部溶解,再加入足量碳酸氢钠溶液,既有沉淀产生,又有气泡产生; ②取少量样品于试管中,加入足量氢氧化钠溶液,振荡后固体部分溶解。 该混合物粉末可能为 A . Al 2 O 3 、 BaCO 3 B . NaHSO 3 、 Al(OH) 3 C . SiO 2 、 Fe 2 O 3 D . CaCO 3 、 CuO |
|
| 13. | 详细信息 |
|
高铁酸钠 (Na 2 FeO 4 ) 具有优异的氧化漂白、杀菌作用。工业上可以用下列四种方法制备高铁酸钠: ① Fe 2 O 3 +Na 2 O 2 →Na 2 FeO 4 +Na 2 O ② FeSO 4 +Na 2 O 2 →Na 2 FeO 4 +Na 2 O+Na 2 SO 4 +O 2 ↑ ③ Fe(NO 3 ) 3 +NaOH+Cl 2 →Na 2 FeO 4 +NaNO 3 +NaCl+H 2 O ④ Fe(OH) 3 +NaClO+NaOH→Na 2 FeO 4 +NaCl+H 2 O 下列说法正确的是 A . 反应 ①和②中 Na 2 O 2 均只作氧化剂 B . Na 2 FeO 4 的氧化性强于 NaClO 、 Na 2 O 2 C . 反应 ③中氧化产物和还原产物的物质的量比为 2 : 3 D . 反应 ④中转移 3mol 电子时,消耗 2mol NaOH |
|
| 14. | 详细信息 |
|
化学中常用图像直观地描述化学反应的进程或结果。向 100 mL 浓度均为 1.0 mol·L -1 的 Na 2 CO 3 、 NaAlO 2 混合溶液中滴加 2.0 mol·L -1 盐酸,下列图像描述正确的是 A . C . |
|
| 15. | 详细信息 |
|
锗在航空航天测控、核物理探测、光纤通讯、红外光学、化学催化剂、生物医学等领域有广泛而重要的应用。一种从二氧化锗粗品 ( 主要含 GeO 2 、 As 2 O 3 ) 中制备锗的工艺流程如下: 已知: i.GeO 2 与 Al 2 O 3 的性质相似; ii.GeCl 4 极易水解, GeCl 4 的沸点为 86.6℃ ; iii.As 2 O 3 +2NaOH=2NaAsO 2 +H 2 O , NaAsO 2 与盐酸反应生成有毒的 AsCl 3 。 下列说法正确的是 A . “ 蒸馏 ” 步骤中用 1 mol·L -1 盐酸比 7 mol·L -1 盐酸的效果好 B . 在实验室中蒸馏需要用到的玻璃仪器有冷凝管、牛角管、蒸发皿、锥形瓶 C . “ 水解 ” 反应的化学方程式为 GeCl 4 +(n+2)H 2 O=GeO 2 ·nH 2 O↓+4HCl D . “ 氧化 ” 的目的是将 NaAsO 2 氧化为 Na 3 AsO 4 ,该反应中氧化剂与还原剂的物质的量比为 3 : 1 |
|
| 16. | 详细信息 |
|
向体积均为 V mL 的 0.5 mol·L -1 FeI 2 和 c mol·L -1 FeBr 2 两种溶液中分别滴加 100 mL 等浓度的 NaNO 3 溶液,并加入足量稀硫酸, NO 3 - 全部转化为 NO ,两种溶液反应转移的电子均为 0.3 mol , FeI 2 恰好反应完全 (I - 只被氧化为 I 2 ) , FeBr 2 溶液中 Fe 2+ 恰好被完全氧化。下列说法正确的是 A . V 为 100 B . 两种溶液反应生成 NO 的质量均为 6.0g C . c 为 1.5 D . |
|
| 17. | 详细信息 |
|
2021 年在四川广汉三星堆新发现大量青铜器。下列有关说法错误的是 A . 铜是人类使用最早的金属之一 B . 青铜比纯铜具有更高的硬度和更强的抗腐蚀性能 C . 出土的青铜器深埋于地下生锈是因为发生了析氢腐蚀 D . 青铜是铜锡铅等的合金,常见的铜合金还有黄铜和白铜 |
|
| 18. | 详细信息 |
|
设 N A 为阿伏加德罗常数的值,下列叙述正确的是 A . 标准状况下, 22.4 LSO 3 含有的氧原子数为 3 N A B . 11.2LCH 4 和 O 2 的混合气体中所含的分子数为 0.5N A C . 在常温常压下, 0.1 mol 铁与 0.1 molCl 2 充分反应,转移的电子数为 0.3N A D . 标准状况下, 22.4LNO 和 11.2LO 2 混合后气体的分子总数小于 N A |
|
| 19. | 详细信息 |
|
下列反应的离子方程式中正确的是 A . 过量铁粉加入稀硝酸中: Fe+2H + =Fe 2+ +H 2 ↑ B . 向 AlCl 3 溶液中滴加过量氨水: Al 3+ +4NH 3 •H 2 O=AlO C . 向水中通入氯气: Cl 2 + H 2 O D . 饱和 Na 2 CO 3 溶液与 CaSO 4 固体反应: CO |
|
| 20. | 详细信息 |
|
下列有关物质的性质及用途描述不正确的是 A . Na 2 O 2 与 H 2 O 、 CO 2 反应均有 O 2 生成,故 Na 2 O 2 可用作呼吸面具中的供氧剂 B . 氢硫酸的酸性比硫酸弱,可以向硫化钠固体中滴加浓硫酸的方法制备 C . 漂白粉可与 CO 2 反应生成 HClO ,可用于自来水的杀菌消毒 D . 钠的熔点较低,可用作液态金属导热剂 |
|
| 21. | 详细信息 | |||||||||||||||
|
下列去除产品里少量杂质的方法,不合理的是
A . A B . B C . C D . D |
||||||||||||||||
| 22. | 详细信息 |
|
水溶液 X 中只可能溶有 K + 、 Mg 2 + 、 Al 3 + 、 AlO 下列判断正确的是 A . 气体甲一定是纯净物 B . 沉淀甲是硅酸和硅酸铝的混合物 C . 所有阴离子都可能存在于溶液 X 中 D . 沉淀乙可能是 Mg(OH) 2 和 Al(OH) 3 的混合物 |
|
| 23. | 详细信息 |
|
下列说法 不正确 的是 A . 工业上利用铝热反应可以冶炼铁、钒、铬、锰等金属 B . 镁燃烧会发出耀眼的白光,可用于制造信号弹和焰火 C . 硫酸钡难溶于水和酸是可用作透视胃肠的内服药剂原因之一 D . 工业上燃煤脱硫可采用将煤燃烧后的烟气通过氨水吸收后再排放的方法 |
|
| 24. | 详细信息 |
|
工业上用 CO 2 合成乙酸的反应路径如图所示: 下列说法错误的是 A . 反应过程中碳元素的化合价始终不变 B . 第 4 步反应的氧化剂是 CH 3 COORh*I C . HI 、 LiOH 、 CH 3 I 、 CH 3 Rh*I 、 CH 3 COORh*I 为反应的中间产物 D . 催化循环的总反应为 CH 3 OH+CO 2 +H 2 |
|
| 25. | 详细信息 |
|
在甲、乙两个体积不同的密闭容器中,分别充入质量相同的 CO 、 CO 2 气体时,两容器的温度和压强均相同,则下列说法正确的是 A . CO 分子数比 CO 2 分子数少 B . 甲容器的体积比乙容器的体积小 C . CO 的摩尔体积比 CO 2 的摩尔体积小 D . 甲中 CO 的密度比乙中 CO 2 的密度小 |
|
| 26. | 详细信息 |
|
下列说法中,正确的是 A . 可以用过滤的方法分离 FeCl 3 溶液和 Fe(OH) 3 胶体 B . Fe(OH) 3 胶体无色、透明,能产生丁达尔效应 C . 硫酸溶液的导电性不一定比醋酸溶液的导电性强 D . 依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
|
| 27. | 详细信息 |
|
钒元素在酸性溶液中有多种存在形式,其中 VO 2+ 为蓝色, VO A . 在酸性溶液中氧化性: MnO B . 亚硫酸钠溶液与酸性 (VO 2 ) 2 SO 4 溶液发生反应: 2VO C . 向 VOSO 4 溶液中滴加酸性 KMnO 4 溶液反应化学方程式为: 10VOSO 4 +2H 2 O+2KMnO 4 =5(VO 2 ) 2 SO 4 +2MnSO 4 +2H 2 SO 4 +K 2 SO 4 D . 向含 1molVO |
|
| 28. | 详细信息 |
|
2020 年 11 月 “嫦娥五号”成功着陆月球,展示了以芳纶为主制成的五星红旗,用 SiC 增强铝基材料钻杆 “挖土”,实现了中国首次月球无人采样返回。研究表明月球表面的“土壤”主要含有氧,硅、铝、铁、镁、钙和钠等元素。下列有关说法不正确的是 A . 月球表面的 “土壤”所含金属元素镁和铝均可以通过电解其熔融氯化物进行冶炼 B . 制造探测器中的瞄准镜时使用光导纤维,其主要成分是 SiO 2 C . 嫦娥五号望远镜的某些部件由 SiC 制成,硬度高,耐高温 D . “嫦娥五号”使用的碳纤维被誉为“新材料之王”,是一种新型无机非金属材料 |
|
| 29. | 详细信息 |
|
图中实验装置正确,且能达到实验目的的是 A . 利用图 1 装置模拟石油的分馏 B . 利用图 2 装置检验 NH 4 Cl 分解产生的两种气体 C . 利用图 3 装置蒸发结晶得到食盐晶体 D . 利用图 4 装置配制一定物质的量浓度的硫酸 |
|
| 30. | 详细信息 |
|
下图六个操作是常见物质的分离提纯操作,则有关这的说法不正确的是 A . 操作 1 、操作 2 、操作 6 都可以是蒸馏,也可以是蒸发 B . 操作 2 可以是蒸发浓缩、冷却结晶、过滤 C . 操作 3 可以是洗涤、干燥 D . 操作 4 、操作 5 分别是萃取、分液 |
|
| 31. | 详细信息 |
|
常温下,下列各组离子在指定溶液中能大量共存的是 A . 能使甲基橙变红的溶液中: B . C . 中性溶液中: D . |
|
| 32. | 详细信息 |
|
某废催化剂含 SiO 2 、 ZnS 、 CuS 及少量的 Fe 3 O 4. 某实验小组以该废催化剂为原料,回收锌和铜,设计实验流程如图: 下列说法正确的是 A . 滤渣 2 的主要成分 H 2 SiO 3 B . 检验滤液 1 中是否含有 Fe 2+ ,可以选用 KSCN 和新制的氯水 C . 步骤 ②操作中,应先加 6% H 2 O 2 ,然后不断搅拌下缓慢加入 1.0mol·L -1 H 2 SO 4 D . 步骤 ③、④操作是蒸发浓缩至出现晶体时停止加热,冷却结晶,过滤 |
|
| 33. | 详细信息 |
|
常温下, 200 mL 某透明溶液中可能含有 Na + 、 Al 3+ 、 请回答下列问题: ( 1 ) 一定不存在的离子是 ___________ ,沉淀丙的化学式为 ___________ 。 ( 2 ) 向溶液甲中加入足量铜产生无色气体的离子方程式为 ___________ 。 ( 3 ) 200 mL 溶液中 ( 4 ) 该溶液中一定存在的阳离子的物质的量比为 ___________ ( 要指明相应的离子 ) 。 ( 5 ) 该溶液中是否存在 Cl - ? ___________ ( 填 “ 是 ” 或 “ 否 ”) 。 |
|
| 34. | 详细信息 |
|
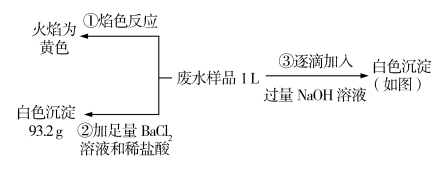
已知:某无色废水中可能含有 H + 、 请回答下列问题: (1) 根据上述 3 组实验可以分析废水中一定不存在的阴离子是 ______________ ,一定存在的阳离子是 ______________ 。 (2) 写出实验 ③ 图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子方程式 ________ 。 (3) 分析图像,在原溶液中 c( (4) 若通过实验确定原废水中 c(Na + )=0.18 mol·L −1 ,试判断原废水中 |
|
| 35. | 详细信息 |
|
硒化镉 (CdSe) 用于电子发射器和光谱分析、光导体、半导体、光敏元件等。以镉铁矿 ( 成分为 CdO 、 Fe 2 O 3 、 FeO 及少量的 Al 2 O 3 和 SiO 2 ) 为原料制备硒化镉和铁红的工艺流程如图所示: 已知 CdSO 4 易溶于水。 回答下列问题: ( 1 ) “ 酸浸 ” 时, CdO 与稀硫酸反应的离子方程式为 ___________ 。 ( 2 ) 常温下,下列物质能与滤渣 1 发生反应的是 ___________ ( 填序号 ) 。 a. 浓硝酸 b. 碳酸钠 c. 氢氟酸 ( 3 ) 试剂 X 为 ___________ 。 ( 4 ) “ 氧化 ” 时加入过量双氧水的目的是将溶液中的 Fe 2+ 氧化为 Fe 3+ ,检验该溶液中 Fe 3+ 的试剂是 ___________ 。 ( 5 ) 在实验室中 “ 灼烧 ” 时用到的含硅酸盐的仪器有 ___________ ( 任填两种 ) ,生成的铁红的用途有 ___________ ( 任填一种 ) 。 ( 6 ) 已知镉铁矿中 CdO 的质量分数为 64% ,整个流程中镉元素的损耗率为 8% ,则 1 t 该镉铁矿可制得 CdSe 的质量为 ___________ kg 。 |
|
| 36. | 详细信息 |
|
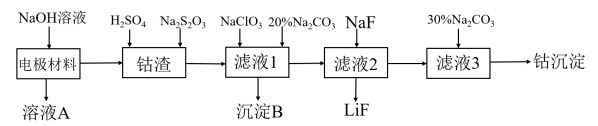
金属是重要但又匮乏的战略资源。从废旧锂电池的电极材料 ( 主要为附在铝箔上的 LiCoO 2 ,还有少量铁的氧化物 ) 中回收钴的一种工艺流程如图: 请回答下列问题 (1) 在焰色反应实验中,观察钾元素的焰色需要用到的玻璃为 _______ 。 (2)“ 溶液 A” 中溶质除 NaOH 外,还有 ______ 。 “ 钴渣 ” 中 LiCoO 2 溶解时的离子方程式为 _______ 。 (3) 在 “ 滤液 1” 中加入 NaClO 3 除了氧化 Fe 2 + 还有 _________ 离子被氧化,在 “ 滤液 1” 中加入 20 ﹪ Na 2 CO 3 溶液,目的是 _________ ;检验 “ 滤液 1” 中 Fe 2+ 是否完全被氧化可用到的试剂为 ________ 。 (4) 如将硫酸改为盐酸浸取 “ 钴渣 ” ,也可得到 Co 2+ 。但工业生产中一般不用盐酸浸取 “ 钴渣 ” ,其原因是 ________ 。 (5)“ 钴沉淀 ” 的化学式可表示为 CoCO 3 ·yCo(OH) 2 。称取 5.17g 该样品置于硬质玻璃管中,在氮气中加热 . 使样品完全分解为 CoO ,生成的气体依次导入足量的浓硫酸和碱石灰中,二者分别增重 0.54g 和 0.88g 。则 “ 钴沉淀 ” 的化学式为 __________ 。 |
|
| 37. | 详细信息 |
|
铜、铬、锰均为过渡元素,其单质及化合物在工业、科技和生产中有着广泛的应用。 ( 1 ) Cu 2 S 可用作制防污涂料、污水处理剂、催化剂等。 ①灼烧 Cu 2 S 时,铜的焰色为 ___________ ( 填序号 ) 。 A. 黄色 B .洋红色 C .紫色 D .绿色 ②用 CuS 、 Cu 2 S 处理酸性废水中的 I.CuS+ II.Cu 2 S+ 当消耗的 CuS 、 Cu 2 S 的物质的量相同时,两者去除 ( 2 ) Cr 2 O 3 可用于冶金,也可用作陶瓷、耐火材料、颜料业原料及有机合成催化剂等。 ① Cr 2 O 3 与 Al 2 O 3 性质类似,具有两性,写出 Cr 2 O 3 与 NaOH 溶液反应的离子方程式: ___________ 。 ②用碳还原重铬酸钾可制备 Cr 2 O 3 ,同时生成一种可燃性有毒气体,当该反应中碳与重铬酸钾的化学计量数比为 2 : 1 时,氧化产物的化学式为 ___________ 。 ( 3 ) 锰酸钾可用作皮革、纤维漂白剂以及杀菌剂、羊毛的媒染剂等。 ①金属锰与熔融碱在氧化剂作用下生成锰酸钾,反应为 2Mn+4KOH( 熔融 )+3O 2 =2K 2 MnO 4 +2H 2 O ,若生成 98.5 g K 2 MnO 4 ,则消耗标准状况下 O 2 的体积为 ___________ 。 ②在 KOH 溶液的环境中高锰酸钾溶液与亚硫酸钠反应可以制得锰酸钾,写出该反应的离子方程式 ___________ 。 |
|
| 38. | 详细信息 |
|
硫及其化合物应用广泛,同时也会对环境造成污染。 ( 1 ) 硫被用来制造黑色火药、火柴等,也是生产橡胶制品的重要原料。有一种硫单质 Sx ,该单质蒸气对氢气的相对密度为 128 ,则 x= ___________ 。 ( 2 ) H 2 S 有剧毒,可用作有机合成还原剂、农药、医药、催化剂的再生等。一种脱硫技术如下:第一步,用 Na 2 CO 3 溶液吸收 H 2 S : H 2 S+Na 2 CO 3 =NaHS+NaHCO 3 ;第二步,用 NaVO 3 溶液与 NaHS 反应生成硫单质,同时还产生 Na 2 V 4 O 9. Na 2 V 4 O 9 中 V 的平均化合价为 ___________ ,第二步反应的离子方程式为 ___________ 。 ( 3 ) SO 2 尾气先用氨水吸收生成 (NH 4 ) 2 SO 3 , 方案 l : 2 方案 2 : ①氨水中存在的分子有 ___________ ( 填化学式 ) 。 ②通过实验可知, ( 4 ) 连二亚硫酸钠 (Na 2 S 2 O 4 ) 适合作木浆造纸的漂白剂。实验室制法:将甲酸和溶于甲醇和水混合溶剂的 NaOH 混合反应后,再通入 SO 2 气体即可制得连二亚硫酸钠,同时生成能使澄清石灰水变浑浊的气体,则该制备反应的化学方程式为 ___________ 。 |
|
| 39. | 详细信息 |
|
磷是重要的元素,能形成多种含氧酸和含氧酸盐。回答下列问题: Ⅰ. 亚磷酸 (H 3 PO 3 ) 是二元酸, H 3 PO 3 溶液存在电离平衡: H 3 PO 3 ( 1 ) 写出亚磷酸钠 (Na 2 HPO 3 ) 中磷的化合价 ___________ 。 ( 2 ) 当亚磷酸与少量 NaOH 溶液反应的离子方程式为 ___________ 。 ( 3 ) 亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式 ___________ 。 Ⅱ. 已知: ①次磷酸 (H 3 PO 2 ) 是一种一元弱酸; ②常温下,电离平衡常数 K a (H 3 PO 2 )=5.9×10 -2 , K a (CH 3 COOH)=1.8×10 -5 ; ( 4 ) 下列说法正确的是 ___________ 。 A . 次磷酸的电离方程式为: H 3 PO 2 ⇌ H + +H 2 PO B . NaH 2 PO 2 属于酸式盐 C . 浓度均为 0.1mol•L -1 的次磷酸 (H 3 PO 2 ) 与盐酸相比前者导电能力强 D . 0.1mol•L -1 NaH 2 PO 2 溶液的 pH 比 0.1mol•L -1 CH 3 COONa 溶液的 pH 小 ( 5 ) 次磷酸钠 NaH 2 PO 2 具有强还原性,是一种很好的化学镀剂。如 NaH 2 PO 2 能将溶液中的 Ni 2+ 还原为 Ni ,用于化学镀镍。酸性条件下镀镍溶液中发生如下反应: ____ ___________Ni 2+ +___________H 2 PO Ⅲ. 磷酸是三元弱酸 (H 3 PO 4 ) ( 6 ) 磷酸钙与焦炭、石英砂混合,在电炉中加热到 1 500 ℃ 生成白磷,反应为: 2Ca 3 (PO 4 ) 2 +6SiO 2 若反应生成 31 g P 4 ,则反应过程中转移的电子数为 ___________ ( 用 N A 表示阿伏加德罗常数的值 ) 。 |
|
| 40. | 详细信息 |
|
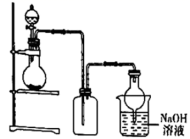
二氯乙酰氯 ( ( 1 ) 仪器 a 的名称是 ___________ ,装置 B 中浓硫酸的作用是 ___________ 。 ( 2 ) 装置 A 采用的加热方式是 ___________ ( 填 “ 酒精灯加热 ” 或 “ 水浴加热 ”) 。 ( 3 ) 装置 C 中发生反应的化学方程式为 ___________ 。 ( 4 ) 试剂 M 是 ___________ ,其作用是 ___________ 。 ( 5 ) 装置 E 是尾气处理装置,还可以用其他方法代替装置 E ,则其他方法有 ______ ( 填一种 ) 。 ( 6 ) 将二氯乙酰氯与氯仿分离的方法名称是 ___________ 。 |
|
| 41. | 详细信息 | |||||||||||||||
|
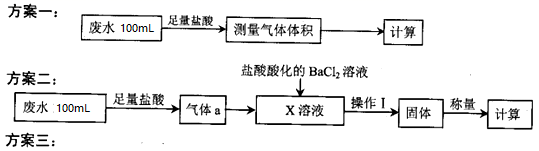
某化工厂排放的工业废水中主要含 Na + 、 HSO 3 ˉ 、 SO 4 2- ,研究小组欲测定其中 HSO 3 ˉ 的浓度,设计如下三个方案。 量取 20.00mL 废水试样,用 0.02moL·L -1 KMnO 4 标准溶液进行滴定。记录数据,计算。 回答下列问题: ( 1 )利用右图所示的装置完成方案一 ①仪器 A 的名称是 ______________ 。 ②读数前,应进行的操作是 ____________________________ 。 ③该方案存在较大的误差,可能的一种原因是 ____________________________ 。 ( 2 ) ①方案二中吸收气体 a 的 “X 溶液 ” 可能是 ______________ ( 填标号 ) 。 a.Na 2 SO 3 溶液 b. 双氧水 c. 硝酸钠溶液 d.H 2 SO 4 酸化的 KMnO 4 溶液 ②若 Ⅹ 为次氯酸钠,写出气体 a 与 X 溶液反应的离子方程式 ______________________ 。 ③该方案中,操作 I 包含的操作名称依次为 ______________ 。 ( 3 ) ①方案三设计的下列滴定方式中,最合理的是 ______________ ( 填标号 ) 。该方案是否需要指示剂 ? ______________ ( 填 “ 是 ” 或 “ 否 ”) ,原因是 __________________________________________ 。 ②滴定记录数据如下表:
计算该废水试样中 HSO 3 ˉ 的浓度为 ______________ mol ·L -l 。 |
||||||||||||||||