2018жұҹиҘҝй«ҳдәҢдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ҹжҙ»дёӯзў°еҲ°зҡ„жҹҗдәӣй—®йўҳпјҢеёёж¶үеҸҠеҲ°еҢ–еӯҰзҹҘиҜҶпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲгҖҖ гҖҖпјү AпјҺе–қиЎҘй“ҒеүӮж—¶пјҢеҠ жңҚз»ҙз”ҹзҙ Cж•ҲжһңжӣҙеҘҪпјҢеҺҹеӣ жҳҜз»ҙз”ҹзҙ Cе…·жңүж°§еҢ–жҖ§ BпјҺеҗ«д№ҷйҶҮгҖҒNaClOгҖҒH2O2зӯүж¶ҲжҜ’ж¶ІеқҮеҸҜд»Ҙе°Ҷз—…жҜ’ж°§еҢ–иҖҢиҫҫеҲ°ж¶ҲжҜ’зӣ®зҡ„ CпјҺиҪ»иҪЁз”өиҪҰеҗҜеҠЁж—¶пјҢз”өиҪҰз”өеҲ·дёҺеҜјзәҝзҡ„жҺҘи§ҰзӮ№дјҡдә§з”ҹй«ҳжё©пјҢзҹіеўЁеҸҜз”ЁдҪңжҺҘи§ҰзӮ№дёҠзҡ„жқҗж–ҷ DпјҺзўій…ёй“қжҳҜдёҖз§Қеә”з”ЁеҫҲе№ҝзҡ„йЈҹе“Ғж·»еҠ еүӮпјҢеҸҜеӨ§йҮҸж·»еҠ еҲ°йҰ’еӨҙгҖҒйқўеҢ…зӯүйЈҹе“Ғдёӯ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
NAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„ж•°еҖјпјҢдёӢеҲ—жңүе…іеҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲгҖҖ гҖҖпјүВ В В В В В В В В В в‘ 1molиӢҜдёӯеҗ«жңүзҡ„зўізўіеҸҢй”®ж•°дёә3NAВ В В В В В В В в‘Ў6.2gж°§еҢ–й’ е’Ң7.8gиҝҮж°§еҢ–й’ зҡ„ж··еҗҲзү©дёӯеҗ«жңүзҡ„зҰ»еӯҗжҖ»ж•°дёә0.6NAВ В В В В В В В В в‘ў3.4gNH3дёӯеҗ«Nп№ЈHй”®ж•°зӣ®дёә0.2NAВ В В В В В В В в‘Јеёёжё©дёӢ1L 0.5mol/L NH4Clжә¶ж¶ІдёҺ2L 0.25mol/L NH4Clжә¶ж¶ІжүҖеҗ«NH4+зҡ„ж•°зӣ®зӣёеҗҢ в‘Өеёёжё©дёӢ4.6gNO2е’ҢN2O4ж··еҗҲж°”дҪ“дёӯжүҖеҗ«еҺҹеӯҗжҖ»ж•°дёә0.3NA в‘ҘзӯүдҪ“з§ҜгҖҒжө“еәҰеқҮдёә1mol/Lзҡ„зЈ·й…ёе’Ңзӣҗй…ёпјҢз”өзҰ»еҮәзҡ„ж°ўзҰ»еӯҗж•°д№ӢжҜ”дёә3пјҡ1В В В В В В В В В В в‘Ұ1molй“ҒзІүеңЁ1molж°Ҝж°”дёӯе……еҲҶзҮғзғ§пјҢеӨұеҺ»зҡ„з”өеӯҗж•°дёә3NA         ⑧й«ҳжё©дёӢпјҢ16.8g FeдёҺи¶ійҮҸж°ҙи’ёж°”е®Ңе…ЁеҸҚеә”еӨұеҺ»0.8NAдёӘз”өеӯҗпјҺВ В В В В В В AпјҺ в‘ в‘Јв‘Өв‘ҰВ В В BпјҺв‘Ўв‘Ө⑧        CпјҺв‘Ўв‘Јв‘Өв‘Ұ⑧      DпјҺв‘Өв‘Ҙв‘Ұ⑧
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜпјҲгҖҖ гҖҖпјү AпјҺеңЁеҠ зғӯжҗ…жӢҢжқЎд»¶дёӢеҠ е…ҘMgOпјҢеҸҜйҷӨеҺ»MgCl2жә¶ж¶Ідёӯзҡ„Fe3+ BпјҺpH=4.5зҡ„з•ӘиҢ„жұҒдёӯcпјҲH+пјүжҳҜpH=6.5зҡ„зүӣеҘ¶дёӯcпјҲH+пјүзҡ„100еҖҚ CпјҺеёёжё©дёӢпјҢCH3COONaе’ҢCH3COOHзҡ„ж··еҗҲжә¶ж¶ІдёӯпјҲpH=7пјүпјҡ cпјҲNa+пјү=cпјҲCH3COOп№Јпјү=cпјҲCH3COOHпјүпјһcпјҲH+пјү=cпјҲOHп№Јпјү DпјҺеңЁй…ёзўұдёӯе’Ңж»ҙе®ҡе®һйӘҢиЈ…ж¶Іж—¶пјҢеҮ№ж¶Ійқўзҡ„жңҖдҪҺзӮ№еңЁе№іи§Ҷж—¶еҝ…йЎ»еңЁвҖң0вҖқеҲ»еәҰ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іеҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) В В В AпјҺHпјӢ(aq)пјӢOHпјҚ(aq)===H2O(l)гҖҖО”HпјқпјҚa kJВ· molпјҚ1пјҢж•…1 mol NaOHеӣәдҪ“дёҺи¶ійҮҸзҡ„зЁҖзӣҗй…ё еҸҚеә”пјҢж”ҫеҮәзғӯйҮҸдёәa kJ BпјҺеёёжё©дёӢпјҢе°Ҷ10 mL pHпјқaзҡ„зӣҗй…ёдёҺ100 mL pHпјқbзҡ„Ba(OH)2жә¶ж¶Іж··еҗҲеҗҺжҒ°еҘҪдёӯе’ҢпјҢ еҲҷaпјӢbпјқ13 CпјҺй•Җй”Ңй’ўз®Ўз ҙжҚҹеҗҺпјҢиҙҹжһҒеҸҚеә”ејҸдёәFeпјҚ2eпјҚ===Fe2пјӢ DпјҺжҠҠзўій…ёж°ўй’ жә¶ж¶Іи’ёе№ІзҒјзғ§пјҢжңҖеҗҺеҫ—еҲ°зҡ„еӣәдҪ“дә§зү©жҳҜзўій…ёж°ўй’
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…із”өи§ЈиҙЁжә¶ж¶Ізҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺеҗ‘0.1 molВ·LпјҚ1 CH3COOHжә¶ж¶ІдёӯеҠ е…Ҙе°‘йҮҸж°ҙпјҢжә¶ж¶Ідёӯ BпјҺе°ҶCH3COONaжә¶ж¶Ід»Һ20 в„ғеҚҮжё©иҮі30 в„ғпјҢжә¶ж¶Ідёӯ CпјҺеңЁpH=8зҡ„NaBжә¶ж¶ІдёӯпјҡcпјҲNa+пјүп№ЈcпјҲBп№Јпјү=9.9Г—10п№Ј8mol DпјҺеҗ‘AgClгҖҒAgBrзҡ„йҘұе’Ңжә¶ж¶ІдёӯеҠ е…Ҙе°‘йҮҸAgNO3пјҢжә¶ж¶Ідёӯ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©дёӢпјҢеҗ‘жҹҗжә¶ж¶ІдёӯеҠ ж°ҙзЁҖйҮҠж—¶пјҢc(OHпјҚ)/c(HпјӢ)зҡ„еҖјжҳҺжҳҫеўһеӨ§пјҢеңЁиҜҘжә¶ж¶ІдёӯиғҪеӨ§йҮҸе…ұеӯҳзҡ„зҰ»еӯҗз»„жҳҜпјҲгҖҖ гҖҖпјү в‘ Al3пјӢгҖҒNaпјӢгҖҒNO в‘ўBa2пјӢгҖҒIпјҚгҖҒNO AпјҺв‘ в‘ЎВ В В В В В В В BпјҺв‘ в‘ўВ В В В В В В В В В CпјҺв‘Ўв‘ЈВ В В В В В В В В В DпјҺв‘Ўв‘ў
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ | ||||||||
|
е·ІзҹҘеёёжё©дёӢжө“еәҰдёә0.lmol/Lзҡ„дёӢеҲ—жә¶ж¶Ізҡ„pHеҰӮдёӢиЎЁпјҢдёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲгҖҖ гҖҖпјү
AпјҺеңЁзӣёеҗҢжё©еәҰдёӢпјҢеҗҢжө“еәҰзҡ„дёүз§Қй…ёжә¶ж¶Ізҡ„еҜјз”өиғҪеҠӣйЎәеәҸпјҡ H2CO3<HClO<HF BпјҺеҗ‘йҘұе’Ңж°Ҝж°ҙдёӯеҠ е…ҘйҖӮйҮҸNa2CO3еӣәдҪ“еҸҜдҪҝжә¶ж¶ІHClOжө“еәҰеҮҸе°Ҹ CпјҺиӢҘе°ҶCO2йҖҡе…Ҙ0.lmol/LNa2CO3жә¶ж¶ІдёӯиҮіжә¶ж¶ІдёӯжҖ§пјҢеҲҷжә¶ж¶Ідёӯ2c(CO32-)+c(HCO3-)=0.1 mol/L DпјҺеҗ‘дёҠиҝ°NaClOжә¶ж¶ІдёӯйҖҡHFж°”дҪ“иҮіжҒ°еҘҪе®Ңе…ЁеҸҚеә”ж—¶пјҡc(Na+)>c(F-)>(H+)>c(HClO)>c(OH-)
|
|||||||||
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
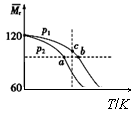
е·ІзҹҘ(CH3COOH)2(g) AпјҺиҜҘеҸҚеә”зҡ„О”H<0 BпјҺж°”дҪ“зҡ„еҺӢејәпјҡp(a)<p(b)пјқp(c) CпјҺе№іиЎЎеёёж•°пјҡK(a)пјқK(b)<K(c) DпјҺжөӢе®ҡд№ҷй…ёзҡ„зӣёеҜ№еҲҶеӯҗиҙЁйҮҸиҰҒеңЁй«ҳеҺӢгҖҒдҪҺжё©жқЎд»¶дёӢ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
дёәе®һзҺ°дёӢеҲ—е®һйӘҢзӣ®зҡ„пјҢдёӢиЎЁжҸҗдҫӣзҡ„дё»иҰҒд»ӘеҷЁе’ҢжүҖз”ЁиҜ•еүӮеҗҲзҗҶзҡ„жҳҜпјҲгҖҖ гҖҖпјү
|
|||||||||||||||||||||
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
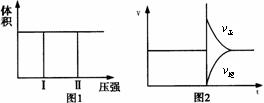
2XпјҲgпјү+YпјҲgпјү 2molXе’Ң1 molYе……е…ҘиҜҘе®№еҷЁдёӯпјҢеҸҚеә”еңЁжҹҗжё©еәҰдёӢ иҫҫеҲ°е№іиЎЎж—¶пјҢZзҡ„зү©иҙЁзҡ„йҮҸдёәp molгҖӮдёӢеҲ—иҜҙжі•дёӯ жӯЈзЎ®зҡ„жҳҜпјҲгҖҖ гҖҖпјү AпјҺиӢҘжҠҠ2molXе’Ң1 molYе……е…ҘиҜҘе®№еҷЁж—¶пјҢеӨ„дәҺ зҠ¶жҖҒв… пјҢиҫҫеҲ°е№іиЎЎж—¶еӨ„дәҺзҠ¶жҖҒв…ЎпјҲеҰӮеӣҫ1жүҖзӨәпјүпјҢеҲҷиҜҘеҸҚеә”зҡ„жӯЈеҸҚеә”жҳҜеҗёзғӯеҸҚеә” BпјҺиӢҘз»ҙжҢҒиҜҘйўҳжқЎд»¶дёҚеҸҳпјҢд»…д»Һз”ҹжҲҗзү©ејҖе§Ӣй…ҚжҜ”пјҢиҰҒжұӮиҫҫеҲ°е№іиЎЎж—¶пјҢZзҡ„зү©иҙЁзҡ„йҮҸд»Қ дёә p mol,еҲҷWзҡ„иө·е§Ӣзү©иҙЁзҡ„йҮҸnпјҲWпјүеә”ж»Ўи¶ізҡ„жқЎд»¶жҳҜnпјҲWпјү>(1-0.5p) mol CпјҺеҸҚеә”иҫҫеҲ°е№іиЎЎеҗҺпјҢеҶҚе°Ҷ2molXе’Ң1 molYе……е…ҘиҜҘе®№еҷЁдёӯпјҢеҲҷеҸҚеә”йҖҹзҺҮVдёҺж—¶й—ҙ tе…ізі»еӣҫеҰӮеӣҫ2жүҖзӨә DпјҺиӢҘйҷҚдҪҺеҺҹе№іиЎЎдҪ“зі»жё©еәҰпјҢеҪ“еҶҚж¬ЎиҫҫеҲ°е№іиЎЎеҗҺпјҢжөӢеҫ—дёӨж¬Ўе№іиЎЎжқЎд»¶дёӢж··еҗҲж°”дҪ“зҡ„ еҜҶеәҰжңӘеҸ‘з”ҹж”№еҸҳ
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
жә¶ж¶ІpHе’Ңжё©еәҰйҡҸеҠ е…Ҙж°Ёж°ҙдҪ“з§ҜеҸҳеҢ–жӣІзәҝеҰӮеӣҫжүҖзӨәпјҢжңүе…і иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲгҖҖ гҖҖпјү AпјҺaзӮ№Kw=1.0Г—10п№Ј14 mol 2 BпјҺж°ҙзҡ„з”өзҰ»зЁӢеәҰпјҡbпјһcпјһaпјһdВ В В В В В В В CпјҺbзӮ№пјҡcпјҲNH4+пјүпјһcпјҲClп№ЈпјүпјһcпјҲH+пјүпјһcпјҲOHп№Јпјү DпјҺ25в„ғ ж—¶NH3В·H2Oзҡ„з”өзҰ»еёёж•°дёә
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲгҖҖ гҖҖпјү AпјҺйҘұе’ҢзҹізҒ°ж°ҙдёӯеҠ е…ҘдёҖе®ҡйҮҸз”ҹзҹізҒ°пјҢжә¶ж¶Іжё©еәҰжҳҺжҳҫеҚҮй«ҳпјҢpHеўһеӨ§ BпјҺAgClжӮ¬жөҠж¶ІдёӯеӯҳеңЁе№іиЎЎпјҡAgCl(s) е№іиЎЎеҗ‘е·Ұ移еҠЁпјҢжә¶ж¶ІдёӯзҰ»еӯҗзҡ„жҖ»жө“еәҰеҮҸе°Ҹ CпјҺAgClжӮ¬жөҠж¶ІдёӯеҠ е…ҘKIжә¶ж¶ІпјҢзҷҪиүІжІүж·ҖеҸҳжҲҗй»„иүІпјҢиҜҒжҳҺжӯӨжқЎд»¶дёӢKsp(AgCl)>Ksp(AgI) DпјҺзЎ¬ж°ҙдёӯеҗ«жңүиҫғеӨҡзҡ„Ca2пјӢгҖҒMg2пјӢгҖҒHCO
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
иӢҜз”Ій…ёй’ (NaA)еҸҜз”ЁдҪңйҘ®ж–ҷзҡ„йҳІи…җеүӮгҖӮз ”з©¶иЎЁжҳҺиӢҜз”Ій…ё(HA)зҡ„жҠ‘иҸҢиғҪеҠӣжҳҫи‘—й«ҳдәҺAпјҚгҖӮе·ІзҹҘ25 в„ғж—¶пјҢHAзҡ„Kaпјқ6.25Г—10пјҚ5пјҢH2CO3зҡ„Ka1пјқ4.17Г—10пјҚ7пјҢKa2пјқ4.90Г—10пјҚ11гҖӮеңЁз”ҹдә§зўій…ёйҘ®ж–ҷзҡ„иҝҮзЁӢдёӯпјҢйҷӨдәҶж·»еҠ NaAеӨ–пјҢиҝҳйңҖеҠ еҺӢе……е…ҘCO2ж°”дҪ“гҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(жё©еәҰдёә25 в„ғпјҢдёҚиҖғиҷ‘йҘ®ж–ҷдёӯе…¶д»–жҲҗеҲҶ) пјҲгҖҖ гҖҖпјү AпјҺй•ҝжңҹйҘ®з”Ёзўій…ёйҘ®ж–ҷжңүеҲ©дәҺзүҷйҪҝеҒҘеә· BпјҺзӣёжҜ”дәҺжңӘе……CO2зҡ„йҘ®ж–ҷпјҢзўій…ёйҘ®ж–ҷзҡ„жҠ‘иҸҢиғҪеҠӣиҫғдҪҺ CпјҺжҸҗй«ҳCO2е……ж°”еҺӢеҠӣпјҢйҘ®ж–ҷдёӯc(AпјҚ)дёҚеҸҳ DпјҺзўій…ёйҘ®ж–ҷдёӯеҗ„з§ҚзІ’еӯҗзҡ„жө“еәҰе…ізі»дёәc(HпјӢ)пјқc(HCO
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ | |||
|
й“…гҖҒдәҢж°§еҢ–й“…гҖҒж°ҹзЎјй…ё(HBF4)з”өжұ жҳҜдёҖз§ҚдҪҺжё©жҖ§иғҪдјҳиүҜзҡ„з”өжұ пјҢеёёз”ЁдәҺеҶӣдәӢе’ҢеӣҪйҳІе·ҘдёҡпјҢе…¶жҖ»еҸҚеә”ж–№зЁӢејҸдёәPbпјӢPbO2пјӢ4HBF4 AпјҺж”ҫз”өж—¶пјҢжә¶ж¶Ідёӯзҡ„BF BпјҺж”ҫз”өж—¶пјҢиҪ¬з§»1 molз”өеӯҗж—¶жӯЈжһҒеҮҸе°‘зҡ„иҙЁйҮҸдёә119.5 g CпјҺе……з”өж—¶пјҢйҳіжһҒйҷ„иҝ‘жә¶ж¶Ізҡ„й…ёжҖ§еҮҸејұ DпјҺе……з”өж—¶пјҢйҳҙжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёәPb2пјӢпјӢ2eпјҚ===Pb
|
||||
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁжҹҗжё©еәҰдёӢпјҢе°Ҷ2molAе’Ң3molBе……е…ҘдёҖеҜҶй—ӯе®№еҷЁдёӯпјҢеҸ‘з”ҹеҸҚеә”пјҡaA(g)+B(g) AпјҺ60%В В В В В В В В В В В В BпјҺ40%В В В В В В В В В В В В CпјҺ50%В В В В В В В В В В В В DпјҺж— жі•зЎ®е®ҡ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
В пјҲ1пјүзЎ…е’Ңж°ҜдёӨе…ғзҙ зҡ„еҚ•иҙЁеҸҚеә”з”ҹжҲҗ1 mol Siзҡ„жңҖй«ҳд»·еҢ–еҗҲзү©пјҢжҒўеӨҚиҮіе®Өжё©пјҢж”ҫзғӯ687 kJпјҢе·ІзҹҘиҜҘеҢ–еҗҲзү©зҡ„зҶ”гҖҒжІёзӮ№еҲҶеҲ«дёәпјҚ69 в„ғе’Ң58 в„ғпјҢеҶҷеҮәиҜҘеҸҚеә”зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸ__________________________________________гҖӮ пјҲ2пјүжҜ”иҫғдёӢеҲ—жә¶ж¶ІдёӯжҢҮе®ҡеҫ®зІ’жө“еәҰзҡ„еӨ§е°Ҹпјҡ жө“еәҰеқҮдёә0.1 molВ·LпјҚ1зҡ„в‘ H2SгҖҒв‘ЎNaHSгҖҒв‘ўNa2SгҖҒв‘ЈH2Sе’ҢNaHSж··еҗҲж¶ІпјҢжә¶ж¶ІpHд»ҺеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜ_____________гҖӮпјҲеЎ«еәҸеҸ·пјүc(H2S)д»ҺеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜ__________гҖӮпјҲеЎ«еәҸеҸ·пјү пјҲ3пјүе·ІзҹҘKsp[Cu(OH)2] = 1Г—10пјҚ20 гҖӮиҰҒдҪҝ0.2 mol / L зҡ„CuSO4жә¶ж¶ІдёӯCu2+жІүж·Җиҫғдёәе®Ңе…ЁпјҢеҲҷеә”еҗ‘жә¶ж¶ІйҮҢеҠ е…ҘNaOHжә¶ж¶ІпјҢи°ғж•ҙжә¶ж¶Ізҡ„pHиҢғеӣҙдёә_________________гҖӮ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
е®Өжё©дёӢпјҢе·ІзҹҘпјҡ CH3COOHзҡ„з”өзҰ»е№іиЎЎеёёж•°Kaпјқ1.8Г—10пјҚ5пјӣH2SO3зҡ„з”өзҰ»е№іиЎЎеёёж•°Kalпјқ1.0Г—10пјҚ2гҖҒKa2пјқ1.0Г—10пјҚ7пјҢеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүе®Өжё©ж—¶пјҢ0.5 molВ·LпјҚ1зҡ„йҶӢй…ёжә¶ж¶Ідёӯз”ұйҶӢй…ёз”өзҰ»еҮәзҡ„c(HпјӢ)зәҰжҳҜз”ұж°ҙз”өзҰ»еҮәзҡ„c(HпјӢ) зҡ„________еҖҚгҖӮ пјҲ2пјүе®Өжё©ж—¶пјҢNaHSO3зҡ„ж°ҙи§Је№іиЎЎеёёж•°Khпјқ________пјҢNaHSO3жә¶ж¶Ідёӯзҡ„еҗ„зҰ»еӯҗжө“еәҰ з”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёә________________гҖӮиӢҘеҗ‘NaHSO3жә¶ж¶ІдёӯеҠ е…Ҙе°‘йҮҸI2пјҢеҲҷ жә¶ж¶Ідёӯ пјҲ3пјүе®Өжё©ж—¶пјҢ0.1 mol/L Na2SO3жә¶ж¶Ізҡ„pHпјқ________
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
е°ҝзҙ пјҲCO(NH2)2пјүпјҢеҺҹзҗҶеҰӮеӣҫжүҖзӨәгҖӮ (1)з”өжәҗзҡ„жӯЈжһҒдёә________(еЎ«вҖңAвҖқжҲ–вҖңBвҖқ)гҖӮ (2)йҳіжһҒе®ӨдёӯеҸ‘з”ҹзҡ„еҸҚеә”дҫқж¬Ўдёә_________гҖҒ_________гҖӮ (3)з”өи§Јз»“жқҹеҗҺпјҢйҳҙжһҒе®Өжә¶ж¶Ізҡ„pHдёҺз”өи§ЈеүҚзӣёжҜ” е°Ҷ__________пјӣ(еЎ«вҖңеўһеӨ§вҖқгҖҒвҖңеҮҸе°ҸвҖқжҲ–вҖңдёҚеҸҳвҖқ)пјҢ иӢҘдёӨжһҒе…ұ收йӣҶеҲ°ж°”дҪ“8.96 L(ж ҮеҮҶзҠ¶еҶө)пјҢеҲҷйҷӨеҺ»зҡ„ е°ҝзҙ дёә________ g(еҝҪз•Ҙж°”дҪ“зҡ„жә¶и§Ј)гҖӮ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
ж°ўиғҪжҳҜеҸ‘еұ•дёӯзҡ„ж–°иғҪжәҗпјҢе®ғзҡ„еҲ©з”ЁеҢ…жӢ¬ж°ўзҡ„еҲ¶еӨҮгҖҒеӮЁеӯҳе’Ңеә”з”ЁдёүдёӘзҺҜиҠӮгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)дёҺжұҪжІ№зӣёжҜ”пјҢж°ўж°”дҪңдёәзҮғж–ҷжңүи®ёеӨҡдјҳзӮ№пјҢдҪҶжҳҜж°ўж°”зӣҙжҺҘзҮғзғ§зҡ„иғҪйҮҸиҪ¬жҚўзҺҮиҝңдҪҺдәҺзҮғж–ҷз”өжұ пјҢеҶҷеҮәзўұжҖ§ж°ўж°§зҮғж–ҷз”өжұ зҡ„иҙҹжһҒеҸҚеә”ејҸпјҡ________________________________гҖӮ (2)ж°ўж°”еҸҜз”ЁдәҺеҲ¶еӨҮH2O2гҖӮ е·ІзҹҘпјҡH2(g)пјӢA(l)===B(l)гҖҖО”H1 O2(g)пјӢB(l)===A(l)пјӢH2O2(l)гҖҖО”H2 е…¶дёӯAгҖҒBдёәжңүжңәзү©пјҢдёӨеҸҚеә”еқҮдёәиҮӘеҸ‘еҸҚеә”пјҢеҲҷH2(g)пјӢO2(g)===H2O2(l)зҡ„О”H________0(еЎ«вҖң>вҖқвҖң<вҖқжҲ–вҖңпјқвҖқ)гҖӮ (3)еңЁжҒ’жё©жҒ’е®№зҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢжҹҗеӮЁж°ўеҸҚеә”пјҡMHx(s)пјӢyH2(g) aпјҺе®№еҷЁеҶ…ж°”дҪ“еҺӢејәдҝқжҢҒдёҚеҸҳВ В В В В В В bпјҺеҗёж”¶y mol H2еҸӘйңҖ1 mol MHx cпјҺиӢҘйҷҚжё©пјҢиҜҘеҸҚеә”зҡ„е№іиЎЎеёёж•°еўһеӨ§В dпјҺиӢҘеҗ‘е®№еҷЁеҶ…йҖҡе…Ҙе°‘йҮҸж°ўж°”пјҢеҲҷv(ж”ҫж°ў)>v(еҗёж°ў)
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
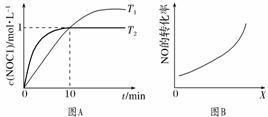
дәҡзЎқй…°ж°Ҝ(NOCl)жҳҜжңүжңәеҗҲжҲҗдёӯзҡ„йҮҚиҰҒиҜ•еүӮпјҢеҸҜз”ұNOе’ҢCl2еҸҚеә”еҫ—еҲ°пјҢеҢ–еӯҰж–№зЁӢејҸдёә2NO(g)пјӢCl2(g) (1)ж°®ж°§еҢ–зү©дёҺжӮ¬жө®еңЁеӨ§ж°”дёӯзҡ„жө·зӣҗзІ’еӯҗзӣёдә’дҪңз”Ёж—¶дјҡз”ҹжҲҗдәҡзЎқй…°ж°ҜпјҢж¶үеҸҠеҰӮдёӢеҸҚеә”пјҡ в‘ 2NO2(g)пјӢNaCl(s) в‘Ў4NO2(g)пјӢ2NaCl(s) в‘ў2NO(g)пјӢCl2(g) и®ҫеҸҚеә”в‘ в‘Ўв‘ўеҜ№еә”зҡ„е№іиЎЎеёёж•°дҫқж¬ЎдёәK1гҖҒK2гҖҒK3пјҢеҲҷK1гҖҒK2гҖҒK3д№Ӣй—ҙзҡ„е…ізі»дёә____________гҖӮ (2)300 в„ғж—¶пјҢ2NOCl(g) жӯЈеҸҚеә”йҖҹзҺҮзҡ„иЎЁиҫҫејҸдёәvжӯЈпјқkВ·cn(NOCl)(kдёәйҖҹзҺҮеёёж•°пјҢеҸӘдёҺжё©еәҰжңүе…і)пјҢжөӢеҫ—йҖҹзҺҮдёҺжө“еәҰзҡ„е…ізі»еҰӮиЎЁжүҖзӨәпјҡ
nпјқ________пјҢkпјқ________гҖӮ
1 mol Cl2(g)пјҢеңЁдёҚеҗҢжё©еәҰдёӢжөӢеҫ—c(NOCl) дёҺж—¶й—ҙtзҡ„е…ізі»еҰӮеӣҫAжүҖзӨәпјҡ еҸҚеә”ејҖе§ӢеҲ°10 minж—¶NOзҡ„е№іеқҮеҸҚеә” йҖҹзҺҮv(Cl2)пјқ________ molВ·LпјҚ1В·minпјҚ1гҖӮ (4)еңЁеҜҶй—ӯе®№еҷЁдёӯе……е…ҘNO(g)е’ҢCl2(g)пјҢж”№еҸҳеӨ–з•Ң жқЎд»¶[жё©еәҰгҖҒеҺӢејәгҖҒ Xд»ЈиЎЁ________гҖӮ
|
|||||||||||||
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
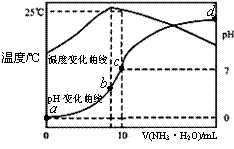
иҒ”ж°Ё(еҸҲз§°иӮјпјҢN2H4пјҢж— иүІж¶ІдҪ“)жҳҜдёҖз§Қеә”з”Ёе№ҝжіӣзҡ„еҢ–е·ҘеҺҹж–ҷпјҢеҸҜз”ЁдҪңзҒ«з®ӯзҮғж–ҷгҖӮ IгҖҒ(1)иҒ”ж°ЁеҲҶеӯҗзҡ„з”өеӯҗејҸдёә______________пјҢ (2)иҒ”ж°ЁдёәдәҢе…ғејұзўұпјҢеңЁж°ҙдёӯзҡ„з”өзҰ»ж–№ејҸдёҺж°ЁзӣёдјјгҖӮиҒ”氨第дёҖжӯҘз”өзҰ»еҸҚеә”зҡ„ж–№зЁӢејҸ _______________гҖӮиҒ”ж°ЁдёҺзӣҗй…ёеҸҚеә”з”ҹжҲҗзҡ„жӯЈзӣҗзҡ„еҢ–еӯҰж–№зЁӢејҸдёә__________________ IIгҖҒжҹҗжҺўз©¶е°Ҹз»„еҲ©з”ЁдёӢеҲ—еҸҚеә”еҲ¶еҸ–ж°ҙеҗҲиӮј(N2H4В·H2O)пјҡ CO(NH2)2пјӢ2NaOHпјӢNaClO===Na2CO3пјӢN2H4В·H2OпјӢNaCl
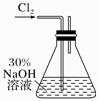
е®һйӘҢдёҖпјҡеҲ¶еӨҮNaClOжә¶ж¶І(е®һйӘҢиЈ…зҪ®еҰӮдёҠеӣҫжүҖзӨә) (1)й…ҚеҲ¶30%NaOHжә¶ж¶Іж—¶пјҢжүҖйңҖзҡ„зҺ»з’ғд»ӘеҷЁйҷӨйҮҸзӯ’еӨ–пјҢиҝҳжңү________(еЎ«ж ҮеҸ·)гҖӮ
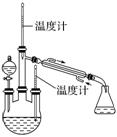
е®һйӘҢдәҢпјҡеҲ¶еҸ–ж°ҙеҗҲиӮј(е®һйӘҢиЈ…зҪ®еҰӮеҸіеӣҫжүҖзӨә)гҖӮ жҺ§еҲ¶еҸҚеә”жё©еәҰпјҢе°ҶеҲҶж¶ІжјҸж–—дёӯжә¶ж¶Ізј“ж…ўж»ҙе…ҘдёүйўҲзғ§з“¶дёӯпјҢе……еҲҶеҸҚеә”гҖӮ еҠ зғӯи’ёйҰҸдёүйўҲзғ§з“¶еҶ…зҡ„жә¶ж¶ІпјҢ收йӣҶ108пҪһ114 в„ғйҰҸеҲҶгҖӮ (е·ІзҹҘпјҡN2H4В·H2OпјӢ2NaClO===N2вҶ‘пјӢ3H2OпјӢ2NaCl) (2)еҲҶж¶ІжјҸж–—дёӯзҡ„жә¶ж¶ІжҳҜ________(еЎ«ж ҮеҸ·)гҖӮ AпјҺCO(NH2)2жә¶ж¶ІВ В В В В BпјҺNaOHе’ҢNaClOж··еҗҲжә¶ж¶І йҖүжӢ©зҡ„зҗҶз”ұжҳҜ__________________________________________________ е®һйӘҢдёүпјҡжөӢе®ҡйҰҸеҲҶдёӯж°ҙеҗҲиӮјзҡ„еҗ«йҮҸгҖӮ з§°еҸ–йҰҸеҲҶ5.000 gпјҢеҠ е…ҘйҖӮйҮҸNaHCO3еӣәдҪ“пјҢеҠ ж°ҙй…ҚжҲҗ250 mLжә¶ж¶ІпјҢ移еҸ–25.00 mLпјҢз”Ё0.100 0 molВ·LпјҚ1зҡ„I2жә¶ж¶Іж»ҙе®ҡгҖӮж»ҙе®ҡиҝҮзЁӢдёӯпјҢжә¶ж¶Ізҡ„pHдҝқжҢҒеңЁ6.5 е·ҰеҸігҖӮ (е·ІзҹҘпјҡN2H4В·H2OпјӢ2I2===N2вҶ‘пјӢ4HIпјӢH2O) (3)ж»ҙе®ҡиҝҮзЁӢдёӯпјҢNaHCO3иғҪжҺ§еҲ¶жә¶ж¶Ізҡ„pHеңЁ6.5е·ҰеҸіпјҢеҺҹеӣ жҳҜ_____________________гҖӮ (4)жң¬е®һйӘҢз”ЁВ В В В В В В В В В В еҒҡжҢҮзӨәеүӮпјҢеҪ“ж»ҙе®ҡиҫҫеҲ°з»ҲзӮ№ж—¶зҡ„зҺ°иұЎдёә_____________________гҖӮ (5)е®һйӘҢжөӢеҫ—ж¶ҲиҖ—I2жә¶ж¶Ізҡ„е№іеқҮеҖјдёә18.00 mLпјҢйҰҸеҲҶдёӯж°ҙеҗҲиӮј(N2H4В·H2O)зҡ„иҙЁйҮҸеҲҶж•° дёә________гҖӮ
|
|
- з”ҳиӮғй«ҳдәҢеҢ–еӯҰжңҲиҖғжөӢйӘҢпјҲ2019е№ҙдёӢеӯҰжңҹпјүиҜ•еҚ·еёҰи§ЈжһҗеҸҠзӯ”жЎҲ
- е№ҝдёңзңҒе®һйӘҢдёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠеӯҰжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰйўҳе…Қиҙ№еңЁзәҝжЈҖжөӢ
- жөҷжұҹй«ҳдёҖеҢ–еӯҰжңҹжң«иҖғиҜ•пјҲ2019е№ҙдёҠеҚҠе№ҙпјүе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- ж№–еҢ—зңҒй„Ӯе·һеёӮйғЁеҲҶй«ҳдёӯиҒ”иҖғеҚҸдҪңдҪ“2020-2021е№ҙй«ҳдёҖдёҠеҚҠе№ҙжңҹдёӯиҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- йҮҚеәҶеёӮ2019е№ҙй«ҳдёүдёӢеҶҢеҢ–еӯҰй«ҳиҖғжЁЎжӢҹе…Қиҙ№иҜ•еҚ·
- дјҡеҒҡе®һйӘҢй«ҳдёүеҢ–еӯҰдёҠеҶҢдё“йўҳз»ғд№ иҜ•еҚ·е®Ңж•ҙзүҲ
- й«ҳдёҖеҢ–еӯҰдёҠеҶҢдё“йўҳз»ғд№ е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- дёүеҸ°дёӯеӯҰе®һйӘҢеӯҰж Ўй«ҳдәҢеҢ–еӯҰдёҠеҶҢејҖеӯҰиҖғиҜ•е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ