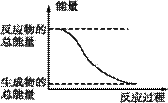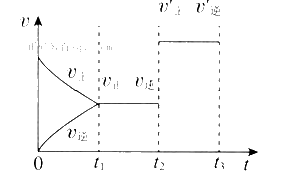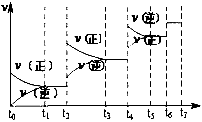2017高一下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
化学与生活、社会、科学、技术、环境等息息相关。下列有关说 A. 12C和14C互为同位素,其中14C可用于文物的年代的鉴定 B.在元素周期表的金属和 C.“青蒿一握,以水二升渍,绞取汁”,药学家屠呦呦对青蒿素的提取属于物理变化 D.煤、石油、天然气属于重要的可再生能源,而氢氧燃料电池则是一种能量转换率较高、符合绿色化学理念的新型动力电源
|
|
| 2. | 详细信息 |
|
1H、2H、3H-、H+ 、H2是( ) A.氢的5种同位素 B.5种氢元素 C. 氢元素的5种不同微粒
|
|
| 3. | 详细信息 |
|
下列叙述正确的是( ) A.同一周期元素的原子,半径越小越容易失去电子 B.元素周期表中的所有元素都是从自然界中发现的,过渡元素都是金属元素 C.非金属元素形成的共价化合物中,原子的最外层都达到了8电子的稳定结构 D.第ⅠA族与第ⅦA族元素间可形成共价化合物或离子化合物
|
|
| 4. | 详细信息 |
|
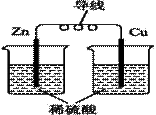
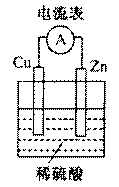
原电池产生电流的本质原因是( ) A.电解质溶液中有电离出的自由移动的离子 B.有导线将两个活泼性不同的电极连接 C.在不同金属的两极间存在电势差 D.在原电池中发生了氧化还原反应
|
|
| 5. | 详细信息 |
|
化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是( )
图Ⅰ 图Ⅱ A.化学反应中能量变化的主要原因是化学键的断裂与生成 B.燃烧反应中,反应物的总能量比生成物的总能量低 C.图Ⅰ所示的装置能将化学能转变为电能 D.图Ⅱ所示的反应为吸热反应
|
|
| 6. | 详细信息 | ||||||||||||
|
已知一定温度下,在2 L的密闭容器中,合成氨反应
以氨气来表示该化学反应的反应速率为( ) A.0.2 mol·L-1·s-1 B.0.4 mol·L-1·s-1 C.0.6 mol·L-1·s-1 D.0.8 mol·L-1·s-1
|
|||||||||||||
| 7. | 详细信息 |
|
下列说法正确的是( ) A.增大反应物浓度,可增大单位体积内活化分子百分数,从而使有效碰撞次数增大 B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
|
|
| 8. | 详细信息 | |
|
某同学按如图所示的装置做实验,并把实验情况记录于框内。你认为框内叙述合理的是( )
A.①②③ B.③④⑤ C.③④⑥ D.②③④
|
||
| 9. | 详细信息 |
|
NO和CO都是汽车尾气里的有害物质,它们能缓缓地反应生成N2和CO2,化学方程式为2NO+2CO A.使用正催化剂能加大反应速率 B.改变反应物的压强对反应速率产生影响 C.冬天气温低,反应速率降低,对人体危害更大 D.无论外界条件怎样改变,均对此化学反应的速率无影响
|
|
| 10. | 详细信息 |
|
下列热化学方程式的书写及相关说法正确的是( ) A.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ B.C(s)+ C.2 mol氢气燃烧得水蒸气放热484 kJ,则H2O(g)===H2 ΔH=+242 kJ·mol-1 D.Ba(OH)2(aq)+H2SO4(aq)===BaSO4(s)+2H2O(l) ΔH=-2a kJ·mol-1,则任何强酸和强碱发生中和反应生成1 mol H2O(l)的反应热均为 -a kJ·mol-1
|
|
| 11. | 详细信息 | |||
|
如图所示为元素周期表的一部分,其中X、Y、Z、W为四种短周期元素。Z元素原子核外K层与M层上的电子数相等。下列说法中正确的是( ) A.Y元素的最高价氧化物对应的水化物的化学式为H3YO4 B.Y的最简单气态氢化物的水溶液显弱碱性 C.原子半径由小到大的顺序为X<Z<Y<W D.X、Z两种元素的氧化物中所含化学键的类型相同
|
||||
| 12. | 详细信息 |
|
一定温度和压强下反应N2+3H2 A. N2与H2不再化合,NH3不再分解 B.N2、H2化合成NH3的反应速率等于NH3分解的反应速率 C.H2、NH3的体积分数相等 D.N2、H2、NH3的物质的量浓度相等
|
|
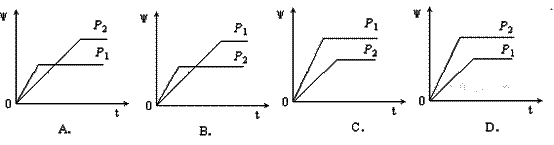
| 13. | 详细信息 |
|
在一定温度不同压强(P1<P2)下,可逆反应2X(g)
|
|
| 14. | 详细信息 |
|
.下列两组热化学方程式中,有关ΔH的比较正确的是( ) ①CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH1 CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH2 ②NaOH(aq)+ NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH4 A.ΔH1>ΔH2;ΔH3<ΔH4. B.ΔH1>ΔH2;ΔH3>ΔH4 C.ΔH1=ΔH2;ΔH3<ΔH4 D.ΔH1<ΔH2;ΔH3<
|
|
| 15. | 详细信息 |
|
在一密闭容器中,反应a A(g) A.平衡向正反应方向移动了 B.物质B的质量分数减小了 C.物质A的转化率减少了 D.a>b
|
|
| 16. | 详细信息 |
|
下图表示一定条件下N2+3H2
A.加压 B.升温 C.加入催化剂 D.增大反应物浓度
|
|
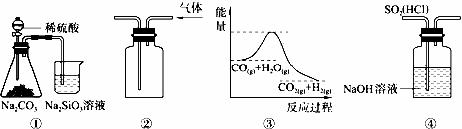
| 17. | 详细信息 |
|
关于下列图示的说法中,正确的是( )
A.图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 B.用图②所示实验装置排空气法收集CO2气体
D.图④装置可以用来除去SO2中的HCl
|
|
| 18. | 详细信息 |
|
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol; CO(g)+ 某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,则原混合气体中的H2和CO的物质的量之比为( ) A.2∶1 B.1∶2 C.1∶1 D.2∶3
|
|
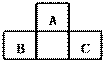
| 19. | 详细信息 |
|
A、B、C均为短周期元素,它们在周期表中的位置如图,已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 分别是( )
C. O、P、Cl D. C、Al、P
|
|
| 20. | 详细信息 | ||||||||||||
|
在2
下列说法正确的是: ( ) A.反应达到平衡时,X的转化率为60% B.反应可表示为X+3Y C.增大压强使平衡向生成Z的方向移动,平衡常数增大 D.改变浓度可以改变此反应的平衡常数
|
|||||||||||||
| 21. | 详细信息 | |||||||||||||||||||||||||||
|
下图是元素周期表的一部分,针对表中的①~⑩中元素, 填写下列空格:
(1)在这10种元素中,非金属性最强的元素是_____ (填“元素符号”);金属性最强的元素是_____(填“元素符号”);化学性质最不活泼的元素是_______ (填“元素符号”);元素②简单离子的结构示意图为___________________。 (2)元素①与②中,原子半径较大的是________(填元素符号)。元素②与⑦的气态氢化物分别为__________和__________ (填化学式),两者的热稳定性大小为:前者_____后者。(填“>”、“<”或“=”)。 (3) 用电子式表示④与⑧形成的化合物的形成过程 。 (4)元素⑤的氧化物与盐酸反应的离子方程式为: _______________________。 (5)元素⑧的单质与元素⑩的氢化物反应的化学方程式为:__________________。
|
||||||||||||||||||||||||||||
| 22. | 详细信息 |
|
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: 3SiO2(s)+6C(s)+2N2(g)⇌Si3N4(s)+6CO(g) (1)该反应的氧化剂是 ,其还原产物是 ; (2)该反应的平衡常数表达式为K= ; (3)若知上述反应为放热反应,则其反应热△H 0(1分)(填“>”、“<”或“=”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18mol•L﹣1•min﹣1,则N2消耗速率为v(N2)= ; (4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中
|
|
| 23. | 详细信息 |
|
I、依据事实,写出下列反应的热化学方程式。 (1)在25 ℃、101 kPa下,1 g甲烷燃烧生成CO2和液态水时放热55.625 kJ。则表示甲烷燃烧热的热化学方程式为___________________ (2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为______________。 (3).在25 ℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(1)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)===CH3COOH(1)的反应热ΔH为 II、锌锰干电池是应用最普遍的电池之一。其基本反应为: X极:Z Y极:2MnO2+2NH (1)X是电池的________(填“正”或“负”,下同)极,Y是电池的________极。 (2)该电池总反应的离子方程式为:_______________________。 (3)若反
|
|
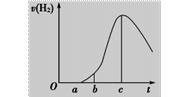
| 24. | 详细信息 |
|
I.把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中, 该铝片与硫酸反应产生氢气的速率与反应时间 的关系可用下图所示的坐标曲线来表示。 请回答下列问题。 (1)曲线由O→a段不产生氢气的原因是____________________。 有关反应的化学方程式为_________________________。 (2)曲线由a→c段,产生氢气的速率增加较快的主要原因是__________________ ____。 (3)曲线由c以后产生氢气的速率逐渐下降的主要原因是_______________________________________。 II.某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可以加快氢气的生成速率。请回答下列问题: (1)上述实验中发生反应的化学方程式有: 、_____________________; (2) 硫酸铜溶液可以加快氢气生成速率的原因:__________________; (3) 实验中现有Na2SO4、MgSO4、 Ag2SO4、 K2SO4四种溶液,可与上述实验中CuSO4溶液起相似作用的是:________;
|
|