2016-2017年高二下学期期中考试化学考卷带参考答案和解析(上海市金山中学)
| 1. | 详细信息 |
|
有关氯化钠叙述错误的是 A. 是强电解质 B. 25 ℃时,溶液的pH=7 C. 电子式为: |
|
| 2. | 详细信息 |
|
一定含有离子的物质是 A. I2 B. 冰醋酸 C. H2O D. KCl |
|
| 3. | 详细信息 |
|
重水 A. 氘原子核外有1个电子 B. 是H的同位素 C. 一个氘原子中含有2个中子 D. D、H、 |
|
| 4. | 详细信息 |
|
Na+的浓度不是1 mol/L的溶液是 A. 0.5mol/L的NaCl B. 0.5 mol/L的Na2SO4 C. 1mol/L的NaOH D. 1 mol/L的NaOH |
|
| 5. | 详细信息 |
|
下列微粒能通过水解产生H+的是 A. CO32- B. HCO3- C. Na+ D. NH4+ |
|
| 6. | 详细信息 |
|
有机物命名正确的是 A. CH2Br-CH2Br二溴乙烷 B. 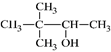 ? 3,3-二甲基-2-丁醇 ? 3,3-二甲基-2-丁醇C. CH3CHOHCH2CH3 丁醛 D. CH3OOCCH3 甲酸乙酯 |
|
| 7. | 详细信息 |
|
影响1 mol气体体积大小的主要因素是 A. 分子大小 B. 分子间平均距离 C. 分子键长 D. 分子质量 |
|
| 8. | 详细信息 |
|
能使溴水褪色的是 A. 乙醇 B. 乙酸 C. 乙烯 D. 乙烷 |
|
| 9. | 详细信息 |
|
将Cl2制成漂粉精的主要目的是 A. 增强漂白和消毒作用 B. 使它转化为较稳定物质,便于保存和运输 C.使它转化为较易溶于水的物质 D. 增加氯的质量分数,有利于漂白、消毒 |
|
| 10. | 详细信息 |
|
下列元素非金属性最强的是 A. N B. Cl C. F D. O |
|
| 11. | 详细信息 |
|
工业上大规模获得乙烯的方法是 A. 石油分馏 B. 从天然气中分离 C. 煤炭干馏 D. 石油裂解 |
|
| 12. | 详细信息 |
|
84消毒液的pH为10.1,最适宜的测定方法是 A. 使用pH试纸 B. 使用红色石蕊试纸 C. 使用数字pH计 D. 以酚酞为指示剂进行酸碱中和滴定 |
|
| 13. | 详细信息 |
|
可以进行烘干操作的仪器是 A. 锥形瓶 B. 量筒 C. 容量瓶 D. 滴定管 |
|
| 14. | 详细信息 |
|
分离FeCl3和AlCl3的混合物可用的试剂是( ) A. 氨水和盐酸 B. 氢氧化钠和二氧化碳 C. 氢氧化钠和盐酸 D. 氨水和二氧化碳 |
|
| 15. | 详细信息 |
|
下列变化过程中放热的是 A. H2O(l)→H2O(g) B. 2HI(g)→H2(g)+I2(g) - 14.9 kJ/mol C. 形成化学键时共放出能量862 kJ的化学反应 D. 能量变化如右图所示的化学反应 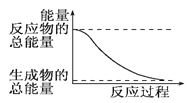 |
|
| 16. | 详细信息 |
|
下列物质制备不合理的是 A. 从海水中提取NaCl B. 从海带中提取碘 C. 电解熔化的氯化铝炼金属铝 D. 电解饱和食盐水制烧碱 |
|
| 17. | 详细信息 |
某有机物结构如下图所示,有关该物质的叙述正确的是 A. 该有机物易溶解于水 B. 一氯代物有5种 C. 1 mol该有机物最多能与4 mol氢气加成 D. 该有机物碱性水解的产物之一是1-丙醇 |
|
| 18. | 详细信息 |
|
关于实验操作叙述正确的是 A. 分液时,下层液体先从分液漏斗下口放出,上层液体后再从上口倒出 B. 实验室制乙烯时,为使受热均匀,应轻轻搅动温度计 C. 配制一定物质量浓度的溶液时,超过刻度线,倒出部分使之恰好达到刻度线即可 D. 酸碱滴定时,眼睛一定要注视滴定管中液面的变化 |
|
| 19. | 详细信息 |
|
在体积可变的密闭容器中,可逆反应 2NO2 A. 混合气体的颜色变浅 B. 逆反应速率减小 C. 混合气体的平均分子量变大 D. NO2的转化率增大 |
|
| 20. | 详细信息 |
|
有Na2S、Na2SO3、Na2SO4三瓶白色固体,标签模糊不清,下列说法不正确的是 A. 可用稀硫酸鉴别 B. 均能溶解于水 C. 每种盐中钠元素与硫元素的质量比都为2:1 D. 若三者组成的固体混合物中硫元素质量分数为32%,则氧元素质量分数为16% |
|
| 21. | 详细信息 |
|
NaCl是基础化工原料,通过电解饱和食盐水可制得NaOH、H2、Cl2。完成下列填空: (1)写出电解饱和食盐水的化学方程式________________________,阳极产物是 __________,检验该产物的一种简便化学方法是__________________________________。 (2)氯原子结构示意图为_______, 氯离子电子式是_______,氯气所含化学键是_________。 (3)氯气经过压缩后变成液氯,属于__________变化(选填“物理”或“化学”)。常用浓氨水来检查输氯管道是否破损,破损处会形成大量白烟NH4Cl和一种无色无味的单质气体,写出化学方程式并标出电子转移的方向和数目:____________________________________________。 (4)Cl与Br属于同主族元素,这两种元素非金属性较强的是______________,请用一个事实说明你的结论:____________________________________________________ 。 |
|
| 22. | 详细信息 | ||||||||
实验室常用氯化铵与氢氧化钙的固体混合物加热制取氨气,下列是实验室提供的有关装置:
|
|||||||||
| 23. | 详细信息 |
| 用100 mL注射器收集50 mL纯净的氨气,然后再抽取10 mL滴有酚酞试液的蒸馏水,并用橡皮塞封闭针头。充分振荡后,注射器内_______(选填“有”或“无”)气体剩余,液体呈______色,用化学方程式解释液体颜色变化的原因_____________________________。 | |
| 24. | 详细信息 |
工业合成氨的简易流程如下图所示: (1)通过循环Ⅰ可利用的气态物质是_______。 a.催化剂 b.只有N2 c.只有H2 d.N2和H2 (2)液氨常用作制冷剂,理由是___________________________________________________。 (3)互为同主族的N、P、As元素可以分别形成NH3 、PH3、AsH3,它们热稳定性的强弱关系为__________,运用相关理论解释结论:_____________________________________。 |
|
| 25. | 详细信息 |
|
容积可变的密闭容器中,反应2SO2(g)十O2(g) (1)工业上该反应是在________(填设备名称)进行的,所用的催化剂是________。 (2)其他条件不变时,降低温度,平衡向正反应方向移动,则正反应为_______(选填“吸热”“放热”)。下图为反应速率(ν)与时间(t)的关系,判断在t1时刻曲线发生变化的原因是__________(选填编号)。  a.增大O2的浓度 b. 扩大容器体积 c. 加入催化剂 d. 升高温度 (3)改变条件后,平衡混合物中SO3的百分含量_______(选填“增大”“减小”“不变”)。 (4)工业上用氨水来吸收SO2尾气,最终形成化肥(NH4)2 SO4,将(NH4)2 SO4固体溶于水,溶液呈_______性,理由是____________________(用离子方程式表示),该溶液体系中存在多种守恒,请任写出其中一种守恒关系(用离子浓度表示) _______________________。 |
|
| 26. | 详细信息 |
煤和石油不仅是重要的矿物能源,更可以通过综合利用得到多种有机化工产品。乙烯是石油化工最重要的基础原料,下图是工业合成物质C的流程: 完成下列填空: (1)写出由乙烯制备聚乙烯塑料的化学方程式:_____________________________________, 反应类型为________________。聚乙烯是________________(选填“纯净物”、“混合物”)。 (2)A与浓硫酸在共热条件下制取乙烯的反应类型是__________________。 (3)B的分子式为C2H4O2,与纯碱反应能生成二氧化碳气体,写出反应A+B→C的化学方程式___________________________________________________________________。 |
|
| 27. | 详细信息 |
煤干馏后可得到焦炭、煤焦油、粗氨水和焦炉气等。焦炭可通过以下途径制取聚氯乙烯等化工产品。 完成下列填空: (1)上述乙炔转化为HC≡C-CH=CH2的反应类型是___________________。 (2)HC≡C-CH=CH2与正四面体烷 (3)若分别完全燃烧等质量的HC≡C-CH=CH2和乙炔,所需氧气的量____________________ (选填“前者多”“后者多”“一样多”)。 |
|
| 28. | 详细信息 |
| 请设计一个实验,证明C2H4O分子中是否含有醛基? | |
最近更新