2018辽宁高二下学期人教版高中化学期中考试
| 1. | 详细信息 |
|
闪烁着银白色光泽的金属钛(22Ti)因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域,号称“崛起的第三金属”。已知钛有48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是 A. 上述钛原子中,中子数不可能为22 B. 钛元素在周期表中处于第四周期 C. 钛的不同同位素在周期表中处于不同的位置 D. 钛元素是d区的过渡元素
|
|
| 2. | 详细信息 |
|
化学与生活密切相关。下列说法正确的是 A.碘是人体必需微量元素,所以要多吃富含碘的食物 B.为使水果尽快成熟,需要用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯 C.液态植物油中有碳碳双键,与氢气加成后可以形成人造脂肪,摄入过多对人体无害 D.加热能杀死流感病毒是因为蛋白质受热变性
|
|
| 3. | 详细信息 |
|
下列各组中的物质均能发生加成反应的是 A.乙烯和乙醇 B.苯和聚乙炔 C.乙酸和溴乙烷 D.丙炔和聚氯乙烯
|
|
| 4. | 详细信息 |
|
下列各组中的反应,属于同一反应类型的是 A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 C.由氯代环己烷消去制环己烯;由丙烯加溴制1,2-二溴丙烷 D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
|
|
| 5. | 详细信息 |
|
下列说法错误的是 A.某些金属在灼烧时会产生特殊的颜色,是由于电子跃迁时能量以光的形式释放出来 B.1-36号元素中,原子最外层有3个未成对电子的元素有3个 C.除ds区外,以最后填入电子的轨道能级符号作为区的名称 D.气态电中性的原子失去1个电子转化为气态正离子所需要的最低能量称为第一电离能
|
|
| 6. | 详细信息 |
|
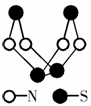
目前科学家们已经合成许多硫-氮化合物,其中一种结构如图所示。关于该物质说法正确的是
C. 该物质分子中所有原子的最外层均达到稳定结构 D.
|
|
| 7. | 详细信息 | ||||||||||||||||||||
|
有四组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如下表所示:
下列各项判断正确的是 A.第四组物质中H2O的沸点最高,是因为H2O分子中化学键键能最强 B.第三组与第四组相比较,化合物的稳定性顺序为:HBr>H2Se C.第三组物质溶于水后,溶液的酸性:HF>HCl>HBr>HI D.第一组物质是分子晶体,一定含有共价键
|
|||||||||||||||||||||
| 8. | 详细信息 |
|
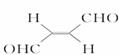
关于化合物 A.分子间可形成氢键 B.分子中既有极性键又有非极性键 C.分子中有7个σ键和1个π键 D.该分子在水中的溶解度小于2丁烯
|
|
| 9. | 详细信息 |
|
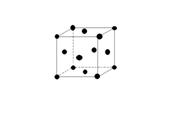
设阿伏加德罗常数的值为NA,下列结论错误的是 A. 完全电解2 mol H2O断裂的σ键键数为4NA B. 标准状况下,11.2 L CO2中含有的π键键数为2NA C. 60 g SiO2晶体中含有的Si—O键键数为4NA D. 128 g金属铜中含有如图所示的晶胞数为0.5NA
|
|
| 10. | 详细信息 |
|
.下列化合物中含有2个手性碳原子的是 A. C.
|
|
| 11. | 详细信息 | |||||||||||||||||||||||||
|
化合物中,稀土元素最常见的化合价是+3 ,但也有少数的稀土元素可以显示+4价,观察下面四种稀土元素的电离能数据,判断最有可能显示+4价的稀土元素是 (几种稀土元素的电离能(单位:KJ/mol))
|
||||||||||||||||||||||||||
| 12. | 详细信息 |
|
下列有关离子晶体的数据大小比较不正确的是 A.熔点:NaF>MgF2>AlF3 B.晶格能:NaF>NaCl>NaBr C.阴离子的配位数:CsCl>NaCl>CaF2 D.硬度:MgO>CaO>BaO
|
|
| 13. | 详细信息 |
|
下列各选项所述的 ①Al原子和N原子的未成对电子数 ②Ag+、Cu2+与NH3形成配合物时的配位数 ③H—F的键能与H—I的键能 ④F元素和O元素的电负性 ⑤N和O元素的第一电离能 A. ①④⑤ B. ②④ C. ②④⑤ D. ③④⑤
|
|
| 14. | 详细信息 |
|
已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列有关C3N4晶体的说法中正确的是 A. C3N4晶体是分子晶体 B. C3N4晶体中C—N键的键长比金刚石中的C—C键的键长短 C. C3N4晶体中C、N原子个数之比为4∶3 D. C3N4晶体中微粒间通过离子键结合
|
|
| 15. | 详细信息 |
|
.下列有关说法不正确的是
A.水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键 B.CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+ C.H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动 D.金属铜中Cu原子堆积模型如图4为最密堆积每个Cu原子的配位数均为12
|
|
| 16. | 详细信息 |
|
下列物质的结构与性质与氢键无关的是 ①乙醚的沸点②冰的密度比液态水小③邻羟基苯甲酸的熔沸点比对羟基苯甲酸的低④水分子在高温下很稳定⑤氢化镁的晶格能高⑥DNA的双螺旋结构⑦尿素的熔沸点比醋酸高 A ④⑥② B ①④⑤ C ②⑤⑥ D ③⑤⑦
|
|
| 17. | 详细信息 | |||||||||||||||
|
下列有关物质性质、结构的表述均正确,且存在因果关系的是
|
||||||||||||||||
| 18. | 详细信息 |
|
.下列说法错误的是 A.在NH B. C.C D.已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形 成的π键数目为3NA
|
|
| 19. | 详细信息 |
|
通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是
B.在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为
D.NBr3比NCl3易挥发
|
|
| 20. | 详细信息 | ||||
|
以下说法不正确的是
|
|||||
| 21. | 详细信息 |
|
(1)基态Ga元素中能量最高的能层符号 有 种不同能量的电子,Ga元素与同周期相邻元素Zn、Ge相比,第一电离能从大到小的顺序 ,(用元素符号表示)金属Zn晶体采用六方最密堆积,其密置层堆积方式为 (ABABAB或ABCABC)区分晶体和非晶体最可靠的科学方法是 (2) 磷有三种含氧酸 H3PO2 、 H3PO3 、 H3PO (3)金属铜投入氨水或过氧化氢溶液中均无明显现象,但投入氨水和过氧化氢的混合溶液中,则铜片溶解,溶液呈深蓝色,①写出该反应的离子反应方程式 ,②已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是
|
|
| 22. | 详细信息 |
|
.青蒿素是从黄花蒿中提取的一种无色针状晶体,双氢青蒿素是青蒿素的重要衍生物,抗疟疾疗效优于青蒿素,请回答下列问题:
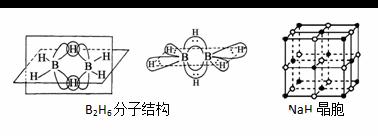
(1)组成青蒿素的三种元素电负性由大到小排序是__________,画出基态O原子的价电子排布图__________。 (2)一个青蒿素分子中含有_______个手性碳原子。 (3)双氢青蒿素的合成一般是用硼氢化钠(NaBH4)还原青蒿素.硼氢化物的合成方法有: 2LiH+B2H6=2LiBH4; 4NaH+BF3═NaBH4+3NaF ①写出BH4﹣的等电子体_________(分子、离子各写一种); ②B2H6分子结构如图,2个B原子和一个H原子共用2个电子形成3中心二电子键,中间的2个氢原子被称为“桥氢原子”,它们连接了2个B原子.则B2H6分子中有______种共价键 ③NaBH4的阴离子中一个B原子能形成4个共价键,而冰晶石(Na3AlF6)的阴离子中一个Al原子可以形成6个共价键,原因是______________; ④NaH的晶胞如图,则NaH晶体中阳离子的配位数是_________;设晶胞中阴、阳离子为刚性球体且恰好相切,求阴、阳离子的半径比
|
|
| 23. | 详细信息 |
|
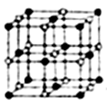
(3)Co的一种氧化物的晶胞如图所示,在该晶体中与一个钴原子等距离且次近的氧原子有______个;已知在该钴的氧化物晶体中钴原子的半径为apm,氧原子的半径为bpm,它们在晶体中是紧密接触的,则在该钴的氧化 (4)筑波材料科学国家实验室 一个科研小组发现了在5K 下呈现超导性的晶体,该晶体具有CoO2的层状结
|
|
| 24. | 详细信息 |
|
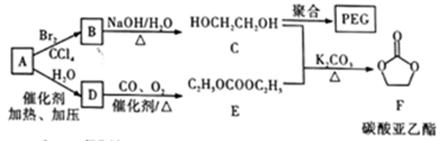
聚乙二醇(PEG) 是一种用途广泛的聚合物,1,2-乙二醇碳酸酯(又称为碳酸亚乙酯) 是一种医药中间体。某小组以烃A 为原料合成PEG和碳酸亚乙酯的路线设计如下: 已知: 2C2H5OH+CO+1/2O2 回答下列问题: (1)A→B的反应类型为__________;(2)B→C的化学方程式为______ (3)C在一定条件下发生聚合反应生成PEC,若某种PEG的平均相对分子质量为2000, 则其平均聚合度为____________________。 (4)E的同分异构体中,含有—OCOO—基团的共有__ _ 种(不包含E和立体异构)。
|
|