2018高三上学期人教版高中化学期中考试
| 1. | 详细信息 |
|
《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。其方法与分离下列物质的实验方法原理上相同的是 A.甲苯和水 B.硝酸钾和氯化钠 C.食盐水和泥沙 D.乙酸乙酯和甘油(丙三醇)
|
|
| 2. | 详细信息 |
|
化学与社会、生活密切相关。下列说法不正确的是 A.Al2O3作耐火材料是因为氧化铝熔点高 B.“血液透析”利用了胶体的性质 C.糖类、油脂、蛋白质均能发生水解 D.家用燃煤中适量的生石灰能有效减少二氧化硫的排放
|
|
| 3. | 详细信息 |
|
在水溶液中能大量共存的一组离子是 A.Al3+、Na+、Cl﹣、SiO32﹣ B.Fe3+、Ba2+、I﹣、NO3﹣ C.NH4+、K+、S2﹣、SO32﹣ D.H+、Ca2+、F﹣、Br﹣
|
|
| 4. | 详细信息 |
|
下列对应化学反应的离子方程式中正确的是 A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO- B.向NaAlO2溶液中通入过量的CO2:AlO2-+4CO2+2H2O=Al3++4HCO3- C.过量的铁和稀硝酸反应:3Fe + 2NO3- + 8H+ = 3Fe2+ + 2NO↑+ 4H2O D.NH4HCO3溶液与足量 NaOH 溶液混合:HCO3-+OH- =CO32-+H2O
|
|
| 5. | 详细信息 |
|
设NA 为阿伏加德罗常数的值,下列叙述正确的是 A.在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA B.标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 Na C.常温下,1.0 LpH = 13的Ba(OH)2溶液中含有的OH—数目为0.1NA D.标准状况下,22.4 L甲醇中含有的C—H的数目为3NA
|
|
| 6. | 详细信息 |
|
下列关于有机化合物的说法正确的是 A.2-甲基丁烷也称异丁烷 B.由乙烯生成乙醇属于加成反应 C.C4H9Cl有3种同分异构体 D.油脂和蛋白质都属于高分子化合物
|
|
| 7. | 详细信息 |
|
下列各组物质相互混合反应后,最终有白色沉淀生成的是 ①金属钠投入FeCl3溶液中; ②过量NaOH溶液和明矾溶液混合; ③少量Ca(OH)2投入过量NaHCO3溶液中; ④向AlCl3溶液中滴入NaHCO3溶液; ⑤向饱和Na2CO3溶液中通入足量CO2 A.①③④⑤ B.只有①④ C.只有②③ D.只有③④⑤
|
|
| 8. | 详细信息 |
|
交通警察执法时常使用的便携式酒精检查仪可能应用了:3CH3CH2OH+2K2Cr2O7(橙色)+8H2SO4=3CH3COOH+2Cr2(SO4)3(蓝绿色)+2K2SO4+11H2O这一反应原理,关于该反应,下列说法正确的是 A.该反应证明了,含最高价元素的化合物,一定具有强氧化性 B.1mol还原剂反应时,转移的电子数为2NA C.H2SO4在反应中表现了氧化性和酸性 D.可以利用该反应原理,将它设计成原电池,通过检测电流强度判断司机是否饮酒
|
|
| 9. | 详细信息 |
|
短周期元素W、X、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是 A.离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) B.Y的最高价氧化物对应水化物的酸性比W的强 C.W的气态氢化物比X的稳定 D.WX2与ZY2中的化学键类型相同
|
|
| 10. | 详细信息 |
|
有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解 质溶液,制造出新型燃料电池,装置如图所示,下列有关
A.通入N2的一极为负极 B.通入H2的电极反应为:H2+2e-=2H+ C.物质A是NH4Cl D.反应过程中左边区域溶液pH逐渐减小
|
|
| 11. | 详细信息 |
|
某溶液除水电离出的OH﹣、H+之外仅含Fe2+、Na+、Al3+、Ba2+、NO3-、SO42-、Cl﹣中的4种,这4种离子的物质的量均为0.1mol.若向该溶液中加入少量稀硫酸,无沉淀生成但有气泡产生.下列说法错误的是 A.该溶液中肯定不含Ba2+ B.若向该溶液中加入过量的稀硫酸,溶液中的阴离子会减少一种 C.若向该溶液中加入足量NaOH溶液,滤出沉淀,洗净灼烧后最多能得8.0g固体 D.该溶液中除H+、0H﹣之外所含离子是Fe2+、Na+、NO3-、SO42-
|
|
| 12. | 详细信息 |
|
下列有关实验操作的叙述,错误的是 A.中和热的测定实验时,眼睛要注视温度计的刻度变化 B.萃取时,将混合物充分振荡后,需静置,待液体分层明显后才能分液 C.中和滴定实验时,为了使滴定终点的现象更加明显,可以滴加较多的指示剂 D.蒸馏时,温度计的读数刚达到某物质的沸点,不能立即收集馏出物
|
|
| 13. | 详细信息 | ||||||||||||||||||||
|
下列根据实验操作和现象所得出的结论正确的是
|
|||||||||||||||||||||
| 14. | 详细信息 |
|
下列除去杂质的方法不正确的是 A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 B.用过量氨水除去Fe3+溶液中的少量Al3+ C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
|
|
| 15. | 详细信息 | |||
|
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是( )
A.反应中转移电子的物质的量是0.21mol B.一定有3. 36L氯气参加反应 C.苛性钾溶液中KOH的质量是16.8g D.ClO
|
||||
| 16. | 详细信息 |
|
下列关于0.10 mol • L-1NaHCO3溶液的说法正确的是 A.溶质的电离方程式为:NaHCO3 =Na+ + H+ +CO32- B.离子浓度关系:c(Na+ ) +c(H+ ) =c(OH- ) + c(HCO3- ) +c(CO32-) C. 25℃时,加水稀释后,n (H+)与n(OH-)的乘积变大 D.温度升高,c(HCO3-)增大
|
|
| 17. | 详细信息 | ||||||||
|
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中。“硫酸法”生产钛的原料是钛铁矿[主要成分是钛酸亚铁(FeTiO3),含有Fe(Ⅲ)等杂质],同时获得副产品甲的工业生产流程如下:
(1)浓硫酸处理钛铁矿时产物之一是TiOSO4,反应中无气体放出,写出该反应的化学方程式 (2)上述生产流程中加入铁屑的目的是 ,可循环利用的物质是 ,检验副产品甲是否变质的实验方法是 (3)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当pH等于 时,Mg(OH)2开始沉淀 ②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该沉淀是 。 (4)中间产品乙是一种氧化物,其经高温与氯气、焦炭反应,除生成TiCl4外,还生成了一种可燃性气体,请写出该反应的化学方程式 。 (5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还原控制的反应条件是 ,反应后的产物需要加入______________溶解后才能达到提纯金属钛的目的。
|
|||||||||
| 18. | 详细信息 |
|
丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈CH3CN等,回答下列问题: (1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下: ①C3H6(g)+NH3(g)+ 3/2O2(g)=C3H3N(g)+3H2O(g) △H=-515kJ/mol ②C3H6(g)+ O2(g)=C3H4O(g)+H2O(g) △H=-353kJ/mol 有利于提高丙烯腈平衡产率的反应条件是 ;提高丙烯腈反应选择性的关键因素是 。 (2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460OC.低于460OC时,丙烯腈的产率 (填“是”或者“不是”)对应温度下的平衡产率,判断理由是 ;高于460OC时,丙烯腈产率降低的可能原因是 (双选,填标号) A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D.反应活化能增大
|
|
| 19. | 详细信息 |
|
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O] 俗称莫尔盐,可溶于水,在100℃~110℃时分解。在定量分析中常用作标定重铬酸钾、高锰酸钾等溶液的标准物质,还用于冶金、电镀等。 Ⅰ.化学课外活动小组研究莫尔盐晶体强热时的分解产物。 (1)甲组同学按照如图所示的装置进行研究,装置C中可观察到的现象是__________,由此可知分解产物中有____________。 (2)乙组同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2。为进行验证,选用甲组实验中的装置A和下图所示的部分装置进行实验。
①乙组同学的实验中,装置依次连接的合理顺序为A、____________。 ②含有SO3的实验现象是______________; Ⅱ.为测硫酸亚铁铵纯度,称取m g莫尔盐样品,配成500ml溶液。甲、乙、丙三位同学设计了如下三个实验方案,请回答: 甲方案:取25.00mL硫酸亚铁铵溶液用0.1000mol·L-1的酸性KMnO4溶液分三次进行滴定。 乙方案:取25.00 mL硫酸亚铁铵溶液进行如下实验。
丙方案:(通过 实验。
(1)甲方案中的离子方程式为___________,若实验操作都正确,但其测定结果总是小于乙方案,可能原因为___________, (2)乙方案中沉淀是否洗涤干净的检验方法是________________。 (3)丙方案中量气管中最佳试剂是______________ a.水 b.饱和NaHCO3溶液 c.CCl4 (4)若测得NH3(已折算为标准状况下)为V L,则硫酸亚铁铵纯度为_____________。 (二)选考题(共13分。请考生从第20、21两道题目中任选一题作答,并用2B铅笔在答题卡上把所选题目的题号涂黑,注意所做题目的题号必须与所涂题目的题号一致,在答题卡上选答区域指定位置答题,如果多做,则按所做的第一题计分。)
|
|
| 20. | 详细信息 |
|
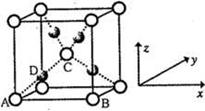
[选修3—物质结构与性质] CuSO4和Cu(NO3)2是自然界中重要的铜盐。请回答下列问题: (1)CuSO4和Cu(NO3)2中阳离子的核外价电子排布式为 ,S、O、N三种元素的第一电离能由大到小的顺序为 。 (2)NO3-的立体构型是 ,与NO3-互为等电子体的一种非极性分子为 (填化学式)。 (3)CuSO4的熔点为560°C,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是 。 (4)往CuSO4溶液中加人过量NaOH能生成配合物[Cu(OH)4]2-。不考虑空间构型, [Cu(OH)4]2-的结构可用示意图表示为(用箭头表示出配位键的位置)_______。 (5)化学实验室常利用新制氢氧化铜检验醛基的存在,乙醛分子中碳原子的杂化方式为 。 (6)利用新制的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如下图所示。
该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(
|
|
| 21. | 详细信息 |
|
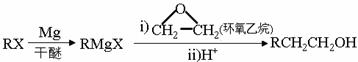
[选修5—有机化学基础] 对氨基苯甲酸酯类是一类局部麻醉药,化合物M是该类药物之一。合成M的一种路线如下:
已知以下信息:①核磁共振氢谱显示B只有一种化学环境的氢,H苯环上有两种化学环境的氢。 ② 回答下列问题: (1)A的结构简式为 ,其化学名称是 。 (2)由E生成F的化学方程式为 。 (3)由G生成H的反应类型为 (4)M的结构简式为 。 (5)D的同分异构体中不能与金属钠反应生成氢气的共有 种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6:1的是 (6)参照上述合成路线,以乙烯和环氧乙烷为原料(无机试剂任选)制备1,6-己二醛,设计合成路线 。
|
|