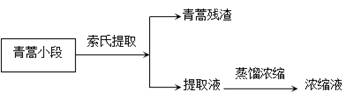
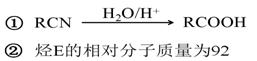2020ж№–еҢ—й«ҳдәҢдёӢеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹдёӯиҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺеҢ»з”Ёй…’зІҫе’Ң84ж¶ҲжҜ’ж¶ІпјҲNaClOжә¶ж¶Іпјүж··еҗҲдҪҝз”ЁиғҪеўһејәе®ғ们зҡ„ж¶ҲжҜ’ж•Ҳжһң BпјҺж°”жә¶иғ¶иў«и®ӨдёәеҸҜд»Ҙдј ж’ӯж–°еҶ з—…жҜ’пјҢе®ғжҳҜж°”дҪ“еҲҶж•ЈиҙЁеҲҶж•ЈеҲ°ж¶ІдҪ“еҲҶж•ЈеүӮдёӯзҡ„дёҖз§Қиғ¶дҪ“ CпјҺвҖңзҶ”е–·еёғвҖқеҸҜз”ЁдәҺеҲ¶дҪңеҸЈзҪ©пјҢз”ҹдә§вҖңзҶ”е–·еёғвҖқзҡ„дё»иҰҒеҺҹж–ҷжҳҜиҒҡдёҷзғҜпјҢе®ғеұһдәҺж··еҗҲзү© DпјҺз–«жғ…жңҹй—ҙеҸҜд»ҘеӨҡеҗғеҜҢеҗ«зәӨз»ҙзҙ зҡ„йЈҹзү©пјҢе®ғ们еңЁдәәдҪ“еҶ…йғҪеҸҜд»ҘйҖҡиҝҮж°ҙи§ЈеҸҚеә”жҸҗдҫӣиғҪйҮҸ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯеҲҶеӯҗй—ҙеӯҳеңЁеӨ§йҮҸж°ўй”®зҡ„жҳҜпјҲВ В пјү AпјҺCH3CH2OHпјҲlпјүВ BпјҺCH3вҖ”OвҖ”CH3пјҲlпјү CпјҺC2H6пјҲgпјү DпјҺNH3пјҲgпјү |
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
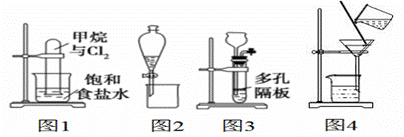
дёӢеҲ—жңүе…іе®һйӘҢеҺҹзҗҶгҖҒиЈ…зҪ®гҖҒж“ҚдҪңжҲ–з»“и®әзҡ„жҸҸиҝ°жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
AпјҺеӣҫ1еҸҚеә”дёҖж®өж—¶й—ҙеҗҺиҜ•з®Ўдёӯж¶ІйқўдјҡдёӢйҷҚ BпјҺеӣҫ2иЈ…зҪ®еҸҜз”ЁдәҺеҲҶзҰ»д№ҷйҶҮе’Ңд№ҷй…ёд№ҷй…Ҝзҡ„ж··еҗҲж¶І CпјҺеӣҫ3иЈ…зҪ®еҸҜз”ЁдәҺе®һйӘҢе®ӨеҲ¶д№ҷзӮ” DпјҺеӣҫ4ж•ҷжқҗйҮҚз»“жҷ¶жі•жҸҗзәҜиӢҜз”Ій…ёзҡ„е®һйӘҢдёӯпјҢдё»иҰҒжӯҘйӘӨдҫқж¬ЎдёәпјҡеҠ зғӯжә¶и§ЈвҶ’и¶ҒзғӯиҝҮж»ӨвҶ’еҶ·еҚҙз»“жҷ¶вҶ’иҝҮж»Ө
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зҰ»еӯҗиғҪеңЁжҢҮе®ҡжә¶ж¶ІдёӯеӨ§йҮҸе…ұеӯҳзҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺйҖҸжҳҺжә¶ж¶ІдёӯпјҡK+гҖҒAl3+гҖҒHCO3-гҖҒSO42- DпјҺc(Fe3+)пјқ1 mol/Lзҡ„жә¶ж¶ІдёӯпјҡNH4+гҖҒK+гҖҒSCN-гҖҒSO42-
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
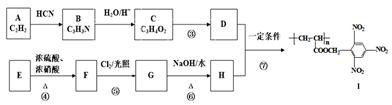
еҢ–еҗҲзү©1пјҢ1вҖ”дәҢзҺҜдёҷеҹәд№ҷзғҜ AпјҺеҲҶеӯҗдёӯжүҖжңүзўіеҺҹеӯҗдёҚеҸҜиғҪе…ұе№ійқўВ В В В В В В В В В В В В В BпјҺиҜҘеҢ–еҗҲзү©еҲҶеӯҗејҸдёәC8H14 CпјҺж ёзЈҒе…ұжҢҜж°ўи°ұжңү3з§Қеі° DпјҺиҜҘеҢ–еҗҲзү©дёҖе®ҡжқЎд»¶дёӢиғҪеҸ‘з”ҹеҸ–д»ЈеҸҚеә”гҖҒеҠ жҲҗеҸҚеә”е’Ңж°§еҢ–еҸҚеә”
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ XгҖҒYгҖҒZгҖҒWзҡ„еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеҠ гҖӮAгҖҒBгҖҒCгҖҒDеқҮжҳҜз”ұиҝҷдәӣе…ғзҙ з»„жҲҗзҡ„дәҢе…ғеҢ–еҗҲзү©пјҢз”ІжҳҜYзҡ„еӣәдҪ“еҚ•иҙЁпјҢеёёжё©дёӢ0.05 mol/Lд№ҷжә¶ж¶Ізҡ„pHдёә1гҖӮAжҳҜж— иүІж°”дҪ“пјҢжҳҜдё»иҰҒзҡ„еӨ§ж°”жұЎжҹ“зү©д№ӢдёҖпјҢдёҠиҝ°зү©иҙЁзҡ„иҪ¬еҢ–е…ізі»еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ(гҖҖгҖҖ)
AпјҺеҺҹеӯҗеҚҠеҫ„пјҡX<Z<W BпјҺDдёӯеӯҳеңЁжһҒжҖ§й”®е’ҢйқһжһҒжҖ§й”® CпјҺжңҖй«ҳд»·еҗ«ж°§й…ёзҡ„й…ёжҖ§пјҡW>Y DпјҺеҢ–еҗҲзү©YZWдёӯй”®и§’дёә120В°
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
й…һиҸҒй’ҙиў«е№ҝжіӣеә”з”ЁдәҺе…үз”өжқҗж–ҷгҖҒе…үеҠЁеҠӣеӯҰе…үж•Ҹжқҗж–ҷзӯүж–№йқўгҖӮй…һиҸҒй’ҙпјҲIIпјүз»“жһ„еҰӮеӣҫжүҖзӨәпјҲCoеқҮеҪўжҲҗеҚ•й”®пјҢйғЁеҲҶеҢ–еӯҰй”®жңӘз”»жҳҺпјүгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ В В пјү
AпјҺй…һиҸҒй’ҙпјҲIIпјүдёӯдёүз§ҚйқһйҮ‘еұһе…ғзҙ зҡ„з”өиҙҹжҖ§еӨ§е°ҸйЎәеәҸдёәNпјһCпјһH
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
е·ҘдёҡдёҠй«ҳзәҜзЎ…еҸҜйҖҡиҝҮдёӢеҲ—еҸҚеә”еҲ¶еҸ–пјҡSiCl4(g)пјӢ2H2(g)
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜВ пјҲ В В пјү В В В AпјҺеҸҚеә”дёӯзҡ„иғҪйҮҸеҸҳеҢ–дёҺзү©иҙЁзҡ„зҠ¶жҖҒж— е…і
|
|||||||||||||
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
ж°ҙз…Өж°”еҸҳжҚўеҸҚеә”жҳҜйҮҚиҰҒзҡ„еҢ–е·ҘиҝҮзЁӢпјҢеҸҚеә”ж–№зЁӢејҸдёәпјҡCOпјҲgпјүпјӢH2OпјҲgпјүпјқCO2пјҲgпјүпјӢH2пјҲgпјүО”HгҖӮжҲ‘еӣҪ科еӯҰ家еңЁиҝҷдёҖеҸҳжҚўдёӯеҲ©з”ЁеҸҢеҠҹиғҪеӮ¬еҢ–еүӮзӘҒз ҙдәҶдҪҺжё©дёӢй«ҳиҪ¬еҢ–зҺҮдёҺй«ҳеҸҚеә”йҖҹзҺҮдёҚиғҪе…јеҫ—зҡ„йҡҫйўҳгҖӮеҸҚеә”еҺҶзЁӢеҰӮеӣҫжүҖзӨәпјҡ
дёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ В В пјү BпјҺж №жҚ®еҺҶзЁӢеӣҫзӨәиҝҮзЁӢв… дёәеҗёзғӯиҝҮзЁӢгҖҒиҝҮзЁӢв…ўдёәж”ҫзғӯиҝҮзЁӢ
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
жҲ‘еӣҪ科еӯҰ家и®ҫи®ЎдәҶдёҖз§ҚеӨӘйҳіиғҪй©ұеҠЁзҡ„H2SеҲҶи§ЈиЈ…зҪ®пјҢе·ҘдҪңеҺҹзҗҶеҰӮдёӢеӣҫжүҖзӨәгҖӮдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲ В В пјү
AпјҺз”ІеҢәеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҡ2Fe3++S2-=2Fe2++SвҶ“ BпјҺзҗҶи®әдёҠжҜҸз”ҹжҲҗ1mol S ж—¶пјҢH+з”ұиҙЁеӯҗдәӨжҚўиҶңеҸідҫ§еҗ‘е·Ұдҫ§з§»еҠЁзҡ„зү©иҙЁзҡ„йҮҸдёә2mol CпјҺдёҷеҢәеҸ‘з”ҹзҡ„з”өжһҒеҸҚеә”дёәпјҡH4[SiW12O40]+2e-+2H+=H6[SiW12O40] DпјҺдёҒеҢәH6[SiW12O40]еңЁеӮ¬еҢ–еүӮиЎЁйқўеҸ‘з”ҹз”өеҢ–еӯҰеҸҚеә”з”ҹжҲҗH4[SiW12O40]е’ҢH2
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
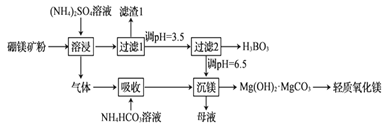
иҪ»иҙЁж°§еҢ–й•Ғе’ҢзЎјй…ё(H3BO3)йғҪжҳҜйҮҚиҰҒзҡ„еҢ–е·ҘеҺҹж–ҷпјҢеҸҜйҮҮз”ЁзЎјй•ҒзҹҝпјҲеҗ«Mg2B2O5В·H2OгҖҒSiO2еҸҠе°‘йҮҸFe2O3гҖҒAl2O3)дёәеҺҹж–ҷз”ҹдә§зЎјй…ёе’ҢиҪ»иҙЁж°§еҢ–й•ҒпјҢе…¶е·ҘиүәжөҒзЁӢеҰӮдёӢпјҡ дёӢеҲ—еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜпјҲВ В В пјү BпјҺиҝӣе…ҘвҖңеҗёж”¶вҖқе·ҘеәҸдёӯзҡ„ж°”дҪ“дёәNH3 CпјҺиӢҘвҖңиҝҮж»Ө2вҖқж—¶и°ғиҠӮжә¶ж¶Ізҡ„зўұжҖ§и¶Ҡејәеҫ—еҲ°зҡ„зЎјй…ёи¶ҠеӨҡ DпјҺвҖңжІүй•ҒвҖқдёӯеҫ—еҲ°зҡ„жҜҚж¶Із»ҸеҠ зғӯеҗҺеҸҜиҝ”еӣһвҖңжә¶жөёвҖқе·ҘеәҸеҫӘзҺҜдҪҝз”Ё
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
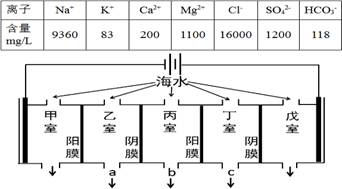
з”өжё—жһҗжі•жҳҜжө·ж°ҙж·ЎеҢ–зҡ„еёёз”Ёж–№жі•пјҢжҹҗең°жө·ж°ҙдёӯдё»иҰҒзҰ»еӯҗзҡ„еҗ«йҮҸеҰӮдёӢиЎЁпјҢзҺ°еҲ©з”ЁвҖңз”өжё—жһҗжі•вҖқиҝӣиЎҢж·ЎеҢ–пјҢжҠҖжңҜеҺҹзҗҶеҰӮеӣҫжүҖзӨәпјҲдёӨз«Ҝдёәжғ°жҖ§з”өжһҒпјҢйҳіиҶңеҸӘе…Ғи®ёйҳізҰ»еӯҗйҖҡиҝҮпјҢйҳҙиҶңеҸӘе…Ғи®ёйҳҙзҰ»еӯҗйҖҡиҝҮпјүгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲВ В пјү
AпјҺж·ЎеҢ–иҝҮзЁӢдёӯжҳ“еңЁз”Іе®ӨеҪўжҲҗж°ҙеһў BпјҺж·ЎеҢ–иҝҮзЁӢдёӯжҲҠе®Өзҡ„з”өжһҒеҸҚеә”ејҸдёәпјҡ2Cl-пјҚ2e-= Cl2вҶ‘ CпјҺж·ЎеҢ–иҝҮзЁӢдёӯд№ҷе®Өе’ҢдёҒе®ӨдёӯйғЁеҲҶзҰ»еӯҗзҡ„жө“еәҰеҮҸе°ҸпјҢж·Ўж°ҙзҡ„еҮәеҸЈдёә aгҖҒc DпјҺеҪ“з”Іе®Ө收йӣҶеҲ°ж ҮеҮҶзҠ¶еҶөдёӢ11.2Lж°”дҪ“ж—¶пјҢйҖҡиҝҮз”Іе®ӨйҳіиҶңзҡ„зҰ»еӯҗзҡ„зү©иҙЁзҡ„йҮҸдёҖе®ҡдёә1mol |
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘиҒ”ж°Ё(N2H4)еңЁж°ҙдёӯзҡ„з”өзҰ»ж–№зЁӢејҸдёәN2H4+H2OвҮҢN2H5++OH-пјҢN2H5++H2OвҮҢN2H62++OH-гҖӮеёёжё©дёӢпјҢе°Ҷзӣҗй…ёйҖҗж»ҙеҠ еҲ°иҒ”ж°Ёзҡ„ж°ҙжә¶ж¶ІдёӯпјҢж··еҗҲжә¶ж¶Ізҡ„pOH [pOHпјқвҖ”lg c(OH-)]йҡҸзҰ»еӯҗжө“еәҰеҸҳеҢ–зҡ„е…ізі»еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜпјҲВ В пјү
AпјҺжӣІзәҝXиЎЁзӨәpOHдёҺ BпјҺеҸҚеә”N2H62++H2OвҮҢN2H5++H3O+зҡ„е№іиЎЎеёёж•°Kпјқ10-15 DпјҺN2H5Clзҡ„ж°ҙжә¶ж¶ІдёӯеӯҳеңЁзӯүејҸпјҡc(N2H62+)+c(H3O+)=c(N2H4)+c(OH-)
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗж— иүІжә¶ж¶ІдёӯеҸҜиғҪеҗ«жңүBa2+гҖҒFe3+гҖҒNa+гҖҒK+гҖҒNH4+гҖҒSO42-гҖҒSO32-гҖҒCl-гҖҒBr-гҖҒCO32-дёӯзҡ„иӢҘе№Із§ҚпјҢзҰ»еӯҗжө“еәҰйғҪдёә0.1mol/LпјҺеҫҖиҜҘжә¶ж¶ІдёӯеҠ е…ҘBaCl2е’ҢиҝҮйҮҸзҡ„зӣҗй…ёпјҢж— зҷҪиүІжІүж·Җз”ҹжҲҗгҖӮеҸҰеҸ–е°‘йҮҸеҺҹжә¶ж¶ІпјҢи®ҫ计并е®ҢжҲҗеҰӮдёӢе®һйӘҢгҖӮдёӢеҲ—еҲӨж–ӯжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү
DпјҺжҳҜеҗҰеҗ«NH4+йңҖеҸҰеҒҡе®һйӘҢеҲӨж–ӯ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘпјҡ2Fe2++Br2=2Fe3++2BrпјҚпјҢ2Fe3++2IпјҚ=2Fe2++I2гҖӮеҗ‘FeI2гҖҒFeBr2зҡ„ж··еҗҲжә¶ж¶ІдёӯйҖҡе…ҘйҖӮйҮҸCl2пјҢжә¶ж¶ІдёӯжҹҗдәӣзҰ»еӯҗзҡ„зү©иҙЁзҡ„йҮҸеҸҳеҢ–еҰӮдёӢеӣҫжүҖзӨәпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү
AпјҺдёүз§ҚзҰ»еӯҗзҡ„иҝҳеҺҹжҖ§ејәејұе…ізі»жҳҜпјҡBrпјҚ>Fe2+>IпјҚ |
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
еӮ¬еҢ–ж°§еҢ–еҸҚеә”пјҡ2SO2пјҲgпјү+ O2пјҲgпјүвҮҢ2SO3пјҲgпјүв–іHпјң0гҖӮеңЁдҪ“з§ҜеҸҜеҸҳзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢз»ҙжҢҒеҺӢејәдёә1.01Г—105 PaпјҢе……е…Ҙ2mol SO2е’ҢдёҖе®ҡйҮҸзҡ„O2пјҢSO2зҡ„е№іиЎЎиҪ¬еҢ–зҺҮОұпјҲSO2пјүйҡҸO2зү©иҙЁзҡ„йҮҸnпјҲO2пјүзҡ„еҸҳеҢ–е…ізі»еҰӮеӣҫ1жүҖзӨәпјҡ
е·ІзҹҘеҸҚеә”aA(g) + bB(g)вҮҢg G(g) + h H(g) зҡ„ж ҮеҮҶе№іиЎЎеёёж•° е…¶дёӯPОё = 1.01Г—105 PaпјҢPGпјҢPHпјҢPAпјҢPBеҲҶеҲ«иЎЁзӨәGпјҢHпјҢAпјҢBзҡ„еҲҶеҺӢпјҢP(еҲҶеҺӢ)=P(жҖ»еҺӢ)Г—зү©иҙЁзҡ„йҮҸеҲҶж•°гҖӮ пјҲ1пјүеңЁз»қзғӯжҒ’е®№зҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢиғҪиЎЁжҳҺеҸҚеә”2SO2пјҲgпјү+ O2пјҲgпјүвҮҢ2SO3пјҲgпјүе·ІиҫҫеҲ°е№іиЎЎзҠ¶жҖҒзҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В пјҲ2пјүеңЁ1000в„ғж—¶йҡҸзқҖO2зү©иҙЁзҡ„йҮҸзҡ„еўһеӨ§пјҢдҪҶSO2е№іиЎЎиҪ¬еҢ–зҺҮеҚҮй«ҳзј“ж…ўпјҢе…¶еҺҹеӣ жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ3пјүжұӮеӣҫ1дёӯaзӮ№зҡ„ж ҮеҮҶе№іиЎЎеёёж•°KОё=В В В В В В В В В В В В В В В В В В В В гҖӮеңЁaзӮ№иҫҫеҲ°е№іиЎЎеҗҺпјҢиӢҘдҝқжҢҒжё©еәҰгҖҒеҺӢејәдёҚеҸҳпјҢеҶҚеҗ‘дҪ“зі»дёӯе……е…ҘSO2(g)пјҢO2(g)пјҢSO3(g)еҗ„0.2molж—¶пјҢжӯӨж—¶П…(жӯЈ)В В В В В В В В В П…(йҖҶ)пјҲеЎ«вҖң<вҖқвҖң>вҖқжҲ–вҖң=вҖқпјүгҖӮ пјҲ4пјүиӢҘеңЁзӣёеҗҢзҡ„жҒ’е®№еҜҶй—ӯе®№еҷЁдёӯе……е…ҘO2е’ҢSO2еҗ„2molпјҢеңЁдёҚеҗҢжё©еәҰдёӢиҫҫеҲ°е№іиЎЎпјҢеҸҚеә”дҪ“зі»жҖ»еҺӢејәйҡҸж—¶й—ҙеҸҳеҢ–еҰӮеӣҫ2жүҖзӨәпјҢеҲҷиҫҫеҲ°е№іиЎЎзҠ¶жҖҒbе’Ңcж—¶пјҢSO3дҪ“з§ҜеҲҶж•°иҫғеӨ§зҡ„жҳҜВ В В В В В В В В В пјҲеЎ«вҖңbвҖқжҲ–вҖңcвҖқпјүпјҢеҺҹеӣ жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
CгҖҒNгҖҒPгҖҒSгҖҒFeгҖҒCuжҳҜдёҺдәәзұ»з”ҹдә§гҖҒз”ҹжҙ»жҒҜжҒҜзӣёе…ізҡ„еҢ–еӯҰе…ғзҙ пјҢеҲ©з”ЁжүҖеӯҰзҹҘиҜҶеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүеҹәжҖҒCuеҺҹеӯҗж ёеӨ–з”өеӯҗжҺ’еёғејҸдёәВ В В В В В В В В В В В пјҢеҲҷй«ҳжё©дёӢзҡ„зЁіе®ҡжҖ§CuOВ В В В В Cu2OпјҲеЎ«вҖңпјһвҖқжҲ–вҖңпјңвҖқпјүпјӣ пјҲ2пјүз»Ҹз ”з©¶Cuзҡ„жҹҗз§ҚеҢ–еҗҲзү©иғҪеӮ¬еҢ–ж°§еҢ–CO(NH2)2пјҢе…¶дёӯCгҖҒNзҡ„жқӮеҢ–ж–№ејҸеҲҶеҲ«дёәВ В В В В В В В В В В пјҢВ В В В В В В В В В В В В пјӣ пјҲ3пјүSiгҖҒPгҖҒSе…ғзҙ зҡ„第дёҖз”өзҰ»иғҪз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜВ В В В В В В В В В В В В В В В пјӣ пјҲ4пјүOF2зҡ„з©әй—ҙжһ„еһӢжҳҜВ В В В В В В В В В В В В В В пјҢеҲҶеӯҗжһҒжҖ§пјҡH2OВ В В В В OF2пјҲеЎ«вҖңпјһвҖқжҲ–вҖңпјңвҖқпјүпјҢзҗҶз”ұжҳҜВ В В В В В В В В В В В В В В В В В В В В пјӣ пјҲ5пјү[Fe(CN)6]3-дёӯй…ҚдҪҚй”®е’ҢПҖй”®зҡ„дёӘж•°д№ӢжҜ”дёәВ В В В В В В В В В В В В В В В В пјӣ пјҲ6пјүйӮ»зҫҹеҹәиӢҜз”ІйҶӣзҡ„жІёзӮ№дҪҺдәҺеҜ№зҫҹеҹәиӢҜз”ІйҶӣзҡ„жІёзӮ№пјҢеҺҹеӣ жҳҜВ В В В В В В В В В В В В В В гҖӮ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ | |||
|
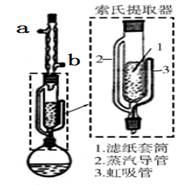
йқ’и’ҝжҢҘеҸ‘жІ№жҳҜйқ’и’ҝзҡ„жҙ»жҖ§жҲҗеҲҶпјҲеҮ д№ҺдёҚжә¶дәҺж°ҙпјҢеҸҜжә¶дәҺд№ҷйҶҡпјҢзҶ”зӮ№156-157в„ғпјҢеҜ№зғӯдёҚзЁіе®ҡпјҢд№ҷйҶҡзҡ„жІёзӮ№34.6в„ғпјүпјҢжңүжҠ—иҸҢгҖҒи§ЈзғӯгҖҒжӯўе’ізӯүдҪңз”ЁгҖӮе®һйӘҢе®Өд»Һйқ’и’ҝдёӯжҸҗеҸ–йқ’и’ҝжҢҘеҸ‘жІ№зҡ„жөҒзЁӢеҰӮдёӢеӣҫжүҖзӨәгҖӮ
В зҙўж°ҸжҸҗеҸ–иЈ…зҪ®еҰӮдёӢеӣҫжүҖзӨәпјҢе®һйӘҢж—¶зғ§з“¶дёӯжә¶еүӮеҸ—зғӯи’ёеҸ‘пјҢи’ёжұҪжІҝи’ёжұҪеҜјз®Ў2дёҠеҚҮиҮізҗғеҪўеҶ·еҮқз®ЎпјҢеҶ·еҮқеҗҺж»ҙе…Ҙж»ӨзәёеҘ—зӯ’1дёӯпјҢдёҺйқ’и’ҝе°Ҹж®өжҺҘи§ҰпјҢиҝӣиЎҢиҗғеҸ–гҖӮиҗғеҸ–ж¶Іж¶ІйқўиҫҫеҲ°иҷ№еҗёз®Ў3йЎ¶з«Ҝж—¶пјҢз»Ҹиҷ№еҗёз®Ў3иҝ”еӣһзғ§з“¶пјҢд»ҺиҖҢе®һзҺ°еҜ№йқ’и’ҝе°Ҹж®өзҡ„иҝһз»ӯиҗғеҸ–гҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
пјҲ1пјүе®һйӘҢж—¶йңҖе°Ҷйқ’и’ҝеүӘжҲҗ1-2cmе°Ҹж®өпјҢж”ҫе…Ҙж»ӨзәёеҘ—зӯ’1дёӯпјҢеүӘжҲҗе°Ҹж®өзҡ„зӣ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В пјҢеңҶеә•зғ§з“¶дёӯеҠ е…Ҙд№ҷйҶҡдёәжә¶еүӮж—¶пјҢеә”дёҚи¶…иҝҮзғ§з“¶е®№з§Ҝзҡ„ В В В В В В В В В гҖӮ пјҲ2пјүзҙўж°ҸжҸҗеҸ–еҷЁдёӯж»ӨзәёеҘ—зӯ’зҡ„й«ҳеәҰпјҲxпјүгҖҒеҘ—з®ЎеҶ…йқ’и’ҝе°Ҹж®өзҡ„й«ҳеәҰпјҲyпјүеҸҠиҷ№еҗёз®Ўзҡ„й«ҳеәҰпјҲzпјүз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜ_______пјҲз”Ёx гҖҒy гҖҒzеӣһзӯ”пјүпјҢдёҺ常规зҡ„иҗғеҸ–зӣёжҜ”пјҢйҮҮз”Ёзҙўж°ҸжҸҗеҸ–еҷЁзҡ„дјҳзӮ№жҳҜВ В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ3пјүжҸҗеҸ–ж—¶зҗғеҪўеҶ·еҮқз®ЎдёӯеҶ·ж°ҙеә”д»Һ________пјҲеЎ«вҖңaвҖқжҲ–вҖңbвҖқпјүз®ЎеҜје…ҘпјҢжҸҗеҸ–ж¶ІйңҖз»ҸВ В В В В В В В пјҲвҖңеёёеҺӢвҖқжҲ–вҖңеҮҸеҺӢвҖқпјүи’ёйҰҸжі•йҷӨеҺ»еӨ§йғЁеҲҶжә¶еүӮпјҢдёӢеҲ—д»ӘеҷЁеңЁиҜҘи’ёйҰҸдёӯйңҖиҰҒз”ЁеҲ°зҡ„жңү______________пјҲеЎ«еӯ—жҜҚж ҮеҸ·пјүгҖӮ AпјҺзӣҙеҪўеҶ·еҮқз®ЎВ В BпјҺзҗғеҪўеҶ·еҮқз®Ў В В CпјҺй”ҘеҪўз“¶В В В DпјҺзғ§жқҜВ В В EпјҺжё©еәҰи®Ў
|
||||
| 19. | иҜҰз»ҶдҝЎжҒҜ | |||
|
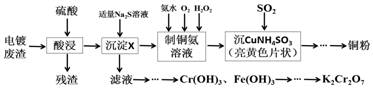
жҹҗеҢ–еӯҰе®һйӘҢе°Ҹз»„д»Ҙз”өй•ҖеәҹжёЈ(Cr2O3гҖҒCuOгҖҒFe2O3еҸҠCaO)дёәеҺҹж–ҷеҲ¶еҸ–й“ңзІүе’ҢK2Cr2O7гҖӮдё»иҰҒжөҒзЁӢеҰӮдёӢпјҡ
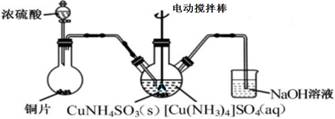
пјҲ1пјүеҠ е…ҘйҖӮйҮҸNa2Sжә¶ж¶ІеҗҺз”ҹжҲҗзҡ„жІүж·ҖXдёәВ В В В В В В В В пјҢиӢҘеҠ е…Ҙзҡ„Na2Sжә¶ж¶ІиҝҮйҮҸпјҢйҷӨз”ҹжҲҗXеӨ–иҝҳдјҡеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ2пјүиҜ·й…Қе№і[Cu(NH3)4]SO4В·H2OеҠ зғӯеҸ‘з”ҹеҲҶи§ЈеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ В В В В В В [Cu(NH3)4]SO4В·H2O пјҲ3пјүвҖңжІү CuNH4 SO3 вҖқж—¶еҸҜз”ЁеҰӮдёӢеӣҫиЈ…зҪ®(еӨ№жҢҒгҖҒеҠ зғӯд»ӘеҷЁз•Ҙ)пјҡ
в‘ вҖңжІү CuNH4SO3 вҖқж—¶пјҢеҸҚеә”жё©еәҰйңҖжҺ§еҲ¶еңЁ 45в„ғпјҢеҗҲйҖӮзҡ„еҠ зғӯж–№ејҸжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘ЎNaOHжә¶ж¶Ізҡ„дҪңз”ЁжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ4пјүжөӢе®ҡдә§е“Ғдёӯ K2Cr2O7еҗ«йҮҸзҡ„ж–№жі•еҰӮдёӢпјҡз§°еҸ–дә§е“ҒиҜ•ж · 2.0 g й…ҚжҲҗ 250 mL жә¶ж¶ІпјҢеҸ–еҮә25.00 mL дәҺй”ҘеҪўз“¶дёӯпјҢеҠ е…Ҙи¶ійҮҸзЁҖзЎ«й…ёй…ёеҢ–еҗҺпјҢеҶҚеҠ е…ҘеҮ ж»ҙжҢҮзӨәеүӮпјҢз”Ё 0.1000 mol/L зЎ«й…ёдәҡй“Ғй“ө(NH4)2 Fe(SO4 )2ж ҮеҮҶж¶ІиҝӣиЎҢж»ҙе®ҡпјҢйҮҚеӨҚиҝӣиЎҢдёүж¬Ўе®һйӘҢгҖӮ(е·ІзҹҘCr2O в‘ иӢҘдёүж¬Ўе®һйӘҢж¶ҲиҖ—(NH4 )2 Fe(SO4)2 ж ҮеҮҶж¶Ізҡ„е№іеқҮдҪ“з§Ҝдёә20.00 mLпјҢеҲҷжүҖеҫ—дә§е“ҒK2Cr2 O7зҡ„зәҜеәҰдёәВ В В В В %гҖӮ в‘ЎдёҠиҝ°жөҒзЁӢдёӯK2Cr2O7еҸ‘з”ҹж°§еҢ–иҝҳеҺҹеҸҚеә”еҗҺжүҖеҫ—жә¶ж¶ІдёӯйҷӨеҗ«жңү Cr 3+ пјҢиҝҳеҗ«жңүдёҖе®ҡжө“еәҰзҡ„Fe3+пјҢеҸҜйҖҡиҝҮи°ғpHзҡ„ж–№жі•дҪҝдёӨиҖ…иҪ¬еҢ–дёәжІүж·ҖгҖӮеҒҮи®ҫдёӨз§ҚзҰ»еӯҗеҲқе§Ӣжө“еәҰеқҮдёә2Г—10-3 mo/LпјҢеҪ“жә¶ж¶ІдёӯеҲҡејҖе§ӢжһҗеҮәCr(OH)3жІүж·Җж—¶пјҢc(Fe3+)=В В В В В В В В В В В В В mo/LгҖӮ{е·ІзҹҘпјҡKsp [Fe(OH)3 ]=4.0Г—10 -38 пјҢKsp [Cr(OH)3 ]=6.0Г—10 -31 }
|
||||
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
д»ҘдёӢжҳҜеҗҲжҲҗдёҖз§ҚеҠҹиғҪй«ҳеҲҶеӯҗIзҡ„и·Ҝзәҝеӣҫ
е·ІзҹҘд»ҘдёӢдҝЎжҒҜпјҡ
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)В В В Gдёӯе®ҳиғҪеӣўзҡ„еҗҚз§°дёәВӯВӯВӯВӯВӯ_________________пјҢ_________________пјӣ (2)В В В еҸҚеә”в‘ е’Ңв‘Ҙзҡ„еҸҚеә”зұ»еһӢеҲҶеҲ«дёә_________________пјҢ_________________пјӣ (3)В В В дёӢеҲ—е…ідәҺзү©иҙЁCзҡ„иҜҙжі•й”ҷиҜҜзҡ„жҳҜ__________(еЎ«еӯ—жҜҚж ҮеҸ·) A. еҸҜеҲ©з”ЁзәўеӨ–е…үи°ұжі•зЎ®е®ҡзү©иҙЁCдёӯзҡ„е®ҳиғҪеӣў B. зү©иҙЁCеӯҳеңЁйЎәеҸҚејӮжһ„дҪ“ C. зү©иҙЁCиғҪдёҺNaHCO3еҸҚеә”дә§з”ҹж°”дҪ“ D. зү©иҙЁCжңҖеӨҡжңү8дёӘеҺҹеӯҗе…ұе№ійқў (4)В В В еҸҚеә”в‘Јзҡ„еҢ–еӯҰж–№зЁӢејҸдёә__________________________________________пјӣ (5)В В В Fзҡ„еҗҢеҲҶејӮжһ„дҪ“дёӯеҗ«жңүиӢҜзҺҜдё”иӢҜзҺҜдёҠиҝһжңү3дёӘзЎқеҹәзҡ„з»“жһ„е…ұжңү_______з§ҚгҖӮ
|
|
- еҢ—дә¬2020е№ҙй«ҳдёүеҢ–еӯҰдёҠеӯҰжңҹе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- жұҹиӢҸй«ҳдёҖеҢ–еӯҰжңҹжң«иҖғиҜ•пјҲ2019е№ҙеҗҺеҚҠжңҹпјүзҪ‘дёҠиҖғиҜ•з»ғд№
- 2018-2019е№ҙй«ҳдёҖдёӢеӯҰжңҹејҖеӯҰиҖғиҜ•еҢ–еӯҰпјҲе®үеҫҪзңҒе®ҡиҝңйҮҚзӮ№дёӯеӯҰпјү
- йҮҚеәҶеёӮжқЁе®¶еқӘдёӯеӯҰ2020-2021е№ҙй«ҳдёҖеүҚеҚҠжңҹ1жңҲжңҲиҖғеҢ–еӯҰйўҳе…Қиҙ№еңЁзәҝжЈҖжөӢ
- жұҹиӢҸзңҒеҫҗе·һеёӮйӮіе·һеёӮиҝҗжІідёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠжңҹ第дәҢж¬ЎеӯҰжңҹи°ғз ”еҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·
- жјіе№іеёӮ2019е№ҙй«ҳдёүдёҠжңҹеҢ–еӯҰжңҲиҖғжөӢйӘҢеёҰзӯ”жЎҲдёҺи§Јжһҗ
- еұұдёң2020е№ҙй«ҳдёүеҢ–еӯҰдёҠеӯҰжңҹжңҲиҖғжөӢйӘҢе…Қиҙ№иҜ•еҚ·
- 2018иҮі2019е№ҙй«ҳдәҢеҗҺеҚҠжңҹ第дәҢж¬ЎжңҲиҖғеҢ–еӯҰиҜ•еҚ·е®Ңж•ҙзүҲпјҲжұҹиӢҸзңҒе®ҝиҝҒеёӮжІӯйҳіеҺҝдҝ®иҝңдёӯеӯҰпјү