2018高一上学期人教版高中化学期中考试
| 1. | 详细信息 |
|
下列说法正确的是 A.金属氧化物都是碱性氧化物 B.酸性氧化物都是非金属氧化物 C.含有氧元素的化合物均为氧化物 D.难溶于水的氢氧化物其对应的氧化物也难溶于水
|
|
| 2. | 详细信息 |
|
有Ca(OH)2(固体)、CuSO4•5H2O(固体)、CH3COOH(液态)这些物质归为一类,下列哪些物质还可以和它们归为一类 A.医用酒精 B.Fe(OH)3胶体 C.液态HCl D.碱石灰
|
|
| 3. | 详细信息 | |||||||||
|
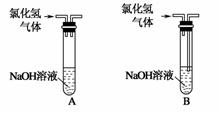
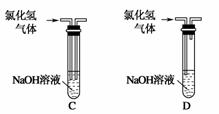
实验室常用氢氧化钠溶液吸收氯化氢尾气,以防止环境污染。下列既能吸收尾气,又能防止溶液倒吸的装置是
|
||||||||||
| 4. | 详细信息 |
|
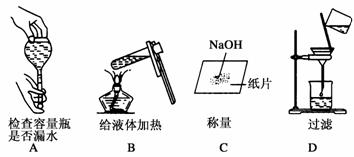
有下列实验操作或事故处理方法正确的有: A.给试管中的液体加热时,应将试管倾斜,试管口斜向上,与桌面成45°角,直接集中在药品处加热; B.夜间发生厨房煤气泄漏,应立即开灯检查煤气泄漏的原因,并打开所有门窗通风; C.用50 mL量筒量取2 mL蒸馏水; D.固体药品用广口瓶保存。
|
|
| 5. | 详细信息 |
|
为了除去粗盐中的Ca2+、Mg2+、SO ①过滤 ②加过量的NaOH溶液 ③加过量的盐酸 ④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液 ⑥加热蒸发 A.②④⑤①③⑥ B.④⑤②①③⑥ C.①②⑤④③⑥ D.②⑤④①③⑥
|
|
| 6. | 详细信息 |
|
下列实验操作正确的是
|
|
| 7. | 详细信息 |
|
NA表示阿伏加德罗常数,下列叙述正确的是( ) A.1 mol·L-1Na2SO4溶液含有2NA个Na+ B.1.7 g H2O2中含有的电子数为0.9NA C.标准状况下,用H2O2制备11.2 L氧气共转移2NA个电子 D.等质量的N2和CO所含分子数均为NA
|
|
| 8. | 详细信息 |
|
下列有关叙述正确的是 ①水的摩尔质量是18 g ②0.5 mol H2的体积为11.2 L ③1 mol水中含有2 mol氢和1 mol氧 ④1 mol任何物质都约含有6.02×1023个分子 ⑤0.5 mol H2SO4含有的原子数目为3.5NA ⑥只有在标准状况下,体积相同的任何气体所含的分子数相同 ⑦质量分数为40 %的硫酸溶液与等体积的水混合,所得溶液浓度大于20 % ⑧物质的量浓度为4mol/L的硫酸溶液与等质量的水混合,所得溶液浓度小于2mol/L A.①③④⑤⑦⑧ B.②⑤⑦⑧ C.⑤⑦⑧ D.⑤⑦
|
|
| 9. | 详细信息 |
|
在体积相同的两个密闭容器中分别充满C2H4、C3H6气体,当这两个容器内温度和气体密度相等时,下列说法正确的是 A.两种气体的压强是P(C2H4) <P(C3H6) B.C2H4比C3H6的质量小 C.两种气体的分子数目相等 D.两种气体的氢原子数目相等
|
|
| 10. | 详细信息 |
|
在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达错误的是 A.体积②>③>①>④ B.密度②>③>④>① C.质量②>③>④>① D.氢原子个数①>③>④>②
|
|
| 11. | 详细信息 |
|
若50 g密度为ρ g·cm-3的硝酸铁溶液里含2.8 g 铁离子,则硝酸根离子的物质的量浓度是 A.ρ/3 mol·L-1 B.15/ρ mol·L-1 C.1.5ρ mol·L-1 D.3ρ mol·L-1
|
|
| 12. | 详细信息 |
|
在标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为 A.
|
|
| 13. | 详细信息 |
|
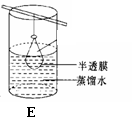
“纳米材料”是粒子直径为1 nm~100nm(1nm=10-9m)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质 ①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过半透膜 ⑥静置后,会析出黑色沉淀 A.①④⑥ B.②③④ C.②③⑤ D.②③④⑤
|
|
| 14. | 详细信息 |
|
关于胶体的性质与应用,相关说法错误的是 A.静电除尘器除去空气或工厂废气中的飘尘是利用胶粒的带电性而加以除去 B.由于胶粒之间有排斥作用,胶粒不易聚集成大的颗粒,这是胶体具有介稳性的原因之一 C.泥浆中泥沙是溶质、水是溶剂 D.胶体的聚沉属于物理过程
|
|
| 15. | 详细信息 |
|
向胶体中加入电解质能使胶体聚沉,使一定量的胶体溶液在一定时间内开始聚沉所需电解质的浓度(mol/L)称作“聚沉值”,电解质“聚沉值”越小,则表示其聚沉能力越大,实验证明:聚沉能力主要取决于与胶体所带相反电荷的离子所带电荷数,电荷数越大,聚沉能力越大。向Fe(OH)3胶体中加入下列电解质时,其“聚沉值”最小的是 A.Na3PO4 B.K2SO4 C.FeCl3 D.NaCl
|
|
| 16. | 详细信息 |
|
为了检验SO A.方案甲:试液 B.方案乙:试液 C.方案丙:试液 D.方案丁:试液
|
|
| 17. | 详细信息 |
|
下列离子反应方程式正确的是 ①碳酸氢钙溶液与过量烧碱溶液混合:Ca2++HCO3−+OH−错误!未找到引用源。CaCO3+H2O ②碳酸镁与稀硫酸:MgCO3+2H+错误!未找到引用源。H2O+CO2↑+Mg2+ ③醋酸与大理石:2CH3COOH+CaCO3错误!未找到引用源。Ca2++2CH3COO−+H2O+CO2↑ ④向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42﹣刚好沉淀完全: H++SO42−+Ba2++OH−错误!未找到引用源。H2O+BaSO4↓ ⑤向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+错误!未找到引用源。H2SiO3↓+2 Na+ ⑥Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+错误!未找到引用源。2Fe3++2H2O A. ①②③④⑥ B.②③④⑥ C.②③④ D.①③④⑤
|
|
| 18. | 详细信息 |
|
下列反应可用离子方程式“H++OH−=H2O” 表示的是 A.稀硫酸与澄清石灰水溶液混合 B.浓硫酸与烧碱溶液混合 C.浓硝酸与氢氧化钾溶液混合 D.浓盐酸与石灰乳溶液混合
|
|
| 19. | 详细信息 |
|
在下列各溶液中,离子一定能大量共存的是 ①强碱性溶液中:K+、HCO3-、Cl-、SO ②小苏打溶液:K+、SO ③含有0.1 mol·L-1 Ca2+的溶液中:Na+、K+、CO ④室温下,强酸性溶液中:Na+、Fe3+、NO ⑤使酚酞试液变红的溶液:Na+、Cl-、SO ⑥使紫色石蕊试液变红的溶液:Fe2+、Mg2+、MnO ⑦常温pH<7的溶液:K+、Ba2+、Cl-、Br- A.二项 B.三项 C.四项 D.五项
|
|
| 20. | 详细信息 |
|
.已知X和Y是两种单质,它们之间能发生反应:X+Y=X2++Y2−。下列叙述中正确的是 ①X被氧化 ②X是氧化剂 ③Y2−是还原产物 ④X2+具有氧化性 ⑤Y2−具有还原性⑥Y单质氧化性比X2+氧化性强 A.①②③ B.①②⑥ C.①③④⑤⑥ D.①③④⑤
|
|
| 21. | 详细信息 |
|
下列反应中,属于非氧化还原反应的是 A.3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O B.3Cl2+6KOH=5KCl+KClO3+3H2O C.3H2O2+2KCrO2+2KOH=2K2CrO4+4H2O D.3CCl4+K2Cr2O7=2CrO2Cl2+3COCl2↑+2KCl
|
|
| 22. | 详细信息 |
|
R2O A.1 B.2 C.3 D.4
|
|
| 23. | 详细信息 |
|
.已知氧化性:Cl2>Br2>Fe3+>I2,则下列离子方程式正确的是: A.少量氯气与FeBr2溶液反应 Cl2+ 2Br− ===2Cl−+Br2 B.过量氯气与FeBr2溶液反应 Cl2+Fe2+ + 2Br− ===2Cl−+Br2+Fe3+ C.氯气与FeBr2溶液以物质的量1:1反应 2Cl2+2Fe2+ +2Br− ===4Cl−+Br2+2Fe3+ D.少量氯气与FeI2溶液反应 Cl2+2Fe2+===2Cl−+2Fe3+
|
|
| 24. | 详细信息 |
|
已知溴水(Br2)显橙黄色,碘水(I2)显棕黄色;还原性:Br−<Fe2+<I−<SO32−。有一无色未知溶液可能含有K+、Fe2+、SO42−、I−、SO32−中的一种或者几种,现做以下实验: ①取部分溶液加入少量溴水,振荡,溶液呈无色; ②向①的溶液中加入过量氯化钡溶液,产生白色沉淀,再加过量稀硝酸沉淀不溶解; ③取少量②的溶液滴入足量AgNO3溶液,有白色沉淀生成。 下列关于无色溶液组成的判断正确的是 A.肯定含有SO32−,肯定不含Fe2+、I−,可能含有K+、SO42− B.肯定含有SO42−,肯定不含Fe2+、I−,可能含有K+、SO32− C.肯定含有K+、SO32−,肯定不含Fe2+,可能含有SO42−、I− D.肯定含有SO42−、SO32−,肯定不含Fe2+、I−,可能含有K+
|
|
| 25. | 详细信息 |
|
Ⅰ.完成下列反应的离子方程式 (1)实验室制备Fe(OH)3胶体的离子方程式:_____________________________。 (2)20mL0.1mol/L的Ca(HCO3)2溶液与30mL0.1mol/L的NaOH溶液混合反应的离子方程式:_____________________________。 Ⅱ.(3)用双线桥标出下列反应电子转移的方向和数目并回答: 11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO4 (4)该反应氧化剂是________________;氧化产物是_____________ (5)该反应每1molCuSO4能氧化_____molP(填字母) A.11/15 B.2/5 C.1/3 D.1/5
|
|
| 26. | 详细信息 |
|
现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制500 mL 0.2 mol·L-1的稀硫酸。可供 选择的仪器:①玻璃棒,②烧瓶,③烧杯,④胶头滴管,⑤量筒,⑥容量瓶,⑦托盘天平,⑧药匙。 请回答下列问题: (1)上述仪器中,在配制稀硫酸时用不到的仪器有______(填代号)。 (2)配制溶液时,一般可以分为以下几个步骤: ①量取 ②计算 ③稀释 ④摇匀 ⑤移液 ⑥洗涤 ⑦定容 ⑧冷却 ⑨初步振荡 ⑩装瓶贴签 其正确的操作顺序为②①③ __________⑥__________④⑩(填序号)。 (3)经计算,需浓硫酸的体积为________mL。现有①10 mL、②50 mL、③100 mL三种规格的量筒,应选用的量筒是______(填代号)。 (4)在配制过程中,其他操作都准确,下列操作中错误且能使所配溶液浓度偏高的有______。(填代号) ①洗涤量取浓硫酸后的量筒,并将洗涤液转入容量瓶中 ②未等稀释后的硫酸溶液冷却至室温就转入容量瓶内 ③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸 ④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出 ⑤转移前,容量瓶中含有少量蒸馏水 ⑥定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线 ⑦定容时俯视刻度线
|
|
| 27. | 详细信息 |
|
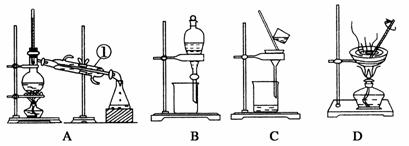
Ⅰ.如下图所示是中学化学中常用的混合物分离和提纯的装置。
请根据装置A、B、C、D、E回答下列问题: (1)从硫酸钡和硫酸钠的混合液中分离出硫酸钡,可选择装置_________(填字母,下同); (2)从氯化钠(大量)和硝酸钾(少量)的混合溶液中分离出氯化钠(晶体)的方法是___________, ____________,洗涤,干燥。整个过程选择装置___________; (3)分离酒精和水,选择装置__________________; (4)装置A中①的名称是____________,冷却水的流动方向是_________________。 (5)从淀粉和氯化钠的混合液中分离出氯化钠,,选择装置__________;该实验称为_________(填方法)。 (6)碘水中提取碘单质(固体)的方法是:先用________装置,可选用哪种萃取剂_______(填代号) 然后用__________装置,分离出的碘单质(固体)处于____________装置中(填名称)。 ①酒精 ②苯 ③醋酸 ④汽油 (7)在用装置B进行操作时,为使液体顺利滴下,应进行的具体操作是_______________________。分液后漏斗内剩余的液体从分液漏斗的________(填“上口”或“下口”)倒入烧杯。
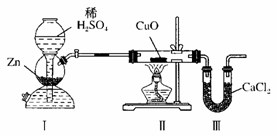
(8)计算m(H):m(O)=_____;(用含m 、n的式子表示) (9)若实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是( ) A.CuO没有全部被还原 B.Ⅲ装置后缺少干燥装置 C.Ⅱ装置中玻璃管内有水冷凝 D.Ⅰ、Ⅱ装置之间缺少干燥装置 E.U型管中CaCl2失效
|
|
| 28. | 详细信息 |
|
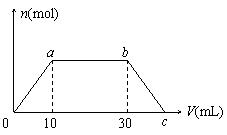
(1)0到a点之间的反应的离子方程式_________________。 (2)a到b点之间的反应的离子方程式_________________。 (3)b点之后的反应的离子方程式____________________。 (4)c点CO2的体积_________mL(同温同压下)。 (5)混合溶液中Ba(OH)2和NaOH的物质的量之比为________。
|
|
- 河南省南阳市鸭河工业南都实验中学2020-2021年高一上册10月月考化学题免费试卷
- 高一下册期末考试理综化学免费试卷带答案和解析(2019-2020年四川省眉山市)
- 2020届百校联考高考百日冲刺金卷全国Ⅱ卷 化学
- 2018-2019年高一前半期期中考试化学考题同步训练(内蒙古自治区正镶白旗察汗淖中学)
- 鲁科版选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时1 化学平衡常数 平衡转化
- 2019-2020年高二下期期中考试化学试卷(浙江省宁波市北仑中学)
- 四川省成都市简阳市阳安中学2020-2021年高一上册期中考试化学试卷在线练习
- 陕西省榆林市第十二中学2021届高三上半年第三次月考化学试卷在线练习