2015е®үеҫҪй«ҳдёүдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёүж°ҹеҢ–ж°®(NF3)жҳҜеҫ®з”өеӯҗе·ҘдёҡдёӯдјҳиүҜзҡ„зӯүзҰ»еӯҗеҲ»иҡҖж°”дҪ“пјҢе®ғеңЁжҪ®ж№ҝзҡ„зҺҜеўғдёӯиғҪеҸ‘з”ҹеҸҚеә”пјҡ3NF3пјӢ5H2O===2NOпјӢHNO3пјӢ9HFгҖӮдёӢеҲ—жңүе…іиҜҘеҸҚеә”зҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В гҖҖ) AпјҺNF3еҲҶеӯҗдёӯжүҖжңүеҺҹеӯҗе…ұе№ійқўВ В В В В В В В В BпјҺNF3еңЁеҸҚеә”дёӯж—ўеҒҡж°§еҢ–еүӮеҸҲеҒҡиҝҳеҺҹеүӮ CпјҺз”ҹжҲҗ0.2mol HNO3ж—¶иҪ¬з§»0.2molз”өеӯҗВ DпјҺ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
NAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°пјҢдёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү AпјҺ100mLВ 1molВ·L-1AlCl3жә¶ж¶Ідёӯеҗ«зҡ„йҳізҰ»еӯҗж•°зӯүдәҺ0.1NA BпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4L CCl4дёӯеҗ«жңүзҡ„CCl4еҲҶеӯҗж•°дёәNA CпјҺе°Ҷ2mL 0пјҺ5molВ·LпјҚlNa2SiO3жә¶ж¶Іж»ҙе…ҘзЁҖзӣҗй…ёдёӯеҲ¶еҫ—H2SiO3иғ¶дҪ“пјҢжүҖеҗ«иғ¶зІ’ж•°дёә0пјҺ001NA DпјҺдёҖе®ҡжқЎд»¶дёӢпјҢ2.3gNaе®Ңе…ЁдёҺO2еҸҚеә”з”ҹжҲҗ3.6gдә§зү©ж—¶еӨұеҺ»зҡ„з”өеӯҗж•°дёә0.1NA
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©дёӢпјҢеңЁдёӢеҲ—з»ҷе®ҡжқЎд»¶зҡ„еҗ„жә¶ж¶ІдёӯпјҢдёҖе®ҡиғҪеӨ§йҮҸе…ұеӯҳзҡ„зҰ»еӯҗз»„жҳҜ(В ) AпјҺPHеӨ§дәҺ7зҡ„жә¶ж¶Іпјҡ Na+гҖҒBa2+гҖҒSO32пјҚгҖҒClOвҖ” BпјҺеҗ«жңү0.1 molВ·LпјҚ1 Fe(NO3)2зҡ„жә¶ж¶ІпјҡH+гҖҒMg2+гҖҒSCNпјҚгҖҒClпјҚ CпјҺдҪҝй…ҡй…һиҜ•ж¶ІеҸҳзәўиүІзҡ„жә¶ж¶ІпјҡNaпјӢгҖҒBa2+гҖҒIпјҚгҖҒClпјҚ DпјҺз”ұж°ҙз”өзҰ»дә§з”ҹзҡ„c(H+)=10пјҚ13molВ·LВӯпјҚ1зҡ„жә¶ж¶ІпјҡNH4+гҖҒSO42пјҚгҖҒNO3пјҚгҖҒClпјҚ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
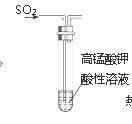
е®һйӘҢи®ҫи®ЎжҳҜеҢ–еӯҰе®һйӘҢзҡ„йҮҚиҰҒжҠҖиғҪд№ӢдёҖгҖӮз”ЁжүҖз»ҷиЈ…зҪ®
еӣҫв‘ В В В В В В В В В В В В В В В В еӣҫв‘ЎВ В В В В В В В В В еӣҫв‘ўВ В В В В В В В В В В еӣҫв‘Ј AпјҺеӣҫв‘ дёӯKMnO4жә¶ж¶Ізҙ«зәўиүІиӨӘеҺ»пјҢиҜҙжҳҺSO2е…·жңүжјӮзҷҪжҖ§ BпјҺеӣҫв‘ЎиғҪжһ„жҲҗй“ңй”ҢеҺҹз”өжұ CпјҺеӣҫв‘ўеҲ©з”ЁжҺ’з©ә气法收йӣҶдәҢж°§еҢ–зўі DпјҺеӣҫв‘ЈжЈҖжҹҘиЈ…зҪ®ж°”еҜҶжҖ§
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
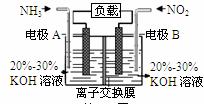
AпјҺз”өжөҒд»ҺеҸідҫ§з”өжһҒз»ҸиҝҮиҙҹиҪҪеҗҺжөҒеҗ‘е·Ұдҫ§з”өжһҒ BпјҺAз”өжһҒдёҠеҸ‘з”ҹж°§еҢ–еҸҚеә”пјҢBдёәжӯЈжһҒ C. з”өжһҒAжһҒеҸҚеә”ејҸдёә2NH3-6e-=N2+6H+ D. еҪ“жңү2.24LNO2(ж ҮеҮҶзҠ¶еҶө) иў«еӨ„зҗҶж—¶пјҢиҪ¬з§»з”өеӯҗдёә0.4mol
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©дёӢпјҢдёӢеҲ—жә¶ж¶Ізҡ„pHжҲ–еҫ®зІ’зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰе…ізі»жӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү AпјҺ0.1molВ·LпјҚ1NaHCO3жә¶ж¶Ідёӯзҡ„зІ’еӯҗжө“еәҰпјҡ c(Na+)>c(HCO3пјҚ)>c(CO32пјҚ)>c(H2CO3)>c(OHпјҚ)>c(HпјӢ) В В B.е°Ҷж ҮеҶөдёӢ2.24Lзҡ„CO2йҖҡе…Ҙ150mL 1molВ·L-1NaOHжә¶ж¶Ідёӯе……еҲҶеҸҚеә”еҗҺзҡ„жә¶ж¶Іпјҡ В В В 2c(NaпјӢ)пјқ3c(CO32пјҚ)пјӢ3c(HCO3пјҚ)пјӢ3c(H2CO3) В C.pHпјқ3зҡ„дәҢе…ғејұй…ёH2Rжә¶ж¶ІдёҺpHпјқ11зҡ„NaOHжә¶ж¶Іж··еҗҲеҗҺпјҢж··еҗҲжә¶ж¶Ізҡ„pHзӯүдәҺ7пјҢВ В В В еҲҷеҸҚеә”еҗҺзҡ„ж··еҗҲж¶Іпјҡ2c(R2пјҚ)пјӢc(HRпјҚ)пјһc(NaпјӢ) В В D.0.2 molВ·L-1зҡ„жҹҗдёҖе…ғй…ёHAжә¶ж¶Іе’Ң0.1 molВ·L-1NaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲеҗҺжә¶ж¶ІpHеӨ§дәҺ7В В В В В еҲҷеҸҚеә”еҗҺзҡ„
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
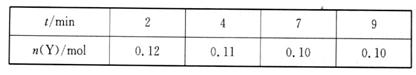
еңЁдёҖе®ҡжё©еәҰдёӢпјҢе°Ҷж°”дҪ“Xе’Ңж°”дҪ“Yеҗ„0.16 molе……е…Ҙ10 LжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯпјҢеҸ‘з”ҹеҸҚеә”пјҡX(g)+Y(g) вҮҢ 2Z(g)В в–іH<0пјҢдёҖж®өж—¶й—ҙеҗҺиҫҫеҲ°е№іиЎЎгҖӮеҸҚеә”иҝҮзЁӢдёӯжөӢе®ҡзҡ„ж•°жҚ®еҰӮдёӢиЎЁпјҡ
дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜВ В В В (В В В В ) AпјҺиҜҘжё©еәҰдёӢжӯӨеҸҚеә”зҡ„е№іиЎЎеёёж•°K=1.44 BпјҺе…¶д»–жқЎд»¶дёҚеҸҳпјҢеҚҮй«ҳжё©еәҰпјҢеҸҚеә”иҫҫеҲ°ж–°е№іиЎЎеүҚ CпјҺеҸҚеә”еүҚ2 minзҡ„е№іеқҮйҖҹзҺҮv (Z)=4. DпјҺе…¶д»–жқЎд»¶дёҚеҸҳпјҢеҶҚе……е…Ҙ0.2 mol ZпјҢе№іиЎЎж—¶Xзҡ„дҪ“з§ҜеҲҶж•°дёҚеҸҳ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||
|
XгҖҒYгҖҒZгҖҒWжҳҜе…ғзҙ е‘ЁжңҹиЎЁдёӯеүҚеӣӣе‘Ёжңҹзҡ„еёёи§Ғе…ғзҙ пјҢе…¶зӣёе…ідҝЎжҒҜеҰӮдёӢиЎЁпјӣ
в‘ҙ XдҪҚдәҺе…ғзҙ е‘ЁжңҹиЎЁдҪҚзҪ®дёә第第__________е‘Ёжңҹ第_________ж—ҸгҖӮXзҡ„дёҖз§ҚеҚ•иҙЁзҶ”зӮ№еҫҲй«ҳпјҢзЎ¬еәҰеҫҲеӨ§пјҢеҲҷиҝҷз§ҚеҚ•иҙЁзҡ„жҷ¶дҪ“еұһдәҺВ В В В В В В В В В жҷ¶дҪ“гҖӮ в‘ө XдёҺYдёӯз”өиҙҹжҖ§иҫғејәзҡ„жҳҜ(еЎ«е…ғзҙ з¬ҰеҸ·пјүВ В В В В пјӣXY2зҡ„з”өеӯҗејҸжҳҜВ В В В В В В В пјҢеҲҶеӯҗдёӯеӯҳеңЁВ В В В В В В зҡ„ ⑶Z2Y2дёӯеҗ«жңүзҡ„еҢ–еӯҰй”®зұ»еһӢжңүВ В В В В В В В В В В В В В В В В В В В пјӣWзҡ„еҹәжҖҒеҺҹеӯҗж ёеӨ–з”өеӯҗжҺ’еёғејҸжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘·еәҹж—§еҚ°еҲ·з”өи·ҜжқҝдёҠжңүWзҡ„еҚ•иҙЁAгҖӮз”ЁH2O2е’ҢH2SO4зҡ„ж··еҗҲжә¶ж¶ІеҸҜжә¶еҮәеҚ°еҲ·з”өи·ҜжқҝдёҠзҡ„AгҖӮе·ІзҹҘпјҡ A(s)+H2SO4 (aq) == ASO4 (aq) + H2(g)гҖҖВ В О”H=+64.4kJВ·mol-1 2H2O2(l) == 2H2O(l) + O2(g)гҖҖВ В В В В В В В В В О”H= -196.4kJВ·mol-1 H2(g)+ иҜ·еҶҷеҮәAдёҺH2SO4гҖҒH2O2еҸҚеә”з”ҹжҲҗASO4(aq)е’ҢH2O(l)зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸ(Aз”ЁеҢ–еӯҰејҸиЎЁзӨә)пјҡ гҖҖВ В В В
|
|||||||||||
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
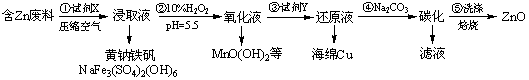
ZnOжҳҜз”өй•ҖгҖҒж¶Ӯж–ҷгҖҒжңүжңәеҗҲжҲҗзӯүеҢ–еӯҰе·Ҙдёҡзҡ„йҮҚиҰҒеҺҹж–ҷгҖӮжҹҗиҜҫйўҳз»„и®ҫи®Ўз”ұеҗ«й”Ңе·Ҙдёҡеәҹж–ҷпјҲеҗ«FeгҖҒCuгҖҒMnзӯүжқӮиҙЁпјүз”ҹдә§ZnOзҡ„е·ҘиүәжөҒзЁӢеҰӮдёӢпјҡ
е·ІзҹҘпјҡй»„й’ й“ҒзҹҫеңЁpHдёә1.5пјҢжё©еәҰдёә90в„ғж—¶е®Ңе…ЁжІүж·ҖпјҢдё”жҳ“дәҺиҝҮж»ӨгҖӮ В В В В В В 2Cu +O2 +2H2SO4В ==В 2CuSO4+2H2O
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
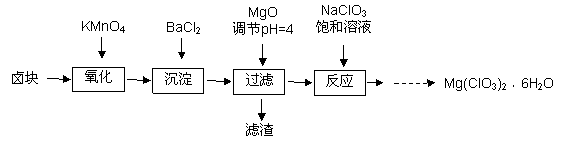
ж°Ҝй…ёй•Ғ[ Mg(ClO3)2 ]еёёз”ЁдҪңеӮ¬зҶҹеүӮгҖҒйҷӨиҚүеүӮзӯүпјҢе®һйӘҢе®ӨеҲ¶еӨҮе°‘йҮҸMg(ClO3)2В·6H2Oзҡ„жөҒзЁӢеҰӮдёӢпјҡ
е·ІзҹҘпјҡв‘ еҚӨеқ—дё»иҰҒжҲҗеҲҶдёәMgCl2В·6H2OпјҢ еҗ«жңүMgSO4гҖҒFeCl2зӯүжқӮиҙЁгҖӮ в‘ЎMg(ClO3)2гҖҒNaClO3 гҖҒMgCl2 гҖҒNaCl еӣӣз§Қ еҢ–еҗҲзү©зҡ„ пјҲ1пјүпјҺеҠ йҖҹеҚӨеқ—еңЁKMnO4жә¶ж¶Ідёӯжә¶и§Јзҡ„жҺӘж–Ҫжңүпјҡ В В В В В В В В В В В В В В В В В В пјҲеҶҷеҮәдёҖзӮ№еҚіеҸҜпјүгҖӮ дә§е“ҒдёӯMg(ClO3)2В·6H2Oеҗ«йҮҸзҡ„жөӢе®ҡпјҡ жӯҘйӘӨ1пјҡеҮҶзЎ®з§°йҮҸ3.0 gдә§е“Ғй…ҚжҲҗ100 mLжә¶ж¶ІгҖӮ жӯҘйӘӨ2пјҡеҸ–10.00 mLиҜ•ж¶І жӯҘйӘӨ3пјҡеҶ·еҚҙиҮіе®Өжё©пјҢз”Ё0.100 mol/L K2Cr2O7В жә¶ж¶Іж»ҙе®ҡеү©дҪҷзҡ„Fe2пјӢиҮіз»ҲзӮ№гҖӮ жӯӨиҝҮзЁӢдёӯеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҡCr2O72пјҚпјӢ6Fe2пјӢпјӢ14HпјӢвҶ’2Cr3пјӢпјӢ6Fe3пјӢпјӢ7H2OгҖӮ жӯҘйӘӨ4пјҡе°ҶжӯҘйӘӨ2гҖҒ3йҮҚеӨҚдёӨж¬Ў пјҲ4пјүпјҺв‘ еҶҷеҮәжӯҘйӘӨ2дёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ в‘ЎжӯҘйӘӨ3дёӯиӢҘж»ҙе®ҡеүҚдёҚз”Ёж ҮеҮҶж¶Іж¶Ұжҙ—ж»ҙе®ҡз®ЎпјҢе°ҶдјҡеҜјиҮҙжңҖз»Ҳз»“жһңВ В В В пјҲеЎ«вҖңеҒҸеӨ§вҖқгҖҒ вҖңеҒҸе°ҸвҖқжҲ–вҖңдёҚеҸҳвҖқпјүпјӣ пјҲ5пјүпјҺиӢҘе№іеқҮж¶ҲиҖ—K2Cr2O7В В В жә¶ж¶І15.00 m
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||||||||||
|
жҹҗеҢ–еӯҰе°Ҹз»„еҗҢеӯҰеҗ‘дёҖе®ҡйҮҸеҠ е…Ҙе°‘йҮҸж·ҖзІүзҡ„NaHSO3жә¶ж¶ІдёӯеҠ е…ҘзЁҚиҝҮйҮҸзҡ„KIO3жә¶ж¶ІпјҢдёҖж®өж—¶й—ҙеҗҺпјҢжә¶ж¶ІзӘҒ然еҸҳи“қиүІгҖӮ В пјҲ1пјүжҹҘйҳ…иө„ж–ҷзҹҘNaHSO3дёҺиҝҮйҮҸKIO3еҸҚеә”еҲҶдёәд»ҘдёӢдёӨжӯҘиҝӣиЎҢпјҢ第дёҖжӯҘдёәIO3пјҚ+ 3HSO3пјҚ=3SO42пјҚ+3H+ + IпјҚпјҢеҲҷ第дәҢжӯҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә_____________________________ В пјҲ2пјүйҖҡиҝҮжөӢе®ҡжә¶ж¶ІеҸҳи“қжүҖз”Ёж—¶й—ҙжҺўз©¶жө“еәҰе’Ңжё©еәҰеҜ№иҜҘеҸҚеә”зҡ„еҸҚеә”йҖҹзҺҮзҡ„еҪұе“ҚгҖӮи°ғиҠӮеҸҚеә”зү©жө“еәҰе’Ңжё©еәҰиҝӣиЎҢеҜ№жҜ”е®һйӘҢпјҢи®°еҪ•еҰӮдёӢпјҡ
е®һйӘҢв‘ в‘ЎжҳҜжҺўз©¶______________еҜ№еҸҚеә”йҖҹзҺҮзҡ„еҪұе“ҚпјҢиЎЁдёӯa=________пјӣе®һйӘҢв‘ в‘ўжҳҜжҺўз©¶жё©еәҰеҜ№еҸҚеә”йҖҹзҺҮзҡ„еҪұе“ҚпјҢеҲҷиЎЁдёӯb=________пјҢc=________ В В В пјҲ3пјүе°ҶNaHSO3жә¶ж¶ІдёҺKIO3жә¶ж¶Іж··еҗҲ(йў„е…ҲеҠ е…ҘеҸҜжә¶жҖ§ж·ҖзІүдёәжҢҮзӨәеүӮ)пјҢз”ЁйҖҹзҺҮжЈҖжөӢд»ӘжЈҖжөӢеҮәиө·е§Ӣйҳ¶ж®өеҸҚеә”йҖҹзҺҮйҖҗжёҗеўһеӨ§пјҢдёҖж®өж—¶й—ҙеҗҺеҸҚеә”йҖҹзҺҮеҸҲйҖҗжёҗеҮҸе°ҸгҖӮиҜҫйўҳз»„еҜ№иө·е§Ӣйҳ¶ж®өеҸҚеә”йҖҹзҺҮйҖҗжёҗеўһеӨ§зҡ„еҺҹеӣ жҸҗеҮәеҰӮдёӢеҒҮи®ҫпјҢиҜ·дҪ е®ҢжҲҗеҒҮи®ҫдёүпјҡ В В еҒҮи®ҫдёҖпјҡеҸҚеә”з”ҹжҲҗзҡ„SO42пјҚеҜ№еҸҚеә”иө·еӮ¬еҢ–дҪңз”ЁпјҢSO42пјҚжө“еәҰи¶ҠеӨ§еҸҚеә”йҖҹзҺҮи¶Ҡеҝ«пјӣ В В еҒҮи®ҫдәҢпјҡеҸҚеә”з”ҹжҲҗзҡ„H+еҜ№еҸҚеә”иө·еӮ¬еҢ–дҪңз”ЁпјҢH+жө“еәҰи¶ҠеӨ§еҸҚеә”йҖҹзҺҮи¶Ҡеҝ«пјӣ В В еҒҮи®ҫдёүпјҡ__________________________________________________________пјӣ В В В вҖҰвҖҰ В пјҲ4пјүиҜ·дҪ и®ҫи®Ўе®һйӘҢйӘҢиҜҒдёҠиҝ°еҒҮи®ҫдёҖпјҢе®ҢжҲҗдёӢиЎЁдёӯеҶ…е®№пјҲеҸҚеә”йҖҹзҺҮеҸҜз”ЁжөӢйҖҹд»ӘжөӢе®ҡпјү
|
|||||||||||||||||||||||||||||
- еҗҲиӮҘеёӮй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҹжң«иҖғиҜ•иҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- й«ҳдёҖеҢ–еӯҰдёӢеҶҢеҚ•е…ғжөӢиҜ•ж‘ёеә•иҖғиҜ•йўҳ
- е®үеҫҪ2019е№ҙй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹдёӯиҖғиҜ•еёҰзӯ”жЎҲдёҺи§Јжһҗ
- й«ҳдёҖдёҠеҶҢжңҹжң«з»ҹиҖғеҢ–еӯҰзҪ‘дёҠжЈҖжөӢж— зәёиҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲ2019-2020е№ҙе№ҝдёңзңҒиӮҮеәҶеёӮз«Ҝе·һеҢәпјү
- еұұдёңй«ҳдёҖеҢ–еӯҰжңҲиҖғжөӢйӘҢпјҲ2019е№ҙдёӢеҚҠе№ҙпјүеңЁзәҝеҒҡйўҳ
- иҺҶз”°еёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹдёӯиҖғиҜ•е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- 2018иҮі2019е№ҙй«ҳдәҢдёӢеҚҠе№ҙжңҹдёӯиҖғиҜ•еҢ–еӯҰиҖғиҜ•е®Ңж•ҙзүҲпјҲеҗүжһ—зңҒеҗүжһ—еёӮ第дә”еҚҒдә”дёӯеӯҰпјү
- ж–°д№ЎеёӮй«ҳдәҢеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·иҜ•еҚ·е®Ңж•ҙзүҲ
 В
В