2018湖南高二下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
1.对比以下几个反应式: Cl+Cl==Cl2 ΔH= -247 kJ·mol-1 O+O==O2 ΔH= -493 kJ·m N+N==N2 ΔH= -946 kJ·mol-1 从能量变化的角度分析可以得出的结论是( ) A.在常温下氮气比氧气、氯气都稳定 B.氮、氧、氯的单质常温下为气体 C.氮、氧、氯的单质都是双原子分子 D.氮气、氧气和氯气的密度不同
|
|
| 2. | 详细信息 |
|
在25℃、101kPa下,1g乙醇完全燃烧生成CO2和液态水时放热29.72kJ,下列热化学方程式正确的是( ) A.CH3CH2OH(l)+3O2(g)==2CO2(g)+ 3H2O(l) △H=+1367kJ/mol B.2CH3CH2OH(l)+6O2(g)==4CO2(g)+ 6H2O(l) △H=-2734kJ/mol C.2CH3CH2OH(l)+6O2(g)==4CO2(g)+ 6H2O(l) △H=-1367kJ/mol D.2CH3CH2OH(l)+6O2(g)==4CO2(g)+ 6H2O(l) △H=+2734kJ/mol
|
|
| 3. | 详细信息 |
|
根据以下3个热化学方程式: 2H2S(g)+3O2(g)===2SO2(g)+2H2 2H2S(g)+O2(g)===2S(s)+2H2O(l) ΔH=-b kJ·mol-1 2H2S(g)+O2(g)===2S(s)+2H2O(g) ΔH=-c kJ·mol-1(a、b、c均为正数) 对a、b、c三者大小关系的判断正确的是( ) A.a>b>c B.a>c>b C.c>b>a D.b>a>c
|
|
| 4. | 详细信息 |
|
已知:S(s)+O2(g)==SO2(g) ΔH=-297.16 kJ·mol-1 2SO2(g)+O2(g) 下列说法正确的是 ( ) A.1 mol SO2(g)的能量总和大于1 mol S(s)和1 mol O2(g)的能量总 B.将2 mol SO2(g)与1 mol O2(g)在一定条件下充分反应,放出196.6 kJ的热量 C.S(g)+O2(g)===SO2(g) ΔH=-Q,Q值小于297.16 kJ D.当1 mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46 kJ的热量
|
|
| 5. | 详细信息 |
|
在25 ℃、101 kPa时,CH4(g)、H2(g)、C(s)的燃烧热分别是-890.3 kJ·mol-1、-285.8 kJ·mol-1和-393.5 kJ·mol-1,则CH4(g)―→C(s)+2H2(g)的ΔH是( ) A.-74.8 kJ·mol-1 B.+74.8 kJ·mol-1 C.-211.0 kJ·mol-1 D.+211.0 kJ·mol-1
|
|
| 6. | 详细信息 |
|
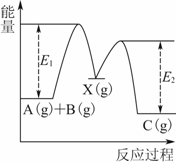
反应A(g)+B(g)―→C(g) ΔH,分两步进行:
②X(g)―→C(g) ΔH2 反应过程中能量变化如下图所示,E1表示A+B―→X的活化能。下列说法正确的是( ) A.ΔH1=ΔH-ΔH2>0 B.X是反应A(g)+B(g)―→C(g)的催化剂 C.E2是反应②的活化能 D.ΔH=E1-E2
|
|
| 7. | 详细信息 |
|
已知:①101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ/mol ②稀溶液中H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol 下列结论正确的是( ) A.碳的燃烧热大于110.5 kJ/mol B.①的反应热为221 kJ/mol C.浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
|
|
| 8. | 详细信息 |
|
下列说法或表示法正确的是( ) A.等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多 B.由C(石墨)→C(金刚石) ΔH=+1.19 kJ· mol—1可知,金刚石比石墨稳定 C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ· mol—1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学 方程式表示为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ· mol—1
|
|
| 9. | 详细信息 |
|
已知:可逆反应2SO2(g)+O2(g) A.升温增压 B.降温增压 C.升温减压 D.降温减压
|
|
| 10. | 详细信息 |
|
下列叙述中,不正确的是( ) A.某特定反应的平衡常数仅是温度的函数 B.催化剂不能改变平衡常数的大小 C.平衡常数发生变化,化学平衡必定发生移动达到新的平衡 D.化学平衡发生移动,平衡常数必发生变化
|
|
| 11. | 详细信息 |
|
下列说法正确的是( ) A.凡是放热反应都是自 B.自发反应一定是熵增大,非自发反应一定是熵减小或不变 C.自发反应在恰当条件下才能实现 D.自发反应在任何条件下都能实现
|
|
| 12. | 详细信息 |
|
.对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3 kJ/mol,且熵减小,在常温常压下该反应能自发进行,对反应的方向起决定作用的是( ) A.焓变 B.温度 C.压强 D.熵变
|
|
| 13. | 详细信息 |
|
.密闭容器中进行下列反应:M(g)+N(g) A.正反应 B.正反应吸热,L为固体或纯液体 C.正反应放热,L为气体 D.正反应放热,L为固体或纯液体
|
|
| 14. | 详细信息 |
|
可逆反应aA(g)+bB(g)
B.增大压强,B的转化率减小 C.当反应达到平衡时,混合气体的密度不再变化 D.a+b>c+d
|
|
| 15. | 详细信息 |
|
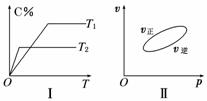
.在容积不变的密闭容器中存在如下反应:2A(g)+B(g)
A.图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响 B.图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响 C.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高 D.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
|
|
| 16. | 详细信息 |
|
取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( ) A.0.01 mol/L B.0.017 mol/L C.0.05 mol/L D.0.50 mol/L
|
|
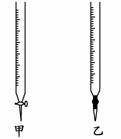
| 17. | 详细信息 |
|
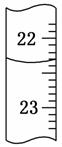
.用0.1026 mol/L的盐酸滴定25.00 mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如右图所示,正确的读数为( ) A.22.30 mL B.22.35 mL C.23.65 mL D.23.70 mL
|
|
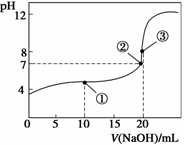
| 18. | 详细信息 |
|
常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如下图。
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO- C.点③所示溶液中:NaOH与CH3COOH恰好完全中和,溶液呈中性 D.在0.100 0 mol·L-1 CH3COOH溶液中,由水电离出来的c(H+)= 10-13 mol·L-1
|
|
| 19. | 详细信息 |
|
下列说法正确的是( ) A.将某电解质溶液加水稀释,溶液中各离子浓度都减小 B.25 ℃时,pH=2的盐酸与pH=12的氨水等体积混合后,混合液中c(H+)=c(OH-) C.0.1 mol·L-1 CH3COOH溶液在稀释过程中c(H+)/c(CH3COOH)将变大 D.25 ℃时,pH=3的某酸溶液与pH=11的Na
|
|
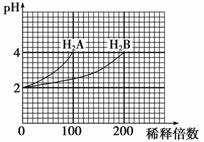
| 20. | 详细信息 |
|
常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示关系,则下列有关叙述正确的是( ) A.H2A的电离方程式为H2A B.pH=4的H2A水溶液中c(OH-)=10-12 mol·L-1 C.NaHA、NaHB的混合溶液中,阴离子有A2-、HA-、HB-、B2-、OH- D.Na2B的水溶液能与H2A溶液发生反应
|
|
| 21. | 详细信息 | ||||||||
|
.已知,25 ℃时有关弱酸的电离平衡常数如下表:
下列有关说法正确的是( ) A.等物质的量浓 B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液不可能呈碱性 C.向Na2C2O4溶液中滴加足量HCN溶液产生二氧化碳气体 D.H2C2O4能使酸性高锰酸钾溶液褪色
|
|||||||||
| 22. | 详细信息 | |||||||||||||||
|
如图为10 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图像,依据图像推出X和Y的物质的量浓度是下表内各组中的( )
|
||||||||||||||||
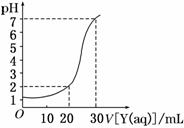
| 23. | 详细信息 | |||||||||||||||||||||||||
|
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考图示从下表中选出正确选项( )
|
||||||||||||||||||||||||||
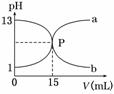
| 24. | 详细信息 |
|
下图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )
A.盐酸的物质的量浓度为1 mol/L B.P点时反应恰好完全,溶液呈中性 C.曲线a是盐酸滴定氢氧化钠的滴定曲线 D.酚酞不能用作本实验的指示剂
|
|
| 25. | 详细信息 |
|
在一定温度下,容积相同的两个密闭容器中,一个充入2 mol SO2、1 mol O2,另一个充入2 mol SO3,发生反应2SO2(g)+O2(g) ①二氧化硫的转化率与三氧化硫的分解率之和为1 ②达到平衡所需的时间相等 ③密度相等 ④压强相等 ⑤放出与吸收的热量相等 ⑥二氧化硫的浓度相同 A.3种 B.4种 C.5种 D.6种
|
|
| 26. | 详细信息 |
|
某温度下,CO2饱和溶液的浓度是0.03 mol·L-1,其 A.3 B.4 C.5 D.6
|
|
| 27. | 详细信息 |
|
常温下,下列叙述不正确的是( ) A.pH=3的弱酸溶液与pH=11的强碱溶液等体积混合后溶液呈酸性 B.pH=5的硫酸溶液稀释到原来的500倍,稀释后c(SO C.向冰醋酸溶液中逐滴加水,则溶液的导电性、醋酸的电离度、溶液的pH均先增大后减小 D.中和10 mL 0.1 mol·L-1醋酸与100 mL 0.01 mol·L-1醋酸所需的NaOH物质的量相同
|
|
| 28. | 详细信息 | ||||||||
|
高炉炼铁过程中发生的主要反应为:
请回答下列问题: (1)该反应的平衡常数表达式K=________,ΔH________0(填“>”、“<”或“=”); (2)在一个容积为10 L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________ mol/(L·min),CO的平衡转化率=________;
|
|||||||||
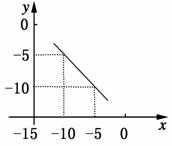
| 29. | 详细信息 |
|
在某温度下的水溶液中,c(H+)=10xmol/L,c(OH-)=10ymol/L,x与y的关系如图所示:
(1)该温度下,水的离子积为_______ (2)该温度下,0.01mol/L NaOH溶液中c(H+)为________ mol/L。
|
|
| 30. | 详细信息 |
|
已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题: (1)该溶液中c(H+)=________ mol/L。 (2)HA的电离平衡常数K=________。 (3)升高温度时,K________(填“增大”,“减小”或“不变”)。 (4)由HA电离出的c(H+)约为水电离出的c(H+)的________倍。
|
|
| 31. | 详细信息 | ||||||||||||||
|
在2 L密闭容器内,800℃时反应2NO(g)+O2(g)
(1)800℃,反应达到平衡时,NO的物质的量浓度为__________ mol/L;升高温度,NO的浓度增大,则该反应是________(填“放热”或“吸热”)反应。
(3)能说明该反应已达到平衡状态的是________。 a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v逆(NO)=2v正(O2) d.容器内密度保持不变 (4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。 a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
|
|||||||||||||||