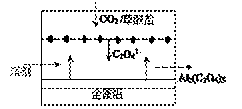2019江西高三上学期人教版(2019)高中化学高考模拟
| 1. | 详细信息 |
|
下列有关化学与生产、生活的说法中,不正确的是( ) A. 陶瓷、水泥和玻璃都属于硅酸盐产品 B. “雨后彩虹”“海市蜃楼”既是一种光学现象,也与胶体的知识有关 C. 铝合金的大量使用归功于人们能使用焦炭从氧化铝中获得铝 D.二氧化硫是主要的大气污染物,能形成酸雨,其PH小于5.6
|
|
| 2. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列叙述正确的是( ) A.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA B.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA C.4.0g由H218O与D216O组成的混合物中所含中子数为2NA D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为 0.6NA
|
|
| 3. | 详细信息 | ||||||||||||||||||||
|
下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )
|
|||||||||||||||||||||
| 4. | 详细信息 |
|
下列说法正确的是( ) ①发生了颜色变化的一定是化学变化。②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 ③由NaH2PO2是正盐知H3PO2是一元酸。④酸性:H2SO4>H3PO4>H2CO3>H3BO3 ⑤从海水中提取物质都必须通过化学反应才能实现。⑥酸性氧化物都能与水反应生成酸。 ⑦232Th转化成233U是化学变化。⑧微粒半径:r(K+)>r(Al3+)>r(S2-)>r(Cl-) A. ②③④ B.②③⑤⑦ C.②④⑥⑦ D.①②④⑥⑧
|
|
| 5. | 详细信息 |
|
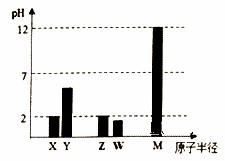
X、Y、Z、W、M为短周期主族元素,25°C时,其最高价氧化物对应的水化物(浓度均为 0.01mol·L-1)溶液的pH和原子半径的关系如图所示。下列有关说法不正确的是( ) A. 最简单气态氢化物的热稳定性:Z>W B.Y的最高价氧化物的电子式为: C. W的气态氢化物是强酸 D. X、M两种元素形成的简单离子半径大小顺序:X>M
|
|
| 6. | 详细信息 |
|
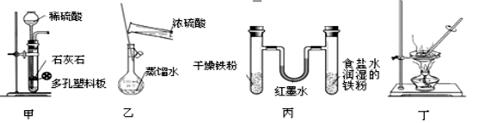
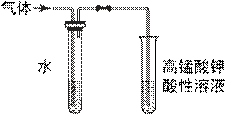
用下列实验装置进行相应实验,设计正确且能达到实验目的的是( )
A.甲用于实验室制取少量CO2 B.乙用于配制一定物质的量浓度的硫酸 C.丙用于模拟生铁的电化学腐蚀 D.丁用于蒸干A1Cl3溶液制备无水AlCl3
|
|
| 7. | 详细信息 |
|
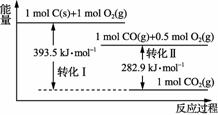
根据如下能量关系示意图分析,下列说法正确的是( )
A. 1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ B. 反应2CO(g)+O2(g)===2CO2(g)中,反应物的总键能小于生成物的总键能 C. C→CO的热化学方程式为2C(s)+O2(g)===2CO(g) ΔH=-110.6 kJ·mol-1 D. 热值是指一定条件下单位质量的物质完全燃烧所放出的热量,则CO的热值ΔH=10.1 kJ·g-1
|
|
| 8. | 详细信息 |
|
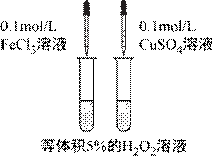
下列图示的实验设计能实现相应实验目的的是 ( )
A.验证FeCl3溶液中是否含有Fe2+ B.检验溴乙烷消去的产物
C.检验氯气与亚硫酸钠是否发生反应 D.对比Fe3+和Cu2+对H2O2分解的催化效果
|
|
| 9. | 详细信息 |
|
A.该装置能将电能转变为化学能 B.正极的电极反应为:C2O42--2e-=2CO2 C.每得到1 mol草酸铝,电路中转移3 mol电子 D.利用该技术可捕捉大气中的CO2
|
|
| 10. | 详细信息 |
|
某溶液含以下离子 Na+、 K+、 Al3+、 Ba2+、 SO42-、 I-、 CO32-中的一种或几种,除水电离产生的 H+和 OH-外不再含其它离子,为确定其成份,进行了如下实验,分别取样:①用 pH 计测试,溶液显弱酸性②加氯水和淀粉无明显现象③用铂丝蘸取溶液在酒精灯上灼烧可观察到黄色火焰。为确定该溶液的组成,还需检验的离子是( ) A.K+ B.SO42- C.Ba2+ D.Al3+
|
|
| 11. | 详细信息 |
|
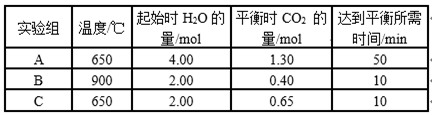
CO(g)和H2O(g)以1 : 2体积比分别通入到体积为2 L的恒容密闭容器中进行反应:CO(g)+H2O(g)
下列说法不正确的是( ) A. 从生产效益分析,C组实验的条件最佳 B. 实验A中,在0~10min内,以v(H2)表示的反应速率大于0.013mol/(L·min)-1 C. 从实验数据分析,该反应的正反应是吸热反应 D. 比较实验B、C,说明C实验使用了更高效的催化剂
|
|
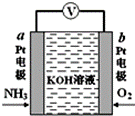
| 12. | 详细信息 |
|
NH3被氧化为常见无毒物质。下列说法错误的是( ).Com] A.溶液中OH-向电极a移动 B.负极的电极反应式为:2NH3-6e-+ 6OH-===N2↑+ 6H2O C.O2在电极b上发生还原反应 D.反应消耗的NH3与O2的物质的量之比为4︰5
|
|
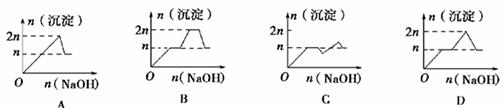
| 13. | 详细信息 | |||||||||||||||
|
向含MgCl2、AlCl3均为n mol的混合液中逐滴加入NaOH溶液至过量,有关离子沉淀或沉淀溶解与pH关系如下表
列表示生成沉淀与加入NaOH的物质的量关系的图像中,关系正确的是( )
|
||||||||||||||||
| 14. | 详细信息 |
|
氢化铝锂(LiAlH4)和硼氢化钠(NaBH4)在有机合成中非常重要,可发生如下反应: ①LiAlH4+4H2O=LiOH+Al(OH)3+4H2↑、②NaBH4+NH4Cl=NH3BH3+NaCl+H2↑, 则下列说法错误的是( ) A.LiAlH4中H元素为-1价 B.反应②中,每生成1 mol NH3BH3会转移2 mol e- C.两个反应中,H2均既是氧化产物,又是还原产物 D.NH4Cl和NaBH4所含化学键类型相同
|
|
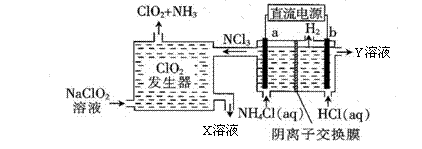
| 15. | 详细信息 |
|
二氧化氯(ClO2),黄绿色易溶于水的气体,是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备,其原理如图所示:
下列说法不正确的是( ) A. b电极接电源的负极,在b极区流出的Y溶液是稀盐酸 B. 二氧化氯发生器中排出的X溶液中溶质主要为NaCl和NaOH C. 电解过程中二氧化氯发生器中产生2.24 L(标准状况)NH3,则b极产生0.6 g H2 D. 电解池a极的电极反应式为NH4+-6e-+4OH-+3Cl-═NCl3+4H2O
|
|
| 16. | 详细信息 |
|
一定量的某磁黄铁矿(主要成分FexS,S为-2价)与100 mL盐酸恰好完全反应(矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是( ) A.该盐酸的物质的量浓度为4.25 mol·L-1 B.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1 C.生成的H2S气体在标准状况下的体积为2.24 L D.该磁黄铁矿中FexS的x=0.85
|
|
| 17. | 详细信息 |
|
A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素。B、C、D均能与A形成10电子分子,E单质可用于野外焊接钢轨的原料,F与D同主族。 (1)D、E、F的离子半径由大到小的顺序为 (填离子符号)。 (2)F和G形成的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,该反应的化学方程式为 。 (3)C能分别与A和D按原子个数比1:2形成化合物乙和丙,乙的结构式为________。常温下,液体乙与气体丙反应生成两种无污染的物质,该反应的氧化产物与还原产物的物质的量之比为 。 (4)现取100 mL1 mol/L的E的氯化物溶液,向其中加入1 mol/L NaOH溶液产生了3.9 g沉淀,则加入的NaOH溶液体积可能为 mL。
|
|
| 18. | 详细信息 |
|
(1)锡(Sn)是一种重要的金属,纯锡可用于制作超导材料。锡元素位于元素周期表第五周期第ⅣA族。请写出锡在元素周期表中的原子序数是 。 (2)P2O5 是一种干燥剂,下列气体不能用 P2O5 干燥的是 (填字母序号)。 A.SO2 B.NH3 C.CO D.H2 E.H2S F.O2 (3)取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是_______________。 (4)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)进行实验。 ①写出CNO-在酸性条件下被NaClO氧化的离子方程式:____________________________; ②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为 。
|
|
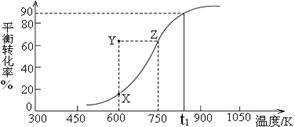
| 19. | 详细信息 |
|
纳米级Cu2O既是航母舰艇底部的防腐蚀涂料,也是优良的催化剂。 (1)已知:C(s)+ 4CuO(s) ΔH =–292kJ•mol-1 ,则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式 。 (2)用纳米级Cu2O作催化剂可实现甲醇脱氢制取甲醛: CH3OH(g)
①600K时,Y点甲醇的v(正) v(逆)(填“>”或“<”)。 ②从Y点到X点可采取的措施是___________________________________。 ③在t1K时,向固定体积为2L的密闭容器中充入1molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)=_____________, 温度为t1时,该反应的平衡常数K=____________。
|
|
| 20. | 详细信息 |
|
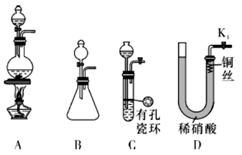
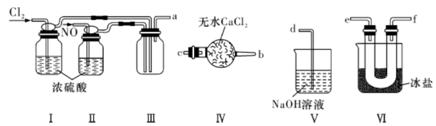
亚硝酰氯(NOC1,熔点为一64.5 ℃,沸点为-5.5℃)是一种黄色气体,遇水易水解生成两种酸。其可用于合成清洁剂、触媒剂及中间体等。亚硝酰氯可在实验室由氯气与一氧化氮在常温常压下合成。 (1) NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为 。 (2) A、B、C装置(夹持仪器已省略)中不可用于制备Cl2的是 (填字母代号)。
(3) 用D装置制备NO,检验D装置气密性的方法是 。 (4) 将上述选好的发生装置与以下装置连接,制备亚硝酰氯。
①装置连接顺序为a (按气流自左向右方向,用小写字母代号填空)。 ②装置Ⅰ、Ⅱ除可干燥NO、C12外,另一个作用是 。 ③有少量NOCl进入了装置V中,则装置V中吸收尾气时,NOCl发生反应的化学方程式为 。 (5) 某同学查阅资料得知,王水在一定条件下可转化为亚硝酰氯和氯气,该反应的化学方程式为 。
|
|
| 21. | 详细信息 |
|
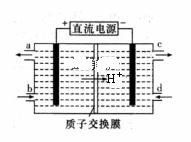
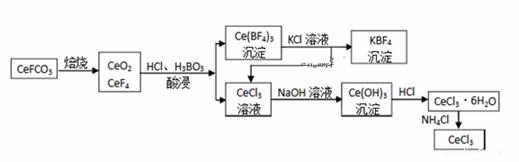
镧系金属元素铈(Ce)常见有+3、+4两种价态,铈的合金耐高温,可以用来制造喷气推进器零件。请回答下列问题: (1)雾霾中含有的污染物NO可以被含Ce4+的溶液吸收,生成NO2-、NO3- 物质的量之比为1:1,试写出该反应的离子方程式: 。 (2)用电解的方法可将上述吸收液中的NO2- 转化为稳定的无 毒气体,同时生成Ce4+,其原理如下图所示。 ①无毒气体从电解槽的 (填字母代号)口逸出。 ②每生成标准状况下22.4L无毒气体,同时可再生Ce4+ mol (3)铈元素在自然界中主要以氟碳铈矿的形式存在,其主要化学成分为 CeFCO3。工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下图所示
①焙烧过程中发生的主要反应的氧化剂和还原剂的物质的量之比为 。 ②向Ce(BF4)3中加入KCl溶液的目的是 _。 ③常温下,当溶液中的某离子的浓度≤1.0×10—5mol·L—1时,可认为该离子沉淀完全。据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到 时,即可视为Ce3+已沉淀完全。( 已知Ksp[Ce(OH)3]=1.0×10—20 ) ④加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是 。
|
|