2019福建高二下学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700oC时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些“理解”,你认为其中错误的是( ) A.这个反应是氧化还原反应 B.金刚石属于金属单质 C.另一种化合物为NaCl D.制造过程中元素种类没有改变
|
|
| 2. | 详细信息 |
|
分类是学习化学的重要方法.下列归纳正确的是( ) A.SO2、SiO2、CO均为酸性氧化物 B.纯碱、烧碱、熟石灰都属于碱类 C.氨气、冰醋酸、食盐均为电解质 D.碱性氧化物都是金属氧化物
|
|
| 3. | 详细信息 |
|
下列变化中,前者是物理变化,后者是化学变化,且都有明显颜色变化的是( ) A.打开盛装NO的集气瓶;冷却NO2气体 B.用冰水混合物冷却SO3气体;加热氯化铵晶体 C.木炭吸附NO2气体;将氯气通入品红溶液中 D.向酚酞溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液
|
|
| 4. | 详细信息 |
|
下列说法正确的是( ) A.CO2的水溶液能导电,所以CO2是电解质 B.BaSO4不溶于水,其水溶液的导电能力极弱,所以BaSO4是弱电解质 C.液溴不导电,所以溴是非电解质 D.强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强
|
|
| 5. | 详细信息 |
|
下列有关溶液的说法正确的是( ) A.将10 g CaCO3粉末加入100 mL水中,所得溶液的浓度为1 mol·L-1 B.将100 mL 2 mol·L-1盐酸加热蒸发至50 mL,所得溶液的浓度为4 mol·L-1 C.将10 mL 1.0 mol·L-1NaCl溶液与90 mL水混合,所得溶液的浓度为0.1 mol·L-1 D.将10 g CaO加入100 mL饱和石灰水中,充分搅拌,静置并恢复到原来的温度,所得溶液的浓度不变
|
|
| 6. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列叙述中正确的是( ) A.1 L 1 mol/L的Na2CO3溶液中含有的CO32-数目为 B.常温常压下,8 g O2含有的电子数是4NA C.标准状况下,2.24 L CCl4中含有的分子数为0.1NA D.25℃时,1 L pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2
|
|
| 7. | 详细信息 |
|
某溶液中有①NH A.①② B.①③ C.②③ D.③④
|
|
| 8. | 详细信息 |
|
常温下,下列各组离子在指定溶液中一定能大量共存的是( ) A. 澄清透明的溶液中:Fe3+、Ba2+、NO3-、Cl- B. 使酚酞变红色的溶液中:Na+、NH4+、C1-、SO42- C. c(Al3+)=0.1mol/L的溶液中:K+、Mg2+、SO42-、AlO2- D. 由水电离产生的c(H+)=10-13mol/L的溶液中:K+、Na+、CH3COO-、NO3-
|
|
| 9. | 详细信息 |
|
下列离子方程式书写正确的是( ) A.氧化亚铁溶于稀硝酸:FeO + 2H+ == Fe2+ + H2O B.往CaCl2溶液中通入少量的CO2: Ca2++CO2+H2O=CaCO3↓+2H+ C.碘化亚铁溶液与足量氯气反应:2I-+Cl2===I2+2Cl- D.向澄清石灰水中滴加少量的NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
|
|
| 10. | 详细信息 |
|
某溶液中大量存在如下五种离子:NO3-、SO42-、Fe3+、H+、M,它们的物质的量浓度之比依次为c(NO3-)︰c(SO42-)︰c(Fe3+)︰c(H+)︰c(M)=2︰3︰1︰3︰1,则M可能是( ) A.Cl- B.Fe2+ C.Mg2+ D.Ba2+
|
|
| 11. | 详细信息 |
|
100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO A.0.20 mol·L-1 B.0.25 mol·L-1 C.0.40 mol·L-1 D.0.50 mol·L-1
|
|
| 12. | 详细信息 |
|
下列说法不正确的是( ) A.温度相同、体积相同的O2(g)和N2(g)所含的分子数一定相同 B.等温等压下,SO2气体与CO2气体的密度之比等于16∶11 C.温度和容积相同的两容器中分别盛有5 mol O2和2 mol N2,则压强之比为5∶2 D.等温等压条件下,5 mol O2(g)和2 mol H2(g)的体积之比等于5∶2
|
|
| 13. | 详细信息 | ||||||||||||||||||||||
|
下表各物质中,A、B、C、D、E均含有同一种短周期元素,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D与水反应的产物。则各物质之间通过一步反应就能实现表中所示转化的是( )
A.②③ B.②④ C.①③④ D.①②③④
|
|||||||||||||||||||||||
| 14. | 详细信息 |
|
工业上从海水中提取溴单质时,可用纯碱溶液吸收空气吹出的溴,发生反应: (I )3Br2+3Na2CO3===5NaBr+NaBrO3+3CO2; (II )5NaBr+NaBrO3 +3H2SO4 ===3Na2SO4 +3Br2+3H2O 下列有关判断正确的是( ) A.反应I中氧化剂与还原剂的物质的量之比为1:1 B.溴元素由化合态转化成游离态时一定发生了还原反应 C.反应II中生成3 mol Br2时,必有5 mol电子转移 D.氧化还原反应中化合价变化的元素一定是不同种元素
|
|
| 15. | 详细信息 |
|
为检验某种钠盐溶液中含有的阴离子是SO A.检验CO B.检验SO C.检验OH-:向待测液中加入石蕊溶液,溶液变红色 D.检验Cl-:向待测液中加入AgNO3溶液和稀盐酸的混合液,有白色浑浊物出现
|
|
| 16. | 详细信息 |
|
下列说法正确的是( ) A.不能发生丁达尔效应的分散系是溶液 B.将1 L 2 mol·L-1的FeCl3溶液制成胶体后,其中含有的氢氧化铁胶粒数为2NA C.纳米粒子的大小与胶体粒子相当,但纳米粒子的体系不一定是胶体 D.将饱和FeCl3溶液加热至沸腾,制得Fe(OH)3胶体
|
|
| 17. | 详细信息 |
|
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口,关于双氧水,回答下列问题: A.Na2O2+2HCl===2NaCl+H2O2 B.Ag2O+H2O2===2Ag+O2↑+H2O C.2H2O2===2H2O+O2↑ D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O (1)上述反应中,不属于氧化还原反应的是______(填字母,下同),H2O2仅体现还原性的反应是____。 (2)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是___________________。 (3)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、MnO ①反应体系选择的酸是_____。 A.盐酸 B.硫酸 C.醋酸 ②该反应的离子方程式为____________________________________________。 ③如果上述反应中有2.24 L(标准状况)气体生成,转移的电子的物质的量为________mol。 (4) H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实验:KCN+H2O2+H2O===A+NH3↑,试指出生成物A的化学式为______
|
|
| 18. | 详细信息 |
|
写出下列离子方程式: (1)FeSO4溶液中加入用H2SO4酸化的H2O2溶液: (2)Na2S2O3溶液中加入稀硫酸: (3)用过量氨水吸收工业尾气中的SO2: (4)在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:
|
|
| 19. | 详细信息 |
|
现有一份含有FeCl3和FeCl2的固体混合物,某化学兴趣小组为测定各成分的含量进行如下两个实验: 实验1 ①称取一定质量的样品,将样品溶解; ②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀; ③将沉淀过滤、洗涤、干燥得到白色固体28.7 g 实验2 ①称取与实验1中相同质量的样品,溶解; ②向溶解后的溶液中通入足量的Cl2; ③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀; ④将沉淀过滤、洗涤后,加热灼烧到质量不再减少,得到固体Fe2O36.40g 根据实验回答下列问题: (1)溶解过程中所用到的玻璃仪器有 (2)实验室保存FeCl2溶液时通常会向其中加入少量的铁粉,其作用是 (3)用化学方程式表示实验2的步骤②中通入足量Cl2的反应: (4)用容量瓶配制实验所用的NaOH溶液,下列情况会使所配溶液浓度偏高的是(填序号)________。 a.未冷却溶液直接转移 b.没用少量蒸馏水洗涤烧杯和玻璃棒2~3次并转入容量瓶 c.加蒸馏水时,不慎超过了刻度线 d.砝码上沾有杂质 e.容量瓶使用前内壁沾有水珠 (5)检验实验2的步骤④中沉淀洗涤干净的方法是 (6)该小组每次称取的样品中含有FeCl2的质量为 g
|
|
| 20. | 详细信息 |
|
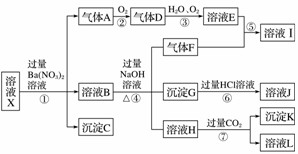
某强酸性溶液X中可能含有Fe2+、Fe3+、Al3+、Ba2+、NH
根据以上信息,回答下列问题: (1)由强酸性条件即可判断X溶液中肯定不存在的离子有________________ (2)溶液X中关于硝酸根离子的判断,正确的是______(填编号,下同)。 a.一定含有 b.一定不含有 c.可能含有 (3)化合物I中含有的化学键类型有________________ (4)转化⑦的离子方程式为______________________________________ (5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是________。 ①NaOH溶液 ②KSCN溶液 ③氯水和KSCN的混合溶液 ④pH试纸 ⑤KMnO4溶液
|
|