2016иҙөе·һй«ҳдёүдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
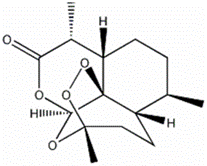
В В В В AпјҺйқ’и’ҝзҙ зҡ„еҲҶеӯҗејҸдёәпјҡC12H12O5 В В В В BпјҺйқ’и’ҝзҙ з»“жһ„дёӯеҗ«жңүиӢҜзҺҜ В В В В CпјҺйқ’и’ҝзҙ з»“жһ„дёӯжңүеҗ«ж°§е®ҳиғҪеӣў В В В В DпјҺйқ’и’ҝзҙ дёҚиғҪеҸ‘з”ҹж°ҙи§ЈеҸҚеә”
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
В XгҖҒYгҖҒZгҖҒMгҖҒWдёәдә”з§Қзҹӯе‘Ёжңҹе…ғзҙ гҖӮXгҖҒYгҖҒZжҳҜеҺҹеӯҗеәҸж•°дҫқж¬ЎйҖ’еўһзҡ„еҗҢе‘Ёжңҹе…ғзҙ пјҢ дё”жңҖеӨ–еұӮз”өеӯҗж•°д№Ӣе’Ңдёә15пјӣXдёҺZеҸҜеҪўжҲҗXZ2еҲҶеӯҗпјӣYдёҺMеҪўжҲҗзҡ„ж°”жҖҒеҢ–еҗҲзү©еңЁж Ү еҮҶзҠ¶еҶөдёӢзҡ„еҜҶеәҰдёә0.76 gВ·LпјҚ1пјӣWзҡ„иҙЁеӯҗж•°жҳҜXгҖҒYгҖҒZгҖҒMеӣӣз§Қе…ғзҙ иҙЁеӯҗж•°д№Ӣе’Ңзҡ„ дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺз”ұXе…ғзҙ еҪўжҲҗзҡ„еҚ•иҙЁдёҚдёҖе®ҡжҳҜеҗҢз§Қзү©иҙЁ BпјҺXZ2гҖҒX2M2гҖҒW2Z2еқҮдёәзӣҙзәҝеһӢзҡ„е…ұд»·еҢ–еҗҲзү© CпјҺеҺҹеӯҗеҚҠеҫ„пјҡWпјһZпјһYпјһXпјһM В В В DпјҺз”ұXгҖҒYгҖҒZгҖҒMеӣӣз§Қе…ғзҙ еҪўжҲҗзҡ„еҢ–еҗҲзү©дёҖе®ҡж—ўжңүзҰ»еӯҗй”®пјҢеҸҲжңүе…ұд»·й”®
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—е®һйӘҢиғҪиҺ·еҫ—жҲҗеҠҹзҡ„жҳҜ AпјҺз”Ёж–°еҲ¶зҡ„银氨жә¶ж¶ІеҸҜеҢәеҲҶз”Ій…ёз”Ій…Ҝе’Ңд№ҷйҶӣ BпјҺиӢҜдёҺжө“жәҙж°ҙеҸҚеә”еҲ¶еҸ–жәҙиӢҜ CпјҺеҗ‘иӢҜй…ҡдёӯеҠ жө“жәҙж°ҙи§ӮеҜҹжІүж·Җ D.1 molВ·LпјҚ1 CuSO4жә¶ж¶І2 mLе’Ң0.5 molВ·LпјҚ1 NaOHжә¶ж¶І4 mLж··еҗҲеҗҺеҠ е…Ҙ40%зҡ„д№ҷйҶӣ В жә¶ж¶І0.5 mLпјҢеҠ зғӯз…®жІёи§ӮеҜҹжІүж·Җзҡ„йўңиүІ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
иғҪжӯЈзЎ®иЎЁзӨәдёӢеҲ—еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜ AпјҺж°ҜеҢ–й“Ғжә¶ж¶ІдёӯеҠ е…Ҙй“ңеұ‘В В В В В Fe3+В +В CuВ =В В Fe2+В +В Cu2+ BпјҺиӢҜй…ҡй’ жә¶ж¶ІдёҺдәҢж°§еҢ–зўіеҸҚеә”В C6H5OпјҚпјӢCO2пјӢH2O = C6H5OHпјӢCO32 пјҚ CпјҺзўій…ёж°ўй’ҷдёҺиҝҮйҮҸзҡ„NaOHжә¶ж¶ІеҸҚеә” Ca2пјӢпјӢ2HCO3пјҚ пјӢ2OHпјҚ = CaCO3вҶ“пјӢ2H2OпјӢCO32 пјҚ DпјҺзЁҖзЎқй…ёдёҺиҝҮйҮҸзҡ„й“Ғеұ‘еҸҚеә”В В В 3FeпјӢ8HпјӢпјӢ2NO3пјҚВ = 3Fe3пјӢпјӢ2NOвҶ‘пјӢ4H2O
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
В NAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°пјҢдёӢеҲ—еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜ AпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ11.2 Lж°Ұж°”дёӯеҗ«жңү B CпјҺеёёжё©еёёеҺӢдёӢпјҢ46g NO2е’ҢN2O4ж··еҗҲж°”дҪ“дёӯеҗ«жңүеҺҹеӯҗжҖ»ж•°дёә3NA DпјҺ1 mol NaдёҺи¶ійҮҸO2еҸҚеә”пјҢз”ҹжҲҗNa2Oе’ҢNa2O2зҡ„ж··еҗҲзү©пјҢиҪ¬з§»з”өеӯҗжҖ»ж•°дёә1NA
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
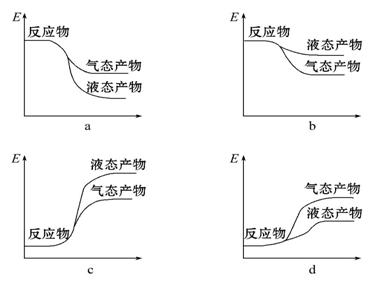
дёӢеҲ—еҸҳеҢ–иҝҮзЁӢдёӯО”Hпјң0зҡ„жҳҜ AпјҺз”өи§ЈAl2O3еҫ—еҲ°Alе’ҢO2 гҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖBпјҺHClеҲҶи§ЈдёәH2е’ҢCl2 CпјҺBa(OH)2В·8H2OдёҺNH4Clжҷ¶дҪ“ж··еҗҲеҸҚеә”гҖҖ гҖҖDпјҺNaдёҺж°ҙеҸҚеә”
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A.жңүеҚ•иҙЁеҸӮеҠ пјҢеҗҢж—¶жңүж–°еҚ•иҙЁз”ҹжҲҗзҡ„еҸҚеә”пјҢдёҖе®ҡжҳҜж°§еҢ–иҝҳеҺҹеҸҚеә” B.第дёүе‘Ёжңҹзҡ„йқһйҮ‘еұһе…ғзҙ зҡ„ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©зҡ„й…ёжҖ§д»Һе·ҰеҲ°еҸійҖҗжёҗеўһејә C.еёёжё©ж—¶пјҢејәй…ёдёҺејәзўұеҸҚеә”з”ҹжҲҗ1molж¶ІжҖҒж°ҙпјҢж”ҫеҮәзҡ„зғӯйҮҸеҚідёәдёӯе’Ңзғӯ D.з”ЁдёҒиҫҫе°”ж•Ҳеә”дёҚиғҪеҢәеҲҶжә¶ж¶Іе’Ңиғ¶дҪ“зҡ„жң¬иҙЁ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ | ||||
|
жҹҗз§Қжҫ„жё…жә¶ж¶Ід»…еҗ«дёӢиЎЁзҰ»еӯҗдёӯзҡ„5з§Қ(дёҚиҖғиҷ‘ж°ҙзҡ„з”өзҰ»дёҺзҰ»еӯҗж°ҙи§Ј)пјҢдё”еҗ„з§ҚзҰ»еӯҗзҡ„зү©иҙЁзҡ„йҮҸеқҮзӣёзӯү
иӢҘеҗ‘еҺҹжә¶ж¶ІдёӯеҠ е…Ҙи¶ійҮҸзҡ„зӣҗй…ёпјҢжңүж— иүІж°”дҪ“з”ҹжҲҗгҖӮз»ҸеҲҶжһҗеҸҚеә”еҗҺжә¶ж¶ІдёӯйҳҙзҰ»еӯҗзҡ„з§Қзұ»жІЎжңүеҸҳеҢ–гҖӮ (1)жә¶ж¶Ідёӯ________(еЎ«вҖңдёҖе®ҡвҖқвҖңдёҖе®ҡдёҚвҖқжҲ–вҖңеҸҜиғҪвҖқ)еҗ«жңүHCO3- жҲ–CO32-пјҢзҗҶз”ұжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В __________________________________________гҖӮ (2)еҺҹжә¶ж¶ІдёӯжүҖ (3)еҗ‘еҺҹжә¶ж¶ІдёӯеҠ е…Ҙи¶ійҮҸзҡ„зӣҗй…ёпјҢжңүж— иүІж°”дҪ“з”ҹжҲҗзҡ„зҰ»еӯҗ (4)еҶҷеҮәеҶ¶зӮјеҺҹжә¶ж¶ІдёӯжүҖеҗ«йҳізҰ»еӯҗеҜ№еә”зҡ„йҮ‘еұһеҚ•иҙЁзҡ„еҢ–еӯҰж–№зЁӢејҸ_____________________гҖӮ
|
|||||
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
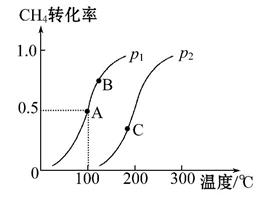
еҲ©з”ЁеӨ©з„¶ж°”еҸҜеҲ¶еҫ—д»ҘH2гҖҒCOзӯүдёәдё»иҰҒз»„жҲҗзҡ„е·ҘдёҡеҺҹж–ҷеҗҲжҲҗж°”пјҢеҸҚеә”дёәCH4(g)+H2O(g)
( в‘ иӢҘиҫҫеҲ°AзӮ№жүҖйңҖзҡ„ж—¶й—ҙдёә5 minпјҢеҲҷv(H2)=________пјҢ100в„ғж—¶е№іиЎЎ в‘Ўеӣҫдёӯзҡ„p1________(еЎ«вҖң<вҖқвҖң>вҖқжҲ–вҖң=вҖқ)p2пјҢAгҖҒBгҖҒCдёүзӮ№зҡ„е№іиЎЎеёёж•°KAгҖҒKBгҖҒKCзҡ„еӨ§е°Ҹе…ізі»(з”ұе°ҸеҲ°еӨ§)жҳҜ____________________гҖӮ (3)еҗҲжҲҗж°”з”ЁдәҺеҗҲжҲҗж°Ёж°”ж—¶йңҖйҷӨеҺ»COпјҢеҸ‘з”ҹеҸҚеә”CO(g)+H2O(g) В В В A.йҷҚдҪҺжё©еәҰВ В В В В В В В В В В В В C.е°ҶH2д»ҺдҪ“зі»дёӯеҲҶзҰ»В В В В В В В В В D.еҶҚйҖҡе…ҘдёҖе®ҡйҮҸзҡ„ж°ҙи’ёж°”
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
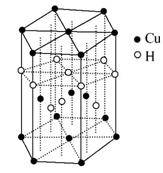
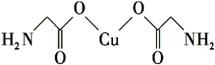
В (1)дәҡй“ңзҰ»еӯҗ(Cu+)еҹәжҖҒж—¶зҡ„д»·з”өеӯҗжҺ’еёғејҸиЎЁзӨәдёә________гҖӮ (2)зЎ’дёә第4е‘Ёжңҹе…ғзҙ пјҢзӣёйӮ»зҡ„е…ғзҙ жңүз ·е’ҢжәҙпјҢеҲҷ3з§Қе…ғзҙ зҡ„第дёҖз”өзҰ»иғҪд»ҺеӨ§еҲ°е°ҸйЎәеәҸдёә________(з”Ёе…ғзҙ з¬ҰеҸ·иЎЁзӨә)гҖӮ (3)Cuжҷ¶дҪ“зҡ„е Ҷз§Ҝж–№ејҸжҳҜ________(еЎ«е Ҷз§Ҝж–№ејҸеҗҚз§°)пјҢе…¶й…ҚдҪҚж•°дёә________пјӣеҫҖCuзҡ„зЎ«й…ёзӣҗжә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙпјҢеҸҜз”ҹжҲҗ[Cu(NH3)4]SO4пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ________гҖӮ A.[Cu(NH3)4]SO4дёӯжүҖеҗ«зҡ„еҢ–еӯҰй”®жңүзҰ»еӯҗй”®гҖҒжһҒжҖ§й”®е’Ңй…ҚдҪҚй”® B.еңЁ[Cu(NH3)4]2+дёӯCu2+з»ҷеҮәеӯӨз”өеӯҗеҜ№пјҢNH3жҸҗдҫӣз©әиҪЁйҒ“ C.[Cu(NH3)4]SO4з»„жҲҗе…ғзҙ дёӯ第дёҖз”өзҰ»иғҪжңҖеӨ§зҡ„жҳҜж°§е…ғзҙ D.SO42-дёҺPO43-дә’дёәзӯүз”өеӯҗдҪ“пјҢз©әй—ҙжһ„еһӢеқҮдёәжӯЈеӣӣйқўдҪ“ (4)ж°Ёеҹәд№ҷй…ёй“ңзҡ„еҲҶеӯҗз»“жһ„еҰӮеӣҫпјҢзўіеҺҹеӯҗзҡ„жқӮеҢ–ж–№ејҸдёә________гҖӮ
(5)й“ңе…ғзҙ дёҺж°ўе…ғзҙ еҸҜеҪўжҲҗдёҖз§ҚзәўиүІеҢ–еҗҲзү©пјҢе…¶жҷ¶дҪ“з»“жһ„еҚ•е…ғеҰӮдёӢеӣҫжүҖзӨәгҖӮеҲҷиҜҘеҢ–еҗҲзү©зҡ„еҢ–еӯҰејҸдёә________гҖӮ
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
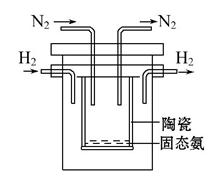
(1)е·ҘдёҡдёҠеёёз”Ёй«ҳжө“еәҰзҡ„K2CO3жә¶ж¶Іеҗёж”¶CO2пјҢеҫ—еҲ°жә¶ж¶ІXпјҢеҶҚеҲ©з”Ёз”өи§Јжі•дҪҝK2CO3жә¶ж¶ІеҶҚз”ҹпјҢе…¶иЈ…зҪ®зӨәж„ҸеӣҫеҰӮдёӢпјҡ в‘ еңЁйҳіжһҒеҢәеҸ‘з”ҹзҡ„еҸҚеә”еҢ…жӢ¬___________________е’ҢH++HCO3-В = В H2O+CO2вҶ‘гҖӮ в‘Ўз®Җиҝ°CO32-еңЁйҳҙжһҒеҢәеҶҚз”ҹзҡ„еҺҹзҗҶ____________________________________________гҖӮ (2)еҶҚз”ҹиЈ…зҪ®дёӯдә§з”ҹзҡ„CO2е’ҢH2еңЁдёҖе®ҡжқЎд»¶дёӢеҸҚеә”з”ҹжҲҗз”ІйҶҮзӯүдә§зү©пјҢе·ҘдёҡдёҠеҲ©з”ЁиҜҘеҸҚеә”еҗҲжҲҗз”ІйҶҮгҖӮе·ІзҹҘпјҡ25в„ғпјҢ101 KPaдёӢпјҡ H2(g)+1/2O2(g) CH3OH(g)+ 3/2 O в‘ еҶҷеҮәCO2е’ҢH2з”ҹжҲҗж°”жҖҒз”ІйҶҮзӯүдә§зү©зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸпјҡ____________гҖӮ в‘ЎдёӢйқўиЎЁзӨәеҗҲжҲҗз”ІйҶҮзҡ„еҸҚеә”зҡ„иғҪйҮҸеҸҳеҢ–зӨәж„ҸеӣҫпјҢе…¶дёӯжӯЈзЎ®зҡ„жҳҜ_______(еЎ«еӯ—жҜҚеәҸеҸ·)гҖӮ
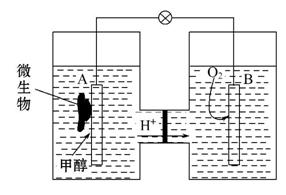
(3)еҫ®з”ҹзү©зҮғж–ҷз”өжұ жҳҜдёҖз§ҚеҲ©з”Ёеҫ®з”ҹзү©е°ҶеҢ–еӯҰиғҪзӣҙжҺҘиҪ¬еҢ–жҲҗз”өиғҪзҡ„иЈ…зҪ®гҖӮе·ІзҹҘжҹҗз§Қз”ІйҶҮеҫ®з”ҹ
зү©зҮғж–ҷз”өжұ дёӯпјҢз”өи§ЈиҙЁжә¶ж¶Ідёәй…ёжҖ§пјҢзӨәж„ҸеӣҫеҰӮдёӢпјҡ в‘ иҜҘз”өжұ еӨ–з”өи·Ҝз”өеӯҗзҡ„жөҒеҠЁж–№еҗ‘дёә____________________(еЎ«вҖңд»ҺAеҲ°BвҖқжҲ–вҖңд»ҺBеҲ°AвҖқ)гҖӮ в‘Ўе·ҘдҪңз»“жқҹеҗҺпјҢBз”өжһҒе®Өжә¶ж¶Ізҡ„pHдёҺе·ҘдҪңеүҚзӣёжҜ”е°Ҷ__________________(еЎ«вҖңеўһеӨ§вҖқвҖңеҮҸе°ҸвҖқжҲ–вҖңдёҚеҸҳвҖқпјҢжә¶ж¶ІдҪ“з§ҜеҸҳеҢ–еҝҪз•ҘдёҚи®Ў)гҖӮ в‘ўAз”өжһҒйҷ„иҝ‘з”ІйҶҮеҸ‘з”ҹзҡ„з”өжһҒеҸҚеә”ејҸдёә___________________гҖӮ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
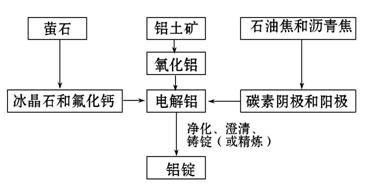
(1)ж°ЁжҳҜжңҖйҮҚиҰҒзҡ„ж°®иӮҘпјҢе…¶еҗҲжҲҗеҺҹзҗҶдёәN2(g)+3H2(g) (2)е·ІзҹҘзғӯеҢ–еӯҰж–№зЁӢејҸпјҡ Mg(OH)2(s) Al(OH)3(s) в‘ Mg(OH)2е’ҢAl(OH)3иө·йҳ»зҮғдҪңз”Ёзҡ„дё»иҰҒеҺҹеӣ жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В __гҖӮ в‘ЎзӯүиҙЁйҮҸMg(OH)2е’ҢAl(OH)3зӣёжҜ”пјҢйҳ»зҮғж•ҲжһңиҫғеҘҪзҡ„жҳҜ___________________пјҢеҺҹеӣ жҳҜ__________________________________гҖӮ (3)е·ҘдёҡдёҠпјҢй“қзҡ„з”ҹдә§жөҒзЁӢеҰӮеӣҫжүҖзӨәпјҡ
в‘ еҶҷеҮәд»Һй“қеңҹзҹҝ(дё»иҰҒжҲҗеҲҶжҳҜж°§еҢ–й“қпјҢеҗ«йҮҸдҪҺ)дёӯиҺ·еҫ—з¬Ұ в‘Ўз”өи§Јж°§еҢ–й“қж—¶пјҢеҠ е…Ҙ________(еЎ«зү©иҙЁеҗҚз§°)её®еҠ©йҷҚдҪҺзҶ”зӮ№гҖӮ
|
|
- й«ҳдёҖеҢ–еӯҰдёҠеҶҢиҜҫж—¶з»ғд№ иҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- 2019еұҠй«ҳдёүеүҚеҚҠжңҹ12жңҲжңҲиҖғеҢ–еӯҰиҖғйўҳпјҲеұұдёңзңҒеҫ·е·һеёӮеӨҸжҙҘеҺҝ第дёҖдёӯеӯҰпјү
- еј е®¶еҸЈеёӮй«ҳдәҢеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·иҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- зүЎдё№жұҹеёӮй«ҳдёүеҢ–еӯҰжңҲиҖғжөӢйӘҢпјҲ2019е№ҙдёҠжңҹпјүзҪ‘дёҠеңЁзәҝеҒҡйўҳ
- ж№–еҚ—зңҒй•ҝжІҷеёӮе‘ЁеҚ—дёӯеӯҰ2020-2021е№ҙй«ҳдәҢдёҠеӯҰжңҹ第дёүж¬ЎжңҲиҖғеҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- ж°‘ж—ҸеӨ§еӯҰйҷ„еұһдёӯеӯҰ2018е№ҙй«ҳдёҖеҢ–еӯҰдёҠеӯҰжңҹжңҹдёӯиҖғиҜ•еңЁзәҝе…Қиҙ№иҖғиҜ•
- й«ҳдәҢеҢ–еӯҰй«ҳиҖғжЁЎжӢҹпјҲ2019е№ҙдёҠжңҹпјүеёҰеҸӮиҖғзӯ”жЎҲдёҺи§Јжһҗ
- е№ҝдёңе№ҝе·һжө·зҸ еҢәдёӯеұұеӨ§еӯҰйҷ„еұһдёӯеӯҰ2020е№ҙй«ҳдәҢеҢ–еӯҰдёӢеӯҰжңҹжңҹдёӯиҖғиҜ•еңЁзәҝзӯ”йўҳ