2018й«ҳдёүдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
2011е№ҙ3жңҲ18ж—ҘиҮі19ж—ҘпјҢеҸ—вҖңеҗғзўҳзӣҗиғҪйҳІжӯўж ёиҫҗе°„вҖқзӯүи°ЈиЁҖзҡ„еҪұе“ҚпјҢжҲ‘еӣҪйғЁеҲҶең°еҢәеҮәзҺ°жҠўиҙӯйЈҹзӣҗзҺ°иұЎгҖӮе·ІзҹҘзўҳзӣҗзҡ„дё»иҰҒжҲҗеҲҶжҳҜKIO3е’ҢNaClпјҢKIO3дёҺNaHSO3еҸ‘з”ҹеҸҚеә”пјҡ В В В 2KIO3+6NaHSO3=2KI+3Na2SO4+3H2SO4пјҢдёӢеҲ—иҜҙжі•дёӯдёҚжӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В пјҲВ В В пјү В В В AпјҺKIO3дёӯIзҡ„еҢ–еҗҲд»·жҳҜ+5В В В В В В В В В В В В В В BпјҺKIO3е’ҢNaClйғҪжҳҜејәз”өи§ЈиҙЁ В В В CпјҺKIO3дҪңж°§еҢ–еүӮеҸ‘з”ҹиҝҳеҺҹеҸҚеә”В В В В В В В В В DпјҺ23Na37ClдёӯиҙЁеӯҗж•°е’Ңдёӯеӯҗж•°д№ӢжҜ”жҳҜ8:7 |
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁNAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢеҲҷдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В пјҲВ В В пјү AпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ2.24LSO3еҗ«жңүзҡ„еҲҶеӯҗж•°зӯүдәҺ0.1NA В В В BпјҺеёёжё©дёӢпјҢ1.0L 1.0 molВ·L-1NaAlO2жә¶ж¶Ідёӯеҗ«жңүзҡ„ж°§еҺҹеӯҗж•°дёә2NA В В В CпјҺ7.8 g Na2Sе’ҢNa2O2зҡ„ж··еҗҲзү©дёӯеҗ«жңүзҡ„йҳҙзҰ»еӯҗж•°зӯүдәҺ0.1NA В В В DпјҺ0.1 mol FeеҸӮеҠ ж°§еҢ–иҝҳеҺҹеҸҚеә”пјҢиҪ¬з§»зҡ„з”өеӯҗж•°зӣ®дёҖе®ҡжҳҜ0.2 NA |
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©дёӢпјҢеҫҖH2O2жә¶ж¶Ідёӯж»ҙеҠ е°‘йҮҸFeSO4жә¶ж¶ІпјҢеҸҜеҸ‘з”ҹеҰӮдёӢдёӨдёӘеҸҚеә”пјҡ2Fe2++H2O2+2H+пјқ2Fe3++2H2OпјҢ2Fe3++H2O2пјқ2Fe2++O2вҶ‘+2H+дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В (В В В В ) AпјҺH2O2зҡ„ж°§еҢ–жҖ§жҜ”Fe3+ејәпјҢе…¶иҝҳеҺҹжҖ§жҜ”Fe2+ејұ BпјҺеңЁH2O2еҲҶи§ЈиҝҮзЁӢдёӯпјҢжә¶ж¶Ізҡ„pHйҖҗжёҗдёӢйҷҚ CпјҺеңЁH2O2еҲҶи§ЈиҝҮзЁӢдёӯпјҢ Fe2+е’ҢFe3+зҡ„жҖ»йҮҸеҸ‘з”ҹеҸҳеҢ– DпјҺH2O2з”ҹдә§иҝҮзЁӢиҰҒдёҘж јйҒҝе…Қж··е…ҘFe2+ |
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
В еҗ«жңүa mol FeBr2зҡ„жә¶ж¶ІдёӯпјҢйҖҡе…Ҙx mol Cl2гҖӮдёӢеҲ—еҗ„йЎ№дёәйҖҡCl2иҝҮзЁӢдёӯпјҢжә¶ж¶ІеҶ…еҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҢе…¶дёӯдёҚжӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (В В В ) AпјҺxпјқ0.4aпјҢ2Fe2++Cl2пјқ2Fe3++2Cl-В В В В В В В В В В В В В В BпјҺxпјқ0.6aпјҢ2BrпјҚ+ Cl2пјқBr2+2ClпјҚ CпјҺx=aпјҢ2Fe2пјӢ+2BrпјҚ+2Cl2пјқBr2+2Fe3пјӢ+4ClпјҚВ DпјҺx=1.5aпјҢ2Fe2пјӢ+4BrпјҚ+3Cl2пјқ2Br2+2Fe3пјӢ+6ClпјҚ |
|
| 5. | иҜҰз»ҶдҝЎжҒҜ | ||||||
|
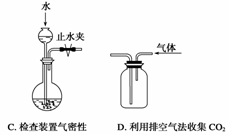
дёӢеҲ—иЈ…зҪ®жҲ–ж“ҚдҪңиғҪиҫҫеҲ°е®һйӘҢзӣ®зҡ„зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В ( В В В )
|
|||||||
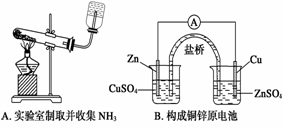
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
зӣ®еүҚеёӮеңәдёҠдё»жөҒжүӢжңәжүҖй…Қзҡ„з”өжұ еҹәжң¬дёҠйғҪжҳҜй”ӮзҰ»еӯҗз”өжұ гҖӮе®ғзҡ„иҙҹжһҒжқҗж–ҷжҳҜйҮ‘еұһй”Ӯе’Ңзўізҡ„еӨҚеҗҲжқҗж–ҷпјҢз»„жҲҗдёәC6LiпјҢе…¶дёӯзўідҪңдёәйҮ‘еұһй”Ӯзҡ„иҪҪдҪ“пјҢз”өи§ЈиҙЁдёәдёҖз§ҚиғҪдј еҜјLi+зҡ„жңүжңәеҜјдҪ“жҲ–й«ҳеҲҶеӯҗжқҗж–ҷгҖӮиҝҷз§Қй”ӮзҰ»еӯҗз”өжұ зҡ„з”өжұ еҸҚеә”ејҸдёәпјҡ0.45Li+Li0.55CoO2 В В В AпјҺж”ҫз”өж—¶з”өжұ еҶ…йғЁLi+еҗ‘иҙҹжһҒ移еҠЁ В В В BпјҺиҜҘз”өжұ дёҚиғҪйҖүз”Ёж°ҙеҒҡжә¶еүӮзҡ„з”өи§ЈиҙЁ В В В CпјҺж”ҫз”өж—¶пјҢжӯЈжһҒзҡ„з”өжһҒеҸҚеә”ејҸпјҡ0.45Li++Li0гҖӮ55CoO2+0.45e- В В В DпјҺе……з”өж—¶пјҢеӨ–жҺҘз”өжәҗзҡ„жӯЈжһҒдёҺз”өжұ дёҠж ҮжіЁвҖң+вҖқзҡ„з”өжһҒиҝһжҺҘ |
|
| 7. | иҜҰз»ҶдҝЎжҒҜ | ||||||||
|
е·ІзҹҘеңЁеёёжё©дёӢжөӢеҫ—жө“еәҰеқҮдёә0.1 molВ·L-1зҡ„дёӢеҲ—дёүз§Қжә¶ж¶Ізҡ„pHпјҡ
В В В дёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲВ В В пјү В В В AпјҺйҳізҰ»еӯҗзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰд№Ӣе’ҢпјҡNa2CO3>NaCN>NaHCO3 В В В BпјҺзӣёеҗҢжқЎд»¶дёӢзҡ„й…ёжҖ§пјҡH2CO3<HCN В В В CпјҺдёүз§Қжә¶ж¶ІдёӯеқҮеӯҳеңЁз”өзҰ»е№іиЎЎе’Ңж°ҙи§Је№іиЎЎ В В В DпјҺеҚҮй«ҳNa2CO3жә¶ж¶Ізҡ„жё©еәҰпјҢ |
|||||||||
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢж“ҚдҪңдјҡеҜјиҮҙе®һйӘҢз»“жһңеҒҸдҪҺзҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В пјҲВ В В пјү в‘ й…ҚеҲ¶100 g 10%зҡ„CuSO4жә¶ж¶ІпјҢз§°еҸ–10 g зЎ«й…ёй“ңжҷ¶дҪ“жә¶дәҺ90 gж°ҙдёӯВ в‘ЎжөӢе®ҡзўій…ёй’ жҷ¶дҪ“ дёӯз»“жҷ¶ж°ҙзҡ„зҷҫеҲҶеҗ«йҮҸж—¶пјҢжүҖз”Ёзҡ„жҷ¶дҪ“е·Із»ҸеҸ—жҪ®.в‘ўй…ҚеҲ¶дёҖе®ҡзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„жә¶ж¶Іж—¶пјҢиҚҜе“ҒдёҺз қ з Ғж”ҫеҸҚдәҶпјҢжёёз ҒиҜ»ж•°дёә0.2 gпјҢжүҖеҫ—жә¶ж¶Ізҡ„жө“еәҰ.в‘Јз”Ёй…ёејҸж»ҙе®ҡз®ЎйҮҸеҸ–з”Ё98%пјҢеҜҶеәҰдёә1.84 g/cm3 зҡ„жө“H2SO4й…ҚеҲ¶200mL 2 molВ·L-1зҡ„зЁҖH2SO4ж—¶пјҢе…Ҳе№іи§ҶеҗҺд»°и§ҶВ В В В В В В пјҲВ В пјү A.еҸӘжңүв‘ В В В В В В В В В В B.еҸӘжңүв‘ЎоҖ„В В В В В В В В В C.в‘Ўв‘ўв‘ЈВ В В В В В В В В D.в‘ в‘ўв‘Ј |
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘa gж°”дҪ“X2дёӯеҗ«жңүbдёӘXеҺҹеӯҗпјҢйӮЈд№Ҳc gиҜҘж°”дҪ“еңЁ0в„ғгҖҒ1.01Г—105 PaжқЎд»¶дёӢзҡ„дҪ“з§ҜжҳҜпјҲNAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјүВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (В В В ) A. |
|
| 10. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
дёӢеҲ—зҰ»еӯҗжҲ–еҲҶеӯҗз»„дёӯиғҪеӨ§йҮҸе…ұеӯҳпјҢдё”ж»Ўи¶ізӣёеә”иҰҒжұӮзҡ„жҳҜВ В В В В В В В В В В В пјҲВ В В пјү
|
||||||||||||||||
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘSO32пјҚпјӢI2пјӢH2O=SO42пјҚпјӢ2IпјҚпјӢ2HпјӢгҖӮжҹҗжә¶ж¶ІдёӯеҸҜиғҪеҗ«жңүIпјҚгҖҒNH4пјӢгҖҒCu2пјӢгҖҒSO32пјҚпјҢеҗ‘иҜҘж— иүІжә¶ж¶ІдёӯеҠ е…Ҙе°‘йҮҸжәҙж°ҙпјҢжә¶ж¶Ід»Қе‘Ҳж— иүІгҖӮеҲҷдёӢеҲ—е…ідәҺиҜҘжә¶ж¶Із»„жҲҗзҡ„еҲӨж–ӯжӯЈзЎ®зҡ„жҳҜ(В В В )В AпјҺиӮҜе®ҡдёҚеҗ«I-В В BпјҺиӮҜе®ҡдёҚеҗ«Cu2пјӢВ CпјҺеҸҜиғҪеҗ«жңүSO32пјҚ В В В DпјҺиӮҜе®ҡдёҚеҗ«жңүNH4пјӢ |
|
| 12. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
В 25В°Cж—¶пјҢеҮ з§Қејұй…ёжә¶ж¶Ізҡ„PHеҰӮдёӢиЎЁжүҖзӨәпјҡ
В В дёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲВ В пјү AпјҺзӣёеҗҢPHзҡ„CH3COOHдёҺHCNжә¶ж¶Ідёӯж°ҙз”өзҰ»зҡ„ж°ўзҰ»еӯҗжө“еәҰCH3COOHжә¶ж¶Ідёӯзҡ„еӨ§ BпјҺзү©иҙЁзҡ„йҮҸжө“еәҰзӣёеҗҢзҡ„CH3COONaдёҺNaCNжә¶ж¶ІдёӯпјҢеҗ„зҰ»еӯҗжө“еәҰд№Ӣе’ҢдёӨиҖ…зӣёзӯүгҖӮ CпјҺ25В°Cж—¶пјҢHCNжә¶ж¶Ізҡ„з”өзҰ»е№іиЎЎеёёж•°пјҲKaпјүдёҺNaCNжә¶ж¶Ізҡ„ж°ҙи§Је№іиЎЎеёёж•°пјҲKпјүеӯҳеңЁ еҰӮдёӢе…ізі»пјҡKa В·K = Kw DпјҺ0.01mol/Lзҡ„Na2SO3жә¶ж¶ІдёҺ0.01mol/Lзҡ„CH3COONaжә¶ж¶ІзӣёжҜ”пјҢдёҖе®ҡжҳҜеҗҺиҖ…зҡ„зўұжҖ§ејә |
|||||||||||||
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
В 25 в„ғпјҢ101 k Paж—¶пјҢејәй…ёдёҺејәзўұзҡ„зЁҖжә¶ж¶ІеҸ‘з”ҹдёӯе’ҢеҸҚеә”зҡ„дёӯе’Ңзғӯдёә57.3 kJ/molпјҢиҫӣзғ·зҡ„зҮғзғ§зғӯдёә5518 kJ/molгҖӮдёӢеҲ—зғӯеҢ–еӯҰж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В (В В В ) AпјҺ2H+(aq)+SO42пјҚ(aq)+Ba2пјӢ(aq)+2OH-(aq)=BaSO4(s)+2H2O(1)В в–іH= BпјҺKOH(aq)+ CпјҺC8H18(I)+ DпјҺ2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1)В в–іH= |
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘m gй•Ғе’Ңй“қзҡ„ж··еҗҲзү©дёӯеҠ е…ҘйҖӮйҮҸзҡ„зЁҖзЎ«й…ёпјҢжҒ°еҘҪе®Ңе…ЁеҸҚеә”з”ҹжҲҗж ҮеҮҶзҠ¶еҶөдёӢзҡ„ж°”дҪ“b LгҖӮеҗ‘еҸҚеә”еҗҺзҡ„жә¶ж¶ІдёӯеҠ е…Ҙc mol/Lж°ўж°§еҢ–й’ҫжә¶ж¶ІV mLпјҢдҪҝйҮ‘еұһзҰ»еӯҗеҲҡеҘҪжІүж·Җе®Ңе…ЁпјҢеҫ—еҲ°зҡ„жІүж·ҖиҙЁйҮҸдёәn gгҖӮеҶҚе°Ҷеҫ—еҲ°зҡ„жІүж·ҖзҒјзғ§иҮіиҙЁйҮҸдёҚеҶҚж”№еҸҳдёәжӯўпјҢеҫ—еҲ°еӣәдҪ“p gгҖӮеҲҷдёӢеҲ—е…ізі»дёҚжӯЈзЎ®зҡ„жҳҜ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (В В В ) AпјҺ |
|
| 15. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||||||
|
еҚ•жҷ¶зЎ…жҳҜдҝЎжҒҜдә§дёҡдёӯйҮҚиҰҒзҡ„еҹәзЎҖжқҗж–ҷгҖӮйҖҡеёёз”ЁзӮӯеңЁй«ҳжё©дёӢиҝҳеҺҹдәҢж°§еҢ–зЎ…еҲ¶еҫ—зІ—зЎ…(еҗ«й“ҒгҖҒй“қгҖҒзЎјгҖҒзЈ·зӯүжқӮиҙЁ)пјҢзІ—зЎ…дёҺж°Ҝж°”еҸҚеә”з”ҹжҲҗеӣӣж°ҜеҢ–зЎ…пјҲеҸҚеә”жё©еәҰ450~500в„ғпјүпјҢеӣӣж°ҜеҢ–зЎ…з»ҸжҸҗзәҜеҗҺз”Ёж°ўж°”иҝҳеҺҹеҸҜеҫ—й«ҳзәҜзЎ…гҖӮд»ҘдёӢжҳҜе®һйӘҢе®ӨеҲ¶еӨҮеӣӣж°ҜеҢ–зЎ…зҡ„иЈ…зҪ®зӨәж„ҸеӣҫгҖӮ
зӣёе…ідҝЎжҒҜеҰӮдёӢпјҡ в‘ еӣӣж°ҜеҢ–зЎ…йҒҮж°ҙжһҒжҳ“ж°ҙи§Јпјӣ в‘ЎзЎјгҖҒй“қгҖҒй“ҒгҖҒзЈ·еңЁй«ҳжё©дёӢеқҮиғҪдёҺж°Ҝж°”зӣҙжҺҘеҸҚеә”з”ҹжҲҗзӣёеә”зҡ„ж°ҜеҢ–зү©пјӣ в‘ўжңүе…ізү©иҙЁзҡ„зү©зҗҶеёёж•°и§ҒдёӢиЎЁпјҡ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүеҶҷеҮәиЈ…зҪ®AдёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ2пјүиЈ…зҪ®Aдёӯgз®Ўзҡ„дҪңз”ЁжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В пјӣиЈ…зҪ®Cдёӯзҡ„иҜ•еүӮжҳҜВ В В В В В В В пјӣ иЈ…зҪ®Eдёӯзҡ„h瓶йңҖиҰҒеҶ·еҚҙзҡ„зҗҶз”ұжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ3пјүиЈ…зҪ®Eдёӯh瓶收йӣҶеҲ°зҡ„зІ—дә§зү©еҸҜйҖҡиҝҮзІҫйҰҸпјҲзұ»дјјеӨҡж¬Ўи’ёйҰҸпјүеҫ—еҲ°й«ҳзәҜеәҰеӣӣж°ҜеҢ–зЎ…пјҢзІҫйҰҸеҗҺзҡ„ж®Ӣз•ҷзү©дёӯпјҢйҷӨй“Ғе…ғзҙ еӨ–еҸҜиғҪиҝҳеҗ«жңүзҡ„жқӮиҙЁе…ғзҙ жҳҜВ В В В В В В В В В В В В В В В В пјҲеЎ«еҶҷе…ғзҙ з¬ҰеҸ·пјүгҖӮ пјҲ4пјүдёәдәҶеҲҶжһҗж®Ӣз•ҷзү©дёӯй“Ғе…ғзҙ зҡ„еҗ«йҮҸпјҢе…Ҳе°Ҷж®Ӣз•ҷзү©йў„еӨ„зҗҶпјҢдҪҝй“Ғе…ғзҙ иҝҳеҺҹжҲҗFe2пјӢ,еҶҚз”ЁKMnO4ж ҮеҮҶжә¶ж¶ІеңЁй…ёжҖ§жқЎд»¶дёӢиҝӣиЎҢж°§еҢ–иҝҳеҺҹж»ҙе®ҡпјҢеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜпјҡ 5Fe2пјӢпјӢMnO4пјҚпјӢ8HпјӢ в‘ ж»ҙе®ҡеүҚжҳҜеҗҰиҰҒж»ҙеҠ жҢҮзӨәеүӮпјҹВ В В В пјҲеЎ«вҖңжҳҜвҖқжҲ–вҖңеҗҰвҖқпјүпјҢиҜ·иҜҙжҳҺзҗҶз”ұВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘ЎжҹҗеҗҢеӯҰз§°еҸ–5.000gж®Ӣз•ҷзү©еҗҺпјҢз»Ҹйў„еӨ„зҗҶеҗҺеңЁе®№йҮҸ瓶дёӯй…ҚеҲ¶жҲҗ100 mLжә¶ж¶ІпјҢ移еҸ–25.00 mLиҜ•ж ·жә¶ж¶ІпјҢз”Ё1.000Г—10пјҚ2 mol/L KMnO4ж ҮеҮҶжә¶ж¶Іж»ҙе®ҡгҖӮиҫҫеҲ°ж»ҙе®ҡз»ҲзӮ№ж—¶пјҢж¶ҲиҖ—ж ҮеҮҶжә¶ж¶І20.00 mLпјҢеҲҷж®Ӣз•ҷзү©дёӯй“Ғе…ғзҙ зҡ„иҙЁйҮҸеҲҶж•°жҳҜВ В В В В В В В В В гҖӮ |
|||||||||||||||||||||||||
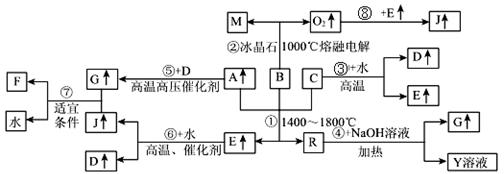
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеӣҫж¶үеҸҠеӨҡз§Қж— жңәеҢ–е·ҘеҸҚеә”пјҢжүҖж¶үеҸҠзү©иҙЁйғҪжҳҜз”ұзҹӯе‘Ёжңҹе…ғзҙ з»„жҲҗпјҢе…¶дёӯRжҳҜдёҖз§Қж–°еһӢж— жңәжқҗж–ҷпјҢпјӯжҳҜдёҖз§Қеә”з”Ёе№ҝжіӣзҡ„йҮ‘еұһжқҗж–ҷпјҢFжҳҜдәәе·ҘеҗҲжҲҗзҡ„第дёҖз§Қжңүжңәзү©пјҢдё”жҳҜдёҖз§Қеёёи§Ғзҡ„еҢ–иӮҘжқҗж–ҷпјҢAгҖҒCгҖҒDгҖҒMеқҮдёәеёёи§Ғе…ғзҙ зҡ„еҚ•иҙЁпјҢвҖңвҶ‘вҖқиЎЁзӨәиҜҘзү©иҙЁеёёжё©дёӢжҳҜж°”дҪ“пјҢеҸҚеә”G+JвҶ’F+H2Oдёӯпј§дёҺJзҡ„жңҖдҪій…ҚжҜ”дёә2:1пјҢеҗ‘Yжә¶ж¶ІдёӯйҖҡе…Ҙи¶ійҮҸзҡ„пјӘж°”дҪ“ж—¶еҸҜеҫ—еҲ°дёҖз§ҚзҷҪиүІиғ¶зҠ¶жІүж·ҖпјҢе°ҶиҜҘзҷҪиүІиғ¶зҠ¶жІүж·Җж»ӨеҮәжҙ—еҮҖеҗҺеҠ зғӯеҲҶи§ЈеҸҜд»Ҙеҫ—еҲ°пјўгҖӮ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүеҶҷеҮәBеҢ–еӯҰејҸВ В В В В В В В В В пјҢFеҢ–еӯҰејҸпјҡВ В В В В В В В В В В В пјӣGзҡ„з©әй—ҙжһ„еһӢВ В В В В В В В В В В В В гҖӮ пјҲ2пјүеҸҚеә”в‘ зҡ„еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲ3пјүеҸҚеә”в‘Јзҡ„зҰ»еӯҗж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲ4пјүдёҠиҝ°еҸҚеә”дёӯеұһдәҺйқһж°§еҢ–иҝҳеҺҹеҸҚеә”зҡ„жңүВ В В В В В В В В В В В В пјҲеЎ«еҶҷзӣёеә”еҸҚеә”зҡ„еәҸеҸ·пјү пјҲ5пјүYжә¶ж¶Іе‘ҲВ В В В В В В В жҖ§пјҲеЎ«й…ёгҖҒзўұжҲ–дёӯпјүпјҢз”ЁзҰ»еӯҗж–№зЁӢејҸи§ЈйҮҠВ В В В В В В В В В В В В В В В В В В В В В |
|
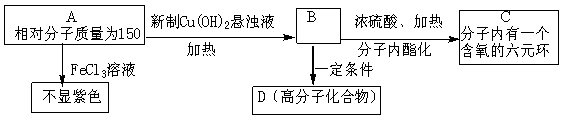
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
AдёәиҠійҰҷзғғиЎҚз”ҹзү©пјҢеҸӘеҗ«CгҖҒHгҖҒOдёүз§Қе…ғзҙ пјҢиӢҜзҺҜдёҠжңүдёӨдёӘеӨ„дәҺйӮ»дҪҚзҡ„еҸ–д»ЈеҹәгҖӮ
пјҲ1пјүBеҲҶеӯҗдёӯеҗ«ж°§е®ҳиғҪеӣўзҡ„еҗҚз§°жҳҜВ В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ2пјүеҶҷеҮәз¬ҰеҗҲдёҠиҝ°жқЎд»¶зҡ„Aзҡ„дёӨз§ҚеҸҜиғҪзҡ„з»“жһ„з®ҖејҸпјҡВ В В В В В В В В В В В В В пјӣВ В В В В В В В В В В В В В гҖӮ пјҲ3пјүзӯүйҮҸзҡ„BеҲҶеҲ«дёҺNaпјҢNaOHпјҢNa2CO3еҸҚеә”ж—¶пјҢж¶ҲиҖ—дёүиҖ…зү©иҙЁзҡ„йҮҸд№ӢжҜ”жҳҜВ В В В В В В В гҖӮ пјҲ4пјүз¬ҰеҗҲдёҠиҝ°жқЎд»¶зҡ„AпјҢе…¶дёӯдёҖз§ҚиҝҳеҸҜеҸ‘з”ҹеҰӮдёӢеҸҳеҢ–пјҡ
в‘ AвҶ’ Fзҡ„еҸҚеә”зұ»еһӢдёәВ В В В В В В В В В В гҖӮ в‘ЎеҶҷеҮәжңүе…іеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ жӯӨAдёҺж–°еҲ¶Cu(OH)2жӮ¬жөҠж¶Ізҡ„еҸҚеә”пјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ жӯӨAеҜ№еә”зҡ„Bз”ҹжҲҗCзҡ„еҸҚеә”пјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ |
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
pCзұ»дјјpHпјҢжҳҜжҢҮжһҒзЁҖжә¶ж¶Ідёӯ,жә¶иҙЁзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„еёёз”ЁеҜ№ж•°иҙҹеҖјгҖӮеҰӮжҹҗжә¶ж¶Іжә¶иҙЁзҡ„жө“еәҰдёәпјҡ1Г—10-3mol/LпјҢеҲҷиҜҘжә¶ж¶Ідёӯжә¶иҙЁзҡ„pC=-lg1Г—10-3=3гҖӮдёӢеӣҫдёәпјҢH2CO3еңЁеҠ е…Ҙејәй…ёжҲ–ејәзўұжә¶ж¶ІеҗҺпјҢе№іиЎЎж—¶жә¶ж¶Ідёӯдёүз§ҚжҲҗеҲҶзҡ„pCвҖ”pHеӣҫгҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
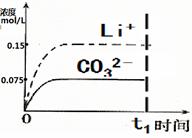
пјҲ1пјүеңЁдәәдҪ“иЎҖж¶ІдёӯпјҢHCO3-иғҪиө·еҲ°зЁіе®ҡдәәдҪ“PHзҡ„дҪңз”Ё,иҜ·з”Ёз”өи§ЈиҙЁжә¶ж¶Ідёӯзҡ„е№іиЎЎи§ЈйҮҠпјҡ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲз”Ёж–№зЁӢејҸиЎЁзӨәпјүгҖӮ пјҲ2пјүH2CO3дёҖзә§з”өзҰ»е№іиЎЎеёёж•°зҡ„ж•°еҖјKa1 пјҲ3пјүжҹҗеҗҢеӯҰи®ӨдёәиҜҘжә¶ж¶ІдёӯNa2CO3зҡ„ж°ҙи§ЈжҳҜеҫ®ејұзҡ„пјҢеҸ‘з”ҹж°ҙи§Јзҡ„CO32-зҰ»еӯҗдёҚи¶…иҝҮе…¶жҖ»йҮҸзҡ„10пј…гҖӮиҜ·дҪ и®ҫи®Ўз®ҖеҚ•е®һйӘҢиҜҒжҳҺиҜҘеҗҢеӯҰзҡ„и§ӮзӮ№жҳҜеҗҰжӯЈзЎ®В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ4пјүе·ІзҹҘжҹҗжё©еәҰдёӢLi2CO3зҡ„Kspдёә1.68Г—10-3пјҢе°ҶйҖӮйҮҸLi2CO3еӣәдҪ“жә¶дәҺ100 mLж°ҙдёӯиҮіеҲҡеҘҪйҘұе’ҢпјҢйҘұе’ҢLi2CO3жә¶ж¶Ідёӯc(Li+)пјқ0.15 molВ·L-1гҖӮc(CO32-)пјқ0.075 molВ·L-1пјҢиӢҘt1ж—¶еҲ»еңЁдёҠиҝ°дҪ“зі»дёӯеҠ е…Ҙ100 mL0.125 molВ·L-1 Na2CO3 жә¶ж¶ІпјҢеҲ—ејҸи®Ўз®—иҜҙжҳҺжҳҜеҗҰжңүжІүж·Җдә§з”ҹгҖӮ пјҲ5пјүиҜ·з”»еҮәt1ж—¶еҲ»еҗҺLi+е’ҢCO32пјҚжө“еәҰйҡҸж—¶й—ҙеҸҳеҢ–е…ізі»еӣҫпјҲз”ЁиҷҡзәҝиЎЁзӨәLi+ ,е®һзәҝиЎЁзӨәCO32пјҚпјүгҖӮ |
|
| 19. | иҜҰз»ҶдҝЎжҒҜ | |||||||||
|
иҝҮж°§еҢ–ж°ўжҳҜйҮҚиҰҒзҡ„ж°§еҢ–еүӮгҖҒиҝҳеҺҹеүӮпјҢе®ғзҡ„ж°ҙжә¶ж¶ІеҸҲз§°дёәеҸҢж°§ж°ҙпјҢеёёз”ЁдҪңж¶ҲжҜ’гҖҒжқҖиҸҢгҖҒжјӮзҷҪзӯүгҖӮжҹҗеҢ–еӯҰе…ҙи¶Је°Ҹз»„еҸ–дёҖе®ҡйҮҸзҡ„иҝҮж°§еҢ–ж°ўжә¶ж¶ІпјҢеҮҶзЎ®жөӢе®ҡдәҶиҝҮж°§еҢ–ж°ўзҡ„еҗ«йҮҸпјҢ并жҺўз©¶дәҶиҝҮж°§еҢ–ж°ўзҡ„жҖ§иҙЁгҖӮ в… пјҺжөӢе®ҡиҝҮж°§еҢ–зҡ„еҗ«йҮҸ иҜ·еЎ«еҶҷдёӢеҲ—з©әзҷҪпјҡ пјҲ1пјү移еҸ–10.00 mеҜҶеәҰдёәПҒ g/mLзҡ„иҝҮж°§еҢ–ж°ўжә¶ж¶ІиҮі250mLВ В В В В В В пјҲеЎ«д»ӘеҷЁеҗҚз§°пјүдёӯпјҢеҠ ж°ҙзЁҖйҮҠиҮіеҲ»еәҰпјҢж‘ҮеҢҖгҖӮ移еҸ–зЁҖйҮҠеҗҺзҡ„иҝҮж°§еҢ–ж°ўжә¶ж¶І25.00mLиҮій”ҘеҪўз“¶дёӯпјҢеҠ е…ҘзЁҖзЎ«й…ёй…ёеҢ–пјҢз”Ёи’ёйҰҸж°ҙзЁҖйҮҠпјҢдҪңиў«жөӢиҜ•ж ·гҖӮ пјҲ2пјүз”Ёй«ҳй”°й…ёй’ҫж ҮеҮҶжә¶ж¶Іж»ҙе®ҡиў«жөӢиҜ•ж ·пјҢе…¶еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸеҰӮдёӢпјҢиҜ·е°Ҷзӣёе…ізү©иҙЁзҡ„еҢ–еӯҰи®ЎйҮҸж•°еҸҠеҢ–еӯҰејҸеЎ«еҶҷеңЁж–№жЎҶйҮҢгҖӮ
пјҲ3пјүж»ҙе®ҡж—¶пјҢе°Ҷй«ҳй”°й…ёй’ҫж ҮеҮҶжә¶ж¶ІжіЁе…ҘВ В В В В В В В пјҲеЎ«вҖңй…ёејҸвҖқжҲ–вҖңзўұејҸвҖқпјүж»ҙе®ҡз®ЎдёӯгҖӮж»ҙе®ҡеҲ°иҫҫз»ҲзӮ№зҡ„зҺ°иұЎжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ4пјүеӨҚж»ҙе®ҡдёүж¬ЎпјҢе№іеқҮиҖ—з”Ёc mol/L KMnO4ж ҮеҮҶжә¶ж¶ІV mLпјҢеҲҷеҺҹиҝҮж°§еҢ–ж°ўжә¶ж¶ІдёӯиҝҮж°§еҢ–ж°ўзҡ„иҙЁйҮҸеҲҶж•°дёәВ В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ5пјүиӢҘж»ҙе®ҡеүҚж»ҙе®ҡз®Ўе°–еҳҙдёӯжңүж°”жіЎпјҢж»ҙе®ҡеҗҺж°”жіЎж¶ҲеӨұпјҢеҲҷжөӢе®ҡз»“жһңВ В В В В В В В В пјҲеЎ«вҖңеҒҸй«ҳвҖқжҲ–вҖңеҒҸдҪҺвҖқжҲ–вҖңдёҚеҸҳвҖқпјүгҖӮ в…ЎпјҺжҺўз©¶иҝҮж°§еҢ–ж°ўзҡ„жҖ§иҙЁ иҜҘеҢ–еӯҰдёҫе°Ҹз»„ж №жҚ®жүҖжҸҗдҫӣзҡ„е®һйӘҢжқЎд»¶и®ҫи®ЎдәҶдёӨдёӘе®һйӘҢпјҢеҲҶеҲ«иҜҒжҳҺдәҶиҝҮж°§еҢ–ж°ўзҡ„ж°§еҢ–жҖ§е’ҢдёҚзЁіе®ҡжҖ§гҖӮпјҲе®һйӘҢжқЎд»¶пјҡиҜ•еүӮеҸӘжңүиҝҮж°§еҢ–ж°ўжә¶ж¶ІгҖҒж°Ҝж°ҙгҖҒзўҳеҢ–й’ҫжј”зІүжә¶ж¶ІгҖҒйҘұе’ҢзЎ«еҢ–ж°ўжә¶ж¶ІпјҢе®һйӘҢд»ӘеҷЁеҸҠз”Ёе“ҒеҸҜиҮӘйҖүгҖӮпјү иҜ·е°Ҷ他们зҡ„е®һйӘҢж–№жі•е’Ңе®һйӘҢзҺ°иұЎеЎ«е…ҘдёӢиЎЁпјҡ
|
||||||||||
- иҫҪе®Ғ2019е№ҙй«ҳдёүдёҠеҚҠжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•ж— зәёиҜ•еҚ·
- й«ҳдёүеҢ–еӯҰдёҠеҶҢдё“йўҳз»ғд№ е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- жІіеҢ—зңҒеј е®¶еҸЈеёӮеј еһЈиҒ”зӣҹ2020-2021е№ҙй«ҳдәҢдёҠеҶҢйҳ¶ж®өжЈҖжөӢеҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·
- 2019-2020е№ҙй«ҳдёҖдёӢеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰпјҲжұҹиӢҸзңҒжұҹйҳҙеёӮдәҢдёӯгҖҒиҰҒеЎһдёӯеӯҰзӯүеӣӣж Ўпјү
- 2018-2019е№ҙй«ҳдёҖеүҚеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·пјҲиҘҝи—ҸиҮӘжІ»еҢәеұұеҚ—еёӮ第дәҢй«ҳзә§дёӯеӯҰпјү
- еұұдёңзңҒж·„еҚҡеёӮ2020еұҠй«ҳдёү第дёҖж¬ЎжЁЎжӢҹеҢ–еӯҰдё“йўҳи®ӯз»ғ
- 2019-2020е№ҙй«ҳдәҢдёӢеҚҠе№ҙ6жңҲжңҲиҖғеҢ–еӯҰеңЁзәҝиҖғиҜ•йўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲе®үеҫҪзңҒиҡҢеҹ 第дёүдёӯеӯҰпјү
- еӨ§еәҶеёӮ2018е№ҙй«ҳдәҢдёҠжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•зҪ‘з»ңиҖғиҜ•иҜ•еҚ·