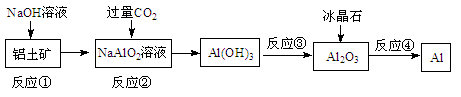
2018жІіеҢ—й«ҳдёҖдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—з”ҹжҙ»дёӯеёёи§Ғзү©иҙЁзҡ„дҝ—еҗҚдёҺеҢ–еӯҰејҸзӣёеҜ№еә”зҡ„жҳҜпјҲВ В В В пјү A. з”ҹзҹізҒ°вҖ”Ca(OH)2В B. йҮҚжҷ¶зҹівҖ”BaCO3В В C. жҳҺзҹҫвҖ”CuSO4В·5H2OВ В D. е°ҸиӢҸжү“вҖ”NaHCO3
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
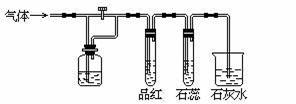
з”ЁдёӢеҲ—е®һйӘҢиЈ…зҪ®иҝӣиЎҢзӣёеә”е®һйӘҢпјҢиғҪиҫҫеҲ°е®һйӘҢзӣ®зҡ„жҳҜпјҲ гҖҖгҖҖпјү A. з”ЁеӣҫжүҖзӨәиЈ…зҪ®йҷӨеҺ»Cl2дёӯеҗ«жңүзҡ„е°‘йҮҸHClВ В B. з”ЁеӣҫжүҖзӨәиЈ…зҪ®и’ёе№ІNaHCO3жә¶ж¶ІеҲ¶еӨҮNaHCO3жҷ¶дҪ“ C. з”ЁеӣҫжүҖзӨәиЈ…зҪ®еҲ¶еҸ–е°‘йҮҸзәҜеҮҖзҡ„CO2ж°”дҪ“В В В D. з”ЁеӣҫжүҖзӨәиЈ…зҪ®еҲҶзҰ»CCl4иҗғеҸ–зўҳж°ҙеҗҺзҡ„ж¶ІжҖҒж··еҗҲзү©
AВ В В В В В В В В В BВ В В В В В В В В В В В В CВ В В В В В В В В В В В В В В В D A. AВ В В В В В В B. BВ В В В В В В C. CВ В В В В В В D. D
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү A. ж ҮеҮҶзҠ¶еҶөдёӢпјҢ11.2LSO2ж°”дҪ“дёӯеҗ«ж°§еҺҹеӯҗж•°зӯүдәҺ18gж°ҙдёӯеҗ«жңүзҡ„ж°§еҺҹеӯҗж•° B. 5.6 gй“ҒдёҺи¶ійҮҸзЁҖзЎ«й…ёеҸҚеә”еӨұеҺ»зҡ„з”өеӯҗзҡ„зү©иҙЁзҡ„йҮҸдёә0.3 mol C. 100g98%зҡ„жө“зЎ«й…ёжүҖеҗ«зҡ„ж°§еҺҹеӯҗдёӘж•°дёә4mol D. 20gNaOHжә¶дәҺ1Lж°ҙпјҢжүҖеҫ—жә¶ж¶Ідёӯc(Na+)=0.5mol/L
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—йҷӨжқӮиҝҮзЁӢдёӯпјҢжүҖйҖүз”Ёзҡ„иҜ•еүӮжҲ–ж–№жі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү A. Fe2O3еӣәдҪ“дёӯж··жңүA12O3:еҠ е…Ҙи¶ійҮҸзҡ„зӣҗй…ёпјҢиҝҮж»Ө B. SO2ж°”дҪ“дёӯж··жңүHC1:йҖҡиҝҮйҘұе’ҢдәҡзЎ«й…ёж°ўй’ жә¶ж¶І C. FeCl2жә¶ж¶Ідёӯж··жңүFeCl3:еҠ е…ҘиҝҮйҮҸзҡ„й“ҒзІүпјҢиҝҮж»Ө D. KNO3еӣәдҪ“дёӯж··жңүе°‘йҮҸзҡ„NaCl:зғӯж°ҙжә¶и§ЈгҖҒйҷҚжё©з»“жҷ¶гҖҒиҝҮж»Ө
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
е°ҶAlCl3гҖҒMgCl2гҖҒMgSO4гҖҒAl2пјҲSO4пјү3жә¶дәҺж°ҙпјҢж··еҗҲжә¶ж¶ІдёӯcпјҲAl3пјӢпјүпјқ0.1molВ·LпјҚ1гҖҒcпјҲMg2пјӢпјүпјқ0.25molВ·LпјҚ1гҖҒcпјҲClпјҚпјүпјқ0.2molВ·LпјҚ1пјҢеҲҷиҜҘжә¶ж¶ІдёӯcпјҲSO42пјҚпјүдёәпјҲВ В гҖҖпјү A. 0.15molВ·LпјҚ1В В В В B. 0.20molВ·LпјҚ1В В В C. 0.25molВ·LпјҚ1В В В D. 0.30molВ·LпјҚ1
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺй…ҚеҲ¶дёҖе®ҡзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„жә¶ж¶ІиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү A. е°ҶNaClеӣәдҪ“зҪ®дәҺжүҳзӣҳеӨ©е№іеҸізӣҳз§°йҮҸпјҡе·Ұзӣҳз қз ҒпјҲ8gпјүе’Ңжёёз ҒпјҲ0пјҺ6gпјүиҜ»ж•°зҡ„е’Ңдёә8пјҺ6g B. е®№йҮҸ瓶дёҠж ҮжңүеҲ»еәҰзәҝгҖҒжё©еәҰе’Ңжө“еәҰпјҢдҪҝз”ЁеүҚиҰҒдәӢе…ҲжЈҖжҹҘжҳҜеҗҰжјҸж°ҙ C. й…ҚеҲ¶дёҖе®ҡзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„жә¶ж¶Із”ЁеҲ°зҡ„дё»иҰҒд»ӘеҷЁжңүпјҡжүҳзӣҳеӨ©е№ігҖҒйҮҸзӯ’гҖҒзғ§жқҜгҖҒзҺ»з’ғжЈ’гҖҒе®№йҮҸ瓶гҖҒиғ¶еӨҙж»ҙз®ЎгҖӮ D. й…ҚеҲ¶1L0.2mol/Lзҡ„H2SO4 жә¶ж¶ІпјҢе®ҡе®№ж—¶д»°и§ҶеҲ»еәҰзәҝж“ҚдҪңпјҢеҲҷй…ҚеҮәжө“еәҰеҒҸй«ҳ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зҰ»еӯҗеңЁжҢҮе®ҡжә¶ж¶ІдёӯдёҖе®ҡиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜпјҲгҖҖ гҖҖпјү A. иғҪдҪҝй…ҡй…һиҜ•ж¶ІеҸҳзәўзҡ„жә¶ж¶ІдёӯпјҡH+гҖҒSO42п№ЈгҖҒNa+гҖҒNO3п№Ј B. еҠ е…ҘAlиғҪж”ҫеҮәж°ўж°”зҡ„жә¶ж¶ІдёӯпјҡNH4+гҖҒSO42п№ЈгҖҒMg2+гҖҒHCO3п№Ј C. еҗ«жңүеӨ§йҮҸCl2зҡ„жә¶ж¶ІдёӯпјҡBa2+гҖҒK+гҖҒNO3п№ЈгҖҒIп№Ј D. ејәй…ёжҖ§зҡ„жә¶ж¶ІдёӯпјҡCu2+гҖҒBrп№ЈгҖҒCa2+гҖҒClп№Ј
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
зҒ«жі•зӮјй“ңйҰ–е…ҲиҰҒз„ҷзғ§й»„й“ңзҹҝпјҢе…¶еҸҚеә”дёәпјҡ2CuFeS2+O2 A. SO2д»…дёәж°§еҢ–дә§зү©В В В В В В В В В В В В В В В В В В В В B. CuFeS2д»…дҪңиҝҳеҺҹеүӮпјҢзЎ«е…ғзҙ иў«ж°§еҢ– C. жҜҸиҪ¬з§»6molз”өеӯҗпјҢжңү1molзЎ«иў«ж°§еҢ–В В В D. жҜҸз”ҹжҲҗ0.5molCu2SпјҢжңү2molзЎ«иў«ж°§еҢ–
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҲ¶еҸ–еҚ•иҙЁзҡ„еҸҚеә”дёӯпјҢеҢ–еҗҲзү©дҪңиҝҳеҺҹеүӮзҡ„жҳҜпјҲгҖҖгҖҖпјү A. з”Ёй“қе’Ңж°§еҢ–й“ҒеңЁй«ҳжё©дёӢеҸҚеә”еҲ¶еҸ–й“ҒВ В В В В B. з”Ёжәҙе’ҢзўҳеҢ–й’ҫжә¶ж¶ІеҸҚеә”еҲ¶еҸ–зўҳ C. з”Ёзўіе’Ңй«ҳжё©ж°ҙи’ёжұҪеҸҚеә”еҲ¶еҸ–ж°ўж°”В В В В В В В D. з”Ёж°ўж°”е’ҢзҒјзғӯзҡ„ж°§еҢ–й“ңеҸҚеә”еҲ¶еҸ–й“ң
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
еҸӘз”ЁдёҖз§ҚиҜ•еүӮеҸҜеҢәеҲ«Na2SO4 гҖҒMgCl2 гҖҒFeCl2 гҖҒAl2(SO4)3 гҖҒ(NH4)2SO4 дә”з§Қжә¶ж¶ІпјҢиҝҷз§ҚиҜ•еүӮжҳҜ (В В В В В ) A. Ba(OH)2В В В В В B. H2SO4В В В В В C. NaOHВ В В В В D. AgNO3
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жЈҖйӘҢзҰ»еӯҗзҡ„ж–№жі•еҸҠзҺ°иұЎжҸҸиҝ°жӯЈзЎ®зҡ„жҳҜ ( гҖҖгҖҖ) A. жЈҖйӘҢNaпјӢпјҡе°Ҷе№ІеҮҖзҡ„й“ӮдёқиҳёеҸ–е°‘йҮҸжә¶ж¶ІеңЁй…’зІҫзҒҜдёҠзҒјзғ§пјҢи§ӮеҜҹзҒ«з„°е‘Ҳжө…зҙ«иүІ B. жЈҖйӘҢNH4+пјҡж»ҙе…ҘNaOHжә¶ж¶ІеҗҺпјҢеҠ зғӯпјҢз”Ёж№ҝж¶ҰзәўиүІзҹіи•ҠиҜ•зәёжЈҖйӘҢеҸ‘зҺ°еҸҳи“қ C. жЈҖйӘҢSO42п№ЈпјҡеҠ е…ҘBaCl2жә¶ж¶ІеҮәзҺ°зҷҪиүІжІүж·ҖпјҢеҶҚеҠ и¶ійҮҸзЁҖзӣҗй…ёжІүж·ҖдёҚжә¶и§Ј D. жЈҖйӘҢClпјҚпјҡзЎ®е®ҡжә¶ж¶ІдёӯSO42п№Јж— еҗҺпјҢеҠ е…ҘAgNO3жә¶ж¶ІеҮәзҺ°зҷҪиүІжІүж·Җ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
дёӢеҲ—е®һйӘҢзҺ°иұЎдёҺеҜ№еә”з»“и®әеқҮжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү
|
|||||||||||||||||||||
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҺдёӢеҲ—зү©иҙЁйғҪе…·жңүжјӮзҷҪдҪңз”ЁпјҢе…¶дёӯжјӮзҷҪеҺҹзҗҶжІЎжңүеҲ©з”Ёзү©иҙЁеҢ–еӯҰжҖ§иҙЁзҡ„жҳҜ(гҖҖ гҖҖ) A. иҝҮж°§еҢ–й’ В В В B. дәҢж°§еҢ–зЎ«В В В C. еҸҢж°§ж°ҙВ В В D. жҙ»жҖ§зӮӯ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іиҜ•еүӮзҡ„дҝқеӯҳж–№жі•пјҢжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү A. жө“зЎқй…ёдҝқеӯҳеңЁж— иүІзҺ»з’ғиҜ•еүӮ瓶дёӯB. ж°ўж°§еҢ–й’ жә¶ж¶ІдҝқеӯҳеңЁе…·зЈЁеҸЈзҺ»з’ғеЎһзҡ„иҜ•еүӮ瓶дёӯ C. е°‘йҮҸзҡ„й’ дҝқеӯҳеңЁж°ҙдёӯВ В В В В В В В В D. FeSO4жә¶ж¶Іеӯҳж”ҫеңЁеҠ жңүе°‘йҮҸй“ҒзІүзҡ„иҜ•еүӮ瓶дёӯ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
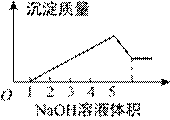
еңЁжҹҗж— иүІжә¶ж¶Ідёӯзј“ж…ўең°ж»ҙе…ҘNaOHжә¶ж¶ІзӣҙиҮіиҝҮйҮҸпјҢдә§з”ҹжІүж·Җзҡ„иҙЁйҮҸдёҺеҠ е…Ҙзҡ„NaOHжә¶ж¶ІдҪ“з§Ҝзҡ„е…ізі»еҰӮеӣҫжүҖзӨәпјҢз”ұжӯӨзЎ®е®ҡпјҢеҺҹжә¶ж¶Ідёӯеҗ«жңүзҡ„йҳізҰ»еӯҗжҳҜпјҲВ В В В пјү
A. Mg2+гҖҒAl3+гҖҒBa2+ В В В В B. H+гҖҒMg2+гҖҒAl3+В В В В В C. H+гҖҒCu2+гҖҒAl3+В В В В D. еҸӘжңүMg2+гҖҒAl3+
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
100ml 1mol/Lзҡ„AlCl3жә¶ж¶ІдёҺ100mlВ 3.5mol/Lзҡ„NaOHжә¶ж¶Іж··еҗҲпјҢеҫ—еҲ°жІүж·Җдёә(В В В ) A. 7.8gВ В В В B. 0gВ В В В C. 9.1 gВ В В В D. 3.9g
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҳеҢ–дёҚеҸҜиғҪйҖҡиҝҮдёҖжӯҘеҸҚеә”зӣҙжҺҘе®ҢжҲҗзҡ„жҳҜ пјҲВ В В В пјү A. Al(OH)3 вҶ’ Al2O3В В В B. SiO2 вҶ’ H2SiO3В В В В C. Al вҶ’ AlO2-В В В D. SiвҶ’В Na2SiO3
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁзӣёеҗҢжқЎд»¶дёӢпјҢдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲВ В В В пјү AпјҺж°Ҝж°”з”Ёеҗ‘дёҠжҺ’з©ә气法收йӣҶВ В В В В В BпјҺNOеҸҜз”ЁжҺ’з©әж°”жі•иҝӣиЎҢ收йӣҶ CпјҺзўій…ёзҡ„й…ёжҖ§жҜ”зЎ…й…ёејәВ В В В В В В В В В DпјҺSO2В зҡ„еӨ§йҮҸжҺ’ж”ҫдјҡеј•иө·й…ёйӣЁ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүе…ідёӢеҲ—жөҒзЁӢзҡ„еҲӨж–ӯжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү
A. жөҒзЁӢдёӯж¶үеҸҠзҡ„еҸҚеә”еқҮдёәйқһж°§еҢ–иҝҳеҺҹеҸҚеә”В В B. еҸҚеә”в‘Ўдә§з”ҹзҡ„йҳҙзҰ»еӯҗдё»иҰҒдёәCO32пјҚ C. еҸҚеә”в‘ўеңЁе®һйӘҢе®Өдёӯеә”еңЁи’ёеҸ‘зҡҝдёӯиҝӣиЎҢВ В В В D. еҸҚеә”в‘Јзҡ„жқЎд»¶жҳҜеҜ№зҶ”иһҚзҠ¶жҖҒдёӢзҡ„еҸҚеә”зү©иҝӣиЎҢз”өи§Ј
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢи®ҫи®ЎжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү A. е°ҶSO2йҖҡе…Ҙжәҙж°ҙдёӯиҜҒжҳҺSO2е…·жңүжјӮзҷҪжҖ§ B. з”Ёеҗ‘дёҠжҺ’з©ә气法收йӣҶй“ңзІүдёҺзЁҖзЎқй…ёеҸҚеә”дә§з”ҹзҡ„NO C. е°Ҷзўҳж°ҙеҖ’е…ҘеҲҶж¶ІжјҸж–—пјҢеҠ йҖӮйҮҸд№ҷйҶҮпјҢжҢҜиҚЎеҗҺйқҷзҪ®пјҢеҸҜе°ҶзўҳиҗғеҸ–еҲ°д№ҷйҶҮдёӯ D. е°ҶSO2йҖҡе…ҘKMnO4й…ёжҖ§жә¶ж¶ІиҜҒжҳҺSO2е…·жңүиҝҳеҺҹжҖ§
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
дёӢеҲ—еҸҷиҝ°в… е’Ңв…ЎеқҮжӯЈзЎ®е№¶жңүеӣ жһңе…ізі»зҡ„жҳҜпјҲВ В В В пјү
A. AВ В В B. BВ В В C. CВ В В D. D
|
||||||||||||||||
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
еҰӮеӣҫиЈ…зҪ®дёӯпјҢиӢҘе…ій—ӯжҙ»еЎһKпјҢеҲҷе“Ғзәўжә¶ж¶Іж— еҸҳеҢ–пјҢзҹіи•ҠиҜ•ж¶ІеҸҳзәўпјҢзҹізҒ°ж°ҙеҸҳжө‘жөҠпјӣиӢҘжү“ејҖжҙ»еЎһKпјҢеҲҷе“Ғзәўжә¶ж¶ІиӨӘиүІпјҢзҹіи•ҠиҜ•ж¶ІеҸҳзәўпјҢзҹізҒ°ж°ҙеҸҳжө‘жөҠгҖӮжҚ®жӯӨеҲӨж–ӯж°”дҪ“е’Ңе№ҝеҸЈз“¶дёӯзӣӣж”ҫзҡ„зү©иҙЁжҳҜпјҲВ В В В пјү
A. SO2е’ҢNaHCO3жә¶ж¶ІВ В В В B. HClе’Ңжө“H2SO4В В В C. Cl2е’Ңж°Ҝж°ҙВ В В D. Cl2е’ҢNaHCO3жә¶ж¶І
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
е°ҶдёӢеҲ—зү©иҙЁеҲҶеҲ«еҠ е…Ҙжәҙж°ҙдёӯпјҢжәҙж°ҙйўңиүІдёҚеҸҳжө…зҡ„жҳҜв‘ KClжҷ¶дҪ“в‘Ў H2Sж°”дҪ“в‘ў CCl4в‘Ј Mg в‘Ө NaOH в‘Ҙ Na2CO3 в‘Ұ Na2SO3 ⑧ FeBr2 пјҲВ В В В пјү A. в‘Ө⑧   B. в‘Өв‘Ҙв‘Ұ⑧   C. в‘ В В В D. еқҮдёҚеҸҜ
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
е°ҶXж°”дҪ“йҖҡе…ҘBaCl2жә¶ж¶ІпјҢжңӘи§ҒжІүж·Җз”ҹжҲҗпјҢ然еҗҺйҖҡе…ҘYж°”дҪ“пјҢжңүжІүж·Җз”ҹжҲҗпјҢXгҖҒYдёҚеҸҜиғҪжҳҜпјҲВ В В В В В пјү
|
||||||||||||||||
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗеӣәдҪ“еҸҜиғҪеҗ«жңүNH4+гҖҒCu2+гҖҒNa+гҖҒCl-гҖҒCO32-гҖҒSO42-дёӯзҡ„еҮ з§ҚзҰ»еӯҗпјҢеҸ–зӯүиҙЁйҮҸзҡ„дёӨд»ҪиҜҘеӣәдҪ“пјҢиҝӣиЎҢеҰӮдёӢе®һйӘҢпјҲдёҚиҖғиҷ‘зӣҗзұ»зҡ„ж°ҙи§ЈеҸҠж°ҙзҡ„з”өзҰ»пјүпјӣ пјҲ1пјүдёҖд»ҪеӣәдҪ“жә¶дәҺж°ҙеҫ—ж— иүІйҖҸжҳҺжә¶ж¶ІпјҢеҠ е…Ҙи¶ійҮҸBaCl2жә¶ж¶ІпјҢеҫ—жІүж·Җ6.27gпјҢеңЁжІүж·ҖдёӯеҠ е…ҘиҝҮйҮҸзЁҖзӣҗй…ёпјҢд»Қжңү2.33gжІүж·ҖгҖӮ пјҲ2пјүеҸҰдёҖд»ҪеӣәдҪ“дёҺиҝҮйҮҸNaOHеӣәдҪ“ж··еҗҲеҗҺе……еҲҶеҠ зғӯпјҢдә§з”ҹдҪҝж№ҝж¶Ұзҡ„зәўиүІзҹіи•ҠиҜ•зәёеҸҳи“қиүІзҡ„ж°”дҪ“0.672LпјҲж ҮеҮҶзҠ¶еҶөпјүгҖӮ дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В В В В В пјү A. иҜҘеӣәдҪ“дёӯдёҖе®ҡеҗ«жңүNH4+гҖҒCO32-гҖҒSO42-гҖҒNa+В В В B. иҜҘеӣәдҪ“дёӯдёҖе®ҡжІЎжңүCu2+гҖҒCl-гҖҒNa+ C. иҜҘеӣәдҪ“дёӯеҸӘеҗ«жңүNH4+гҖҒCO32-гҖҒSO42-гҖҒCl-В В В В D. ж №жҚ®д»ҘдёҠе®һйӘҢпјҢж— жі•зЎ®е®ҡиҜҘеӣәдҪ“дёӯжңүNa+
|
|
| 26. | иҜҰз»ҶдҝЎжҒҜ |
|
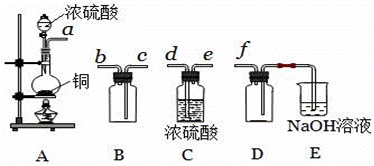
(11еҲҶ)й»„й“ңзҹҝпјҲCuFeS2пјүжҳҜеҲ¶еҸ–й“ңеҸҠе…¶еҢ–еҗҲзү©зҡ„дё»иҰҒеҺҹж–ҷд№ӢдёҖпјҢиҝҳеҸҜеҲ¶еӨҮзЎ«еҸҠй“Ғзҡ„еҢ–еҗҲзү©пјҺеҶ¶зӮјй“ңзҡ„еҸҚеә”дёә 8CuFeS2+21O2 пјҲ1пјүиӢҘCuFeS2дёӯFeзҡ„еҢ–еҗҲд»·дёә+2пјҢеҸҚеә”дёӯиў«иҝҳеҺҹзҡ„е…ғзҙ жҳҜ В В В В В В В _ пјҲеЎ«е…ғзҙ з¬ҰеҸ·пјүпјҺ пјҲ2пјүйӘҢиҜҒй»„й“ңзҹҝеҶ¶зӮјй“ңзҡ„еҸҚеә”еҗҺж°”дҪ“дёӯеҗ«жңүSO2зҡ„ж–№жі•жҳҜВ В В В В В В В В В В В _пјҺ пјҲ3пјүе®һйӘҢе®ӨеҲ¶еӨҮпјҢ收йӣҶе№ІзҮҘзҡ„SO2пјҢжүҖйңҖд»ӘеҷЁеҰӮдёӢпјҺ В в‘ е…¶дёӯиЈ…зҪ®Aдә§з”ҹSO2пјҢеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В пјҺ в‘ЎиҜ·жҢүж°”жөҒж–№еҗ‘иҝһжҺҘеҗ„д»ӘеҷЁжҺҘеҸЈпјҢйЎәеәҸдёәaвҶ’гҖҖгҖҖвҶ’гҖҖгҖҖвҶ’гҖҖгҖҖвҶ’гҖҖгҖҖвҶ’fпјҢиЈ…зҪ®EдёӯNaOHжә¶ж¶Ізҡ„дҪңз”ЁжҳҜВ В В В В В В В В В В _пјҺEдёӯеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ В В В В В В В В В В В В В В В В В В В В В В пјҺ
|
|
| 27. | иҜҰз»ҶдҝЎжҒҜ |
|
ж ҮеҮҶзҠ¶еҶөпјҢдҪ“з§ҜзӣёеҗҢзҡ„еӣӣж”ҜиҜ•з®ЎдёӯеҲҶеҲ«зӣӣж»ЎCl2гҖҒNH3гҖҒSO2е’ҢNO2пјҢеҲҶеҲ«еҖ’з«ӢеңЁзӣӣжңүи¶ійҮҸж°ҙзҡ„ж°ҙж§Ҫдёӯ(еҒҮи®ҫиҝӣе…ҘиҜ•з®Ўзҡ„ж¶ІдҪ“дёҚжү©ж•Ј)пјҢе…үз…§е……еҲҶжә¶и§ЈгҖӮ
пјҲ1пјүд»Һзү©иҙЁеҲҶзұ»зҡ„и§’еәҰеҸҜд»ҘжҺЁжөӢзү©иҙЁзҡ„жҖ§иҙЁгҖӮе…¶дёӯSO2еұһдәҺ_______ж°§еҢ–зү©(еЎ«вҖңй…ёжҖ§вҖқгҖҒвҖңзўұжҖ§вҖқжҲ–вҖңдёӨжҖ§вҖқ)гҖӮ пјҲ2пјүиЈ…жңүNO2зҡ„иҜ•з®ЎеҖ’з«ӢеңЁзӣӣжңүи¶ійҮҸж°ҙзҡ„ж°ҙж§Ҫж—¶пјҢеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә___________________гҖӮе®һйӘҢзҺ°иұЎдёә__________________________________гҖӮ пјҲ3пјүиЈ…жңүNH3зҡ„иҜ•з®ЎиҝӣиЎҢе®һйӘҢж—¶пјҢе®һйӘҢе®ҢжҜ•иҜ•з®ЎеҶ…жә¶ж¶Ізҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёәВ В В В В В В гҖӮ пјҲ4пјүиЈ…жңүCl2зҡ„иҜ•з®ЎеҖ’з«ӢеңЁзӣӣжңүи¶ійҮҸж°ҙзҡ„ж°ҙж§Ҫдёӯз»ҸиҝҮе……еҲҶзҡ„е…үз…§пјҢе®һйӘҢз»“жқҹиҜ•з®Ўдёӯеү©дҪҷзҡ„ж°”дҪ“жҳҜВ В В В В В В В В пјҢз”ҹжҲҗиҜҘж°”дҪ“е…ҲеҗҺеҸ‘з”ҹзҡ„еҢ–еӯҰж–№зЁӢејҸжңүВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖҒВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
|
| 28. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҲ7еҲҶпјүжңүAгҖҒBгҖҒCгҖҒDеӣӣз§Қж— иүІж°”дҪ“пјҢ в‘ AиғҪдҪҝж№ҝж¶Ұзҡ„зәўиүІзҹіи•ҠиҜ•зәёеҸҳи“қпјӣ в‘ЎдёҖе®ҡжқЎд»¶дёӢпјҢAеҸҜд»ҘдёҺBеҸҚеә”з”ҹжҲҗCпјҢCйҒҮз©әж°”еҸҳдёәзәўжЈ•иүІпјӣ в‘ўDдёҺAж··еҗҲз”ҹжҲҗзҷҪзғҹпјӣ в‘ЈDзҡ„жө“жә¶ж¶ІдёҺиҪҜй”°зҹҝ(дё»иҰҒжҲҗеҲҶжҳҜMnO2)еңЁеҠ зғӯжқЎд»¶дёӢеҸҚеә”еҸҜеҲ¶еҸ–й»„з»ҝиүІж°”дҪ“EпјӣжҢүиҰҒжұӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүеҶҷеҮәAдёҺBз”ҹжҲҗC зҡ„еҢ–еӯҰж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ пјҲ2пјүеҶҷеҮәв‘Јзҡ„зҰ»еӯҗж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ пјҲ3пјүж°”дҪ“EжңүжҜ’пјҢе®һйӘҢе®ӨдёҖиҲ¬з”ЁВ В В В В В В В В В В В В еҗёж”¶пјҢиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜ_________________________________гҖӮ
|
|
| 29. | иҜҰз»ҶдҝЎжҒҜ |
|
д»ҘдёӢжҳҜеҜ№йҮҚиҰҒе…ғзҙ еҸҠе…¶еҢ–еҗҲзү©зҡ„и®Ёи®әпјҢж №жҚ®иҰҒжұӮеӣһзӯ”й—®йўҳпјҡ пјҲ1пјүеҲ¶йҖ и®Ўз®—жңәиҠҜзүҮзҡ„еҚҠеҜјдҪ“жқҗж–ҷжҳҜ____пјҢж°ҙжҷ¶йЎ№й“ҫзҡ„дё»иҰҒжҲҗеҲҶжҳҜ_______гҖӮ пјҲ2пјүе®һйӘҢе®ӨзӣӣиЈ…NaOHжә¶ж¶ІжҳҜиҜ•еүӮ瓶дёҚиғҪз”ЁзҺ»з’ғеЎһпјҢеә”иҜҘз”Ёж©Ўиғ¶еЎһпјҢд»ҘйҳІжӯўеҸ‘з”ҹеҸҚеә”пјҡ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (зҰ»еӯҗж–№зЁӢејҸ) пјҲ3пјүж°ЁжҳҜдёҖз§ҚйҮҚиҰҒзҡ„еҢ–е·Ҙдә§е“ҒпјҢеҜҶеәҰжҜ”з©әж°” В В В В В В В В пјҲеЎ«вҖңеӨ§вҖқжҲ–вҖңе°ҸвҖқпјүгҖӮ е·ҘдёҡдёҠеҲ¶еӨҮж°Ёж°”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ4пјүе·ҘдёҡдёҠеҲ¶еҸ–жјӮзҷҪзІүзҡ„еҸҚеә”еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ5пјүжө“H2SO4еёёз”ЁдҪңж°”дҪ“е№ІзҮҘеүӮпјҢжҳҜеӣ дёәе®ғе…·жңү____________пјӣе°ҶйҖӮйҮҸзҡ„и”—зі–ж”ҫе…Ҙзғ§жқҜдёӯпјҢж»ҙе…ҘеҮ ж»ҙж°ҙпјҢжҗ…жӢҢеқҮеҢҖгҖӮ然еҗҺеҠ е…ҘйҖӮйҮҸжө“зЎ«й…ёпјҢиҝ…йҖҹжҗ…жӢҢпјҢж”ҫеҮәеӨ§йҮҸзҡ„зғӯпјҢеҗҢж—¶и§ӮеҜҹеҲ°и”—зі–йҖҗжёҗеҸҳй»‘пјҢдҪ“з§ҜиҶЁиғҖпјҢ并ж”ҫеҮәжңүеҲәжҝҖжҖ§ж°”е‘ізҡ„ж°”дҪ“гҖӮиҜ·еӣһзӯ”пјҡ дә§з”ҹеҲәжҝҖжҖ§ж°”е‘іж°”дҪ“зҡ„еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ6пјүй“ңе’ҢзЁҖзЎқй…ёеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮиӢҘеҸӮеҠ еҸҚеә”зҡ„CuиҙЁйҮҸдёә6.4gпјҢз”ҹжҲҗNOж°”дҪ“____________LпјҲж ҮеҮҶзҠ¶еҶөдёӢпјүпјҢеҲҷиҪ¬з§»з”өеӯҗзү©иҙЁзҡ„йҮҸдёәВ В В В В В В В В molпјҢиў«иҝҳеҺҹзҡ„дёҺжңӘиў«иҝҳеҺҹзҡ„HNO3зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёәВ В В В В В В В В В В В В В гҖӮ
|
|
- еұұдёңзңҒдёҙжІӮеёӮе№ійӮ‘еҺҝгҖҒжІӮж°ҙеҺҝ2020~2021е№ҙй«ҳдәҢдёҠеӯҰжңҹжңҹдёӯиҒ”иҖғеҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- й«ҳдәҢдёӢеҶҢжңҹжң«иҖғиҜ•еҢ–еӯҰиҜ•еҚ·еңЁзәҝз»ғд№ пјҲ2019-2020е№ҙеұұдёңзңҒеҫ·е·һеёӮпјү
- й№ӨеІ—еёӮй«ҳдёҖеҢ–еӯҰ2019е№ҙдёҠеҚҠжңҹжңҲиҖғжөӢйӘҢзҪ‘дёҠиҖғиҜ•з»ғд№
- жҳӯйҖҡеёӮй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•ж‘ёеә•иҖғиҜ•йўҳ
- 2019еұҠй«ҳдёү第дәҢеӯҰжңҹ第дёҖж¬ЎжңҲиҖғзҗҶ科综еҗҲеҢ–еӯҰиҖғиҜ•пјҲиҙөе·һеҸ°жұҹеҺҝйқ©дёҖдёӯеӯҰпјү
- й«ҳдёҖеҢ–еӯҰдёӢеҶҢеҚ•е…ғжөӢиҜ•ж‘ёеә•иҖғиҜ•йўҳ
- иҡҢеҹ 第дёүдёӯеӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- е…ЁеӣҪ2019е№ҙй«ҳдәҢеҢ–еӯҰдёҠеҚҠе№ҙеҚ•е…ғжөӢиҜ•зҪ‘дёҠеңЁзәҝеҒҡйўҳ