2020黑龙江高二下学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
下列说法正确的是( ) A.氯水应保存在棕色广口瓶中并置于阴凉处
|
|
| 2. | 详细信息 | |||||||||||||||||||||
|
下列实验中,预期的现象不合理的是( )
A.A B.B C.C D.D
|
||||||||||||||||||||||
| 3. | 详细信息 |
|
下列离子方程式书写不正确的是( ) A.向 B.大理石与醋酸反应: C.制备 D.少量碳酸氢钠溶液与足量石灰水反应:
|
|
| 4. | 详细信息 |
|
室温下,0.1mol/L某一元酸(HA)溶液中 A.溶液中水电离出的 B.溶液中 C.与0.05 D.上述溶液中加入一定量NaA晶体或加水稀释,溶液的
|
|
| 5. | 详细信息 |
|
NO和CO都是汽车尾气里的有害物质,有人提出通过以下反应来处理尾气: A.使用催化剂能加快反应速率 B.改变压强对反应速率没有影响 C.冬天气温低,反应速率降低,对人体危害较小 D.无论外界条件怎样改变,均对此化学反应的速率无影响
|
|
| 6. | 详细信息 |
|
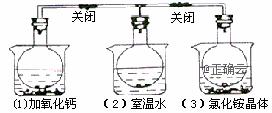
如下图所示,三个烧瓶中分别充满
A.
|
|
| 7. | 详细信息 |
|
有一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来,其装置如图乙所示,ab间充有固体电解质
A.瓦斯分析仪工作时,电池内电路中, B.电池外电路中电子由正极流向负极 C.电极a的反应式为: D.当固体电解质中有1mol
|
|
| 8. | 详细信息 |
|
铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4 (1)该蓄电池的负极材料是__________,放电时发生__________(填“氧化”或“还原”)反应。
|
|
| 9. | 详细信息 |
|
汽车尾气中含有CO、NO、 (1)汽车燃料中不含氮元素,尾气中所含NO产生的原因是_________________________(用化学方程式表示)。 (2)已知:
① 若 ② 部分化学键键能数据为:氧分子中氧氧键的键能为 (3)1573K时, (4)T<500K时,反应 第一步: 第二步: 下列表述正确的是__________(填标号) A.反应速率与 C.反应的中间产物只有
|
|
| 10. | 详细信息 |
|
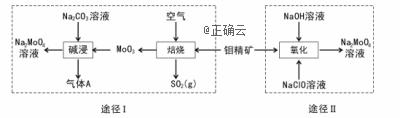
钼酸钠晶体(
(1) (2)途径I为了提高钼精矿焙烧速率,可采取的措施是____(答出两条即可)。 (3)途径I焙烧过程中化学方程式为____,碱浸时气体A的化学式为____。 (4)已知途径I的钼酸钠溶液中 (5)途径II氧化时溶液中还有 (6)途径I或途径II所得的
|
|
| 11. | 详细信息 | ||||||||
|
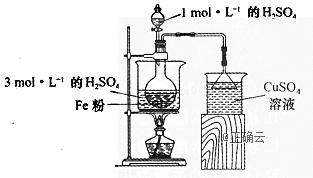
工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值。某教师在指导学生做研究性学习时,拟利用废铁屑在实验室制备 废铁屑的净化:将废铁屑投入10%的碳酸钠溶液中并加热5~10min,通过倾析法弃去纯碱溶液,并用蒸馏水洗净废铁屑,待用。 酸浸净化后的废铁屑:将2g Fe粉、10mL 3
② 反应过程中使用过量铁粉的目的是____________________________。 (2)制备 实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是_____ (填序号)。 A.通入过量 B.加入过量KSCN溶液: C.加入过量NaOH溶液: D.加入过量NaClO和NaOH的混合溶液: (3)产品纯度测定:称取ag产品溶于水,配制成500mL溶液,取25.00mL待测液,用浓度为c
该产品的纯度为____________________________(用含a、c的代数式表示)。 有同学提出,测定产品中
|
|||||||||