2016河南高三下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
amol A. 1 :1 B. 3 :2 C. 2 :3 D. 1 :2
|
|
| 2. | 详细信息 |
|
将等物质的量的镁和铝相混合,取等质量的该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 A.3 mol·L-1 HCl B.4 mol·L-1 HNO3 C.8 mol·L-1 NaOH D.18 mol·L-1 H2SO4
|
|
| 3. | 详细信息 | |||||||||||||||||
|
下表为元素周期表短周期的一部分。下列有关A、B、C、D、E五种元素的叙述中,不正确的是( ) A B C D E A.A与B形成的阴离子可能有:AB32- 、A2B42- B.E的氢化物的沸点比C的氢化物的沸点高 C.D在过量的B中燃烧的主要产物为DB2 D.A与E形成的化合物是非极性分子
|
||||||||||||||||||
| 4. | 详细信息 |
|
下列说法正确的是( ) A.不粘锅的原料 B.分子组成相差1个或若干个“CH2”原子团的有机物,互称为同系物 C.石油分馏是物理变化,煤的气化、液化也是化学变化 D.聚乙烯塑料袋因有毒,不可以装食品
|
|
| 5. | 详细信息 |
|
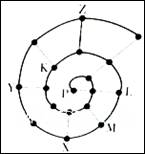
根据不同的研究目的,可以编制成不同的元素周期表。将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”元素周期表,图中每个“.”代表一种元素,其中P点代表氢元素(图中的字母不表示元素符号)。下列说法正确的是
A.Y点元素对应的氢化物比z点元素对应的氢化物更稳定 B.虚线相连的两个点元索处于同一族 C.比Y点原子序数小8的元素,它的最高氧化物对应的水化物是一种弱酸 D.K、L、X三种元素的离子半径大小顺序是X3+>
|
|
| 6. | 详细信息 |
|
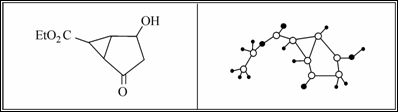
某化合物的结构(键线式)及球棍模型如下:
该有机分子的核磁共振氢谱图如下(单位是ppm):
下列关于该有机物的叙述正确的是 ( ) A.该有机物不同化学环境的氢原子有8种 B.该有机物属于芳香族化合物 C.键线式中的Et代表的基团为—CH3 D.该有机物在一定条件下能够发生加成反应、取代反应,但不能发生消去反应
|
|
| 7. | 详细信息 |
|
对氨水溶液中存在的电离平衡NH3·H2O A.加水后,溶液中n(OH—)增大 B.加入少量浓盐酸,溶液中n(OH—)增大 C.加入少量浓NaOH溶液,电离平衡向正反应方向移动 D.加入少量NH4Cl固体,溶液中c(NH4+)减少
|
|
| 8. | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列说法正确的是 A.0.1 mol·L-1 NaOH溶液中Na+的数目为0.1 NA B.标准状况下,2.24 L CCl4中的分子数目为0.1 NA C.0.1 mol Na2O2与足量CO2反应转移的电子数目为0.1 NA D.3.2 g O2和O3的混合物含有的分子数目为0.1 NA
|
|
| 9. | 详细信息 |
|
下列各组物质中,按熔点由低到高排列正确的是 A.O2、 I2、 Hg B.CO2、 KCl、 SiO2 C.Na 、 K 、 Rb D.SiC、 NaCl 、 SO2
|
|
| 10. | 详细信息 |
|
A、B都是短周期元素,原子半径B>A,它们可形成化合物AB2,由此下列判断正确的是 A.原子序数:A<B B.A和B可能在同一主族 C.A可能在第2周期ⅣA族 D.A肯定是金属元素
|
|
| 11. | 详细信息 |
|
在0.5 L某浓度的Na2SO4溶液中含有0.5 mol Na+,对该溶液的说法不正确的是 A.该溶液的物质的量浓度为1 mol·L—1 B.该溶液中含有35.5 g Na2SO4 C.配制100 mL该溶液需用7.1 g Na2SO4 D.量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol
|
|
| 12. | 详细信息 |
|
有8gNa2O2、Na2O、Na2CO3、NaOH的混合溶液与200g质量分数为3.65%的盐酸恰好完全反应,蒸干溶液,最终得固体质量为 A.8g B.15.5g C.11.7g D.无法计算
|
|
| 13. | 详细信息 |
|
常温下,某溶液中由水电离产生的氢离子和氢氧根离子浓度的乘积为1×10—20。则一定能在该溶液中大量共存的离子组是 A.Ca2+、Na+、Cl— 、NO3— B.NO3—、Fe3+、Mg2+、SO42— C.ClO—、CH3COO—、Na+ 、Br— D.K+、Cl—、Al3+、SO32—
|
|
| 14. | 详细信息 |
|
LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是
A.a处通入O2 B.b处为电池正极,发生了还原反应 C.通入O2的电极发生反应:O2+4e-+4H+ = 2H2O D.该装置将化学能最终转化为电能
|
|
| 15. | 详细信息 | |||||||||||||||||||||||||||
|
下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
回答下列问题: (1)⑥在元素周期表中的位置是(周期、族) 。 (2)在这8种元素的最高价氧化物的水化物中,酸性最强的是 (填化学式)。 (3)①⑥形成物质的电子式 (4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式: 。 (5)下列叙述正确的是 (填字母)。 A.③、④处于不同周期 B.②的阳离子与⑧的阴离子的核外电子数相等 C.⑥在同主族元素中非金属性最强 D.⑤元素与⑦元素两者核电荷数之差是8 E.①与⑧形成的化合物具有两性
|
||||||||||||||||||||||||||||
| 16. | 详细信息 | ||||||||||||||||||
|
氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.01 mol·L-1KMnO4酸性溶液和未知浓度的无色NaHSO3溶液。反应离子方程式是2MnO4-+5HSO3-+H+ (1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少________________ (2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因: (3)选何种指示剂,说明理由 ,到达终点时颜色变化 (4)当用酸滴定碱时,下列操作使测定结果(碱的浓度)偏高的是 ① 酸式滴定管滴至终点,俯视读数 ② 碱液移入锥形瓶后,加入10mL蒸馏水 ③ 酸式滴定管注入酸溶液后,尖嘴有气泡时便开始滴定,滴定后无气泡 ④ 酸式滴定管用蒸馏水润洗后,未用标准液润洗 (5)有关数据记录如下:
则NaHSO3溶液的物质的量浓度为______________mol/L。
|
|||||||||||||||||||
| 17. | 详细信息 |
|
(1)将2.0 mol/L CuSO4 溶液和1.0 mol/L H2SO4 溶液等体积混合(假设混合前后溶液体积不发生变化),所得混合液中C(CuSO4)= mol/L,C(SO42-)= mol/L。 (2)往100 mL 2 mol/L 的AlCl3 溶液中逐滴加入 NaOH 溶液 100 mL 时,产生沉淀为7.8 g。试求所加 NaOH 溶液的物质的量浓度。
|
|
| 18. | 详细信息 | ||||||||
|
下表是A、B、C、D四种有机物的有关信息;
根据表中信息回答下列问题: (1)写出与A互为同系物且比A多一个碳原子的有机物在一定条件下生成高分子化合物的化学反应方程式_________,该反应类型为 _ ; (2)与B具有相同的分子式,分子中每个碳原都以3个键长相等的单键分别跟其它碳原子相连,形成2个90°碳碳键角和1个60°的碳碳键角,该分子的键线式为_________。 (3)C与D反应能生成相对分子质量为100的酯E,该反应类型为 _ ;其化学反应方程式为: _ 。 (4)请写出所有满足下列条件的E的同分异构体结构简式: _ Ⅰ.分子中不含支链并能使溴的四氯化碳溶液褪色 Ⅱ.能与NaHCO3溶液发生反应
|
|||||||||
| 19. | 详细信息 |
|
某有机化合物A含碳76.6%、含氢6.4%,A的相对分子质量约是甲烷的5.9倍。在常温下,该有机物的稀溶液可与浓溴水反应生成白色沉淀,1molA恰好跟3molBr2反应。 (1)求A的分子式 。 (2)写出A的稀溶液中滴加浓溴水的化学方程式__________________。 (3)写出A与碳酸钠、碳酸氢钠溶液可能发生的反应的离子方程式 。
|
|
| 20. | 详细信息 |
|
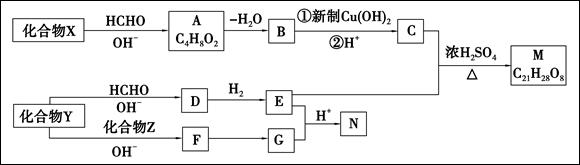
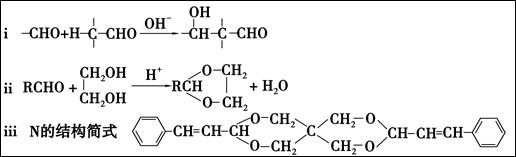
重要有机物M和N常用于交联剂、涂料、杀虫剂等,合成路线如下图所示:
已知:
请回答下列问题: (1)A中含氧官能团的名称为 ,由A生成B的反应类型为 。 (2)Z的名称为 。 (3)1molM在一定条件下发生加成反应,最多消耗 molH2。 (4)由B生成C的反应①的化学方程式为 。 (5)由Y生成D的化学方程式为 。 (6)G的同分异构体有多种,其中与G具有相同官能团的同分异构体有______种,写出核磁共振氢谱有5组峰值,且峰值比为2:2:2:1:1的结构简式 。
|
|
| 21. | 详细信息 |
|
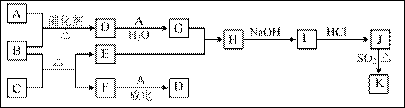
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题: (1)D的化学式为 ;E原子外围电子排布式为 _______ (2)A与B生成D的反应在工业上是生产 的反应原理之一。 (3)E与G的稀溶液反应的离子方程式为 . (4)B和C反应的化学方程式为 。 (5)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式
|
|
| 22. | 详细信息 |
|
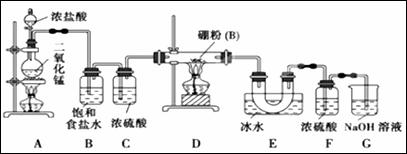
硼与铝的性质相似,能与氧气、氢氧化钠溶液等物质反应。硼与氯气反应生成三氯化硼(BCl3),生成的三氯化硼遇水水解产生白雾(已知:BCl3的熔点为-107.3℃,沸点为12.5℃),且三氯化硼用于制取乙硼烷(B2H6)。某兴趣小组设计如图所示装置制备三氯化硼。
回答下列问题: (1)盛浓盐酸的装置名称为______________________。 (2)装置B的作用是______________________,装置E的作用是__________。 (3)装置D中发生反应的化学方程式为____________________________。 (4)装置F的作用是__________,可以用一个盛装____________(填试剂名称)的干燥管代替装置F和G,使实验更简便。 (5)为了顺利完成实验,点燃酒精灯的正确操作是______(填字母),其理由是__________。 A.先点燃A处酒精灯,后点燃D处酒精灯 B. 先点燃D处酒精灯,后点燃A处酒精灯 C.同时点燃A、D两处酒精灯
|
|
| 23. | 详细信息 | ||||||||||||
|
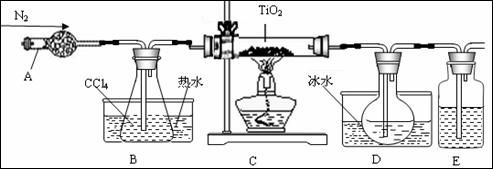
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。 (1)实验室利用反应TiO2(s)+2CCl4(g)==TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下
有关性质如下表
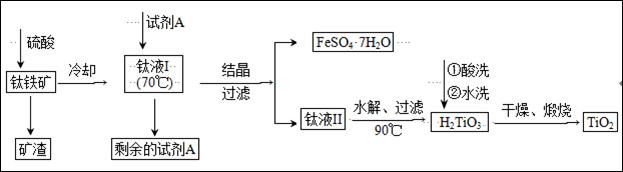
仪器A的名称是 ,装置E中的试剂是 。反应开始前依次进行如下操作:组装仪器、 、加装药品、通入氮气;反应结束后的操作包括:①停止通氮气②熄灭酒精灯③冷却至室温。正确的顺序为 (填序号)。欲分离D中的液态混合物,所采用操作的名称是 。 (2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括: 酸溶FeTiO3(s)+2H2SO4(aq)==FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l) 水解TiOSO4(aq)+ 2H2O(l) 简要工艺流程如下:
①试剂A为 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是 。 ②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是 (填化学式)。
|
|||||||||||||