2020四川高三上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
A.CO2 B.N2O C.CH4 D.N2
|
|
| 2. | 详细信息 |
|
山梨酸(CH3-CH=CH-CH=CH-COOH)是一种高效安全的防腐保鲜剂,有关山梨酸的说法正确的是 A.属于二烯烃 B.和Br2加成,可能生成4种物质 C.1mol可以和3molH2反应 D.和CH3H218OH反应,生成水的摩尔质量为20g/mol
|
|
| 3. | 详细信息 |
|
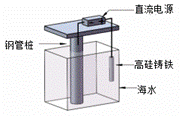
支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,下列有关表述错误的是
A.利用了电解原理 B.钢管桩上有刺激性气味气体生成 C.电子由电源负极流向钢管桩 D.高硅铸铁作阳极
|
|
| 4. | 详细信息 |
|
位于不同主族的四种短周期元素甲、乙、丙、丁,其原子序数依次增大,原子半径r(丁)>r(乙)>r(丙)>r(甲)。四种元素中,只有一种为金属元素,乙和丙原子的最外层电子数之和为丁原子的最外层电子数的3倍。据此推断,下述正确的是 A.简单氢化物的沸点:乙>丙 B.由甲、乙两元素组成的化合物溶于水呈碱性 C.丙和丁两元素的最高价氧化物的水化物之间能发生反应 D.由甲和丙两元素组成的分子,不可能含非极性键
|
|
| 5. | 详细信息 |
|
电解合成 1 , 2-二氯乙烷的实验装置如图所示。下列说法中正确的是
A.该装置工作时,化学能转变为电能 B.CuCl2能将C2H4还原为 l , 2-二氯乙烷 C.X、Y依次为阳离子交换膜、阴离子交换膜 D.该装置总反应为CH2CH2 + 2H2O + 2NaCl
|
|
| 6. | 详细信息 | |||
|
25℃时,改变0.1mol·L-1H2SO3溶液的pH,各微粒的物质的量分数(α)变化如图所示,下列说法中错误的是 A.1gK1(H2SO3)=-1.9 B.pH=3时,c(HSO3-)>c(H2SO3)>c(SO32-) C.反应H2SO3+SO32- D.pH=7.2时,c(HSO3-)=c(SO32-)=c(H+)
|
||||
| 7. | 详细信息 |
|
NA是阿伏加德罗常数的值。下列说法正确的是 A.10 L pH=1的H2SO4 溶液中含H+离子数为2NA B.28 g乙烯与丙烯混合物中含有C-H键数目为4NA C.3 mol H2与1 mol N2混合反应生成NH3,转移电子数为6NA D.11.2 L(标准状况)Cl2 溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
|
|
| 8. | 详细信息 |
|
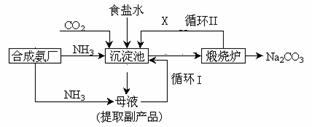
爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题: (1)写出通入CO2和NH3的化学反应方程式_________________________________________________。在 饱和食盐水中通入CO2和NH3,先通NH3后通CO2的原因是_____________________________。 (2)母液中除H+和OH-外,还含有的离子是_____________。 向母液中通氨气,加入细小食盐颗粒,冷却 析出副产品,通氨气的作用有____________。 (a)增大NH4+的浓度,使NH4Cl更多地析出 (b)使NaHCO3更多地析出 (c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度 (3)上述流程中X物质的分子式_______。使原料氯化钠的利用率从70%提高到90%以上,主要是 设计了_______(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是____。 (4)写出检验产品碳酸钠中是否含有氯化钠的简要方案:___________________________________________________________________________________。 (5)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下: 称取样品ag,加水溶解,加入足量的BaCl2溶液,经过滤、洗涤、干燥,最终得到固体bg。样品中纯 碱的质量分数为___________________(用含a、b的代数式表示)。
|
|
| 9. | 详细信息 |
|
工业上制备丙烯的方法有多种,具体如下(本题丙烯用C3H6表示): (1)丙烷(C3H8)脱氢制备丙烯(C3H6) 由下图可得,C3H8(g)
(2)用惰性电极电解CO2的酸性溶液可得丙烯(C3H6),其原理如下图所示。则b的电极反应式为__________。
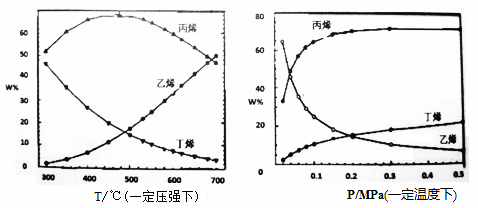
(3)以丁烯(C4H8)和乙烯(C2H4)为原料反应生成丙烯(C3H6)的方法被称为“烯歧化法”,反应为:C4H8(g)+C2H4(g) 一定温度下,在一体积恒为VL的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化反应。 I.该反应达到平衡的标志是______________ a.反应速率满足:2v生成(C4H8)=v生成(C3H6) b.C4H8、C2H4、C3H6的物质的量之比为1:1:2 c.混合气体的平均相对分子质量不再改变 d.C4H8、C2H4、C3H6的浓度均不再变化 Ⅱ.已知t1min时达到平衡状态,测得此时容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为 ①该时间段内的反应速率v(C4H8)= _______mol/(L·min)。(用只含m、V、t1的式子表示)。 ②此反应的平衡常数K=______________。 ③t1min时再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数_______ (4)“丁烯裂解法”是另一种生产丙烯的方法,但生产过程中伴有生成乙烯的副反应发生,具体反应如下:主反应:3C4H8 ①从产物的纯度考虑,丙烯和乙烯的质量比越高越好。则从下表现的趋势来看,下列反应条件最适宜的是__________(填字母序号)。 a.300℃0.1MPa b.700℃0.1MPa c.300℃0.5MPa d.700℃0.5MPa ②下图中,平衡体系中丙烯的百分含量随压强增大呈上升趋势,从平衡角度解释其可能的原因是_____。
|
|
| 10. | 详细信息 |
|
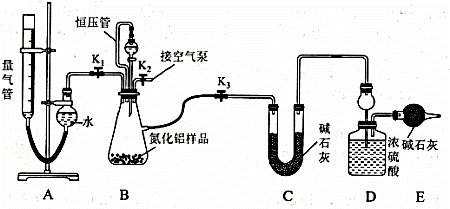
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。 (1)实验原理: ①Al4C3与硫酸反应可生成CH4; ②AIN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式:___________ (2)实验装置(如图所示,量气管为碱式滴定管改装)
连好装置后,首先应进行的操作是_____________________________________ 。 (3)实验过程:称得装置D的初始质量为y g;称取x g AlN样品置于装置B锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管的初始读数为a mL(量气装置左右液面相平)。 ①欲首先测量Al4C3质量分数的有关数据,对K1、K2、K3三个活塞的操作是关闭活塞_______,打开活塞______。 ②若无恒压管,对所测气体体积的影响是_______(填“偏大”、“偏小”或“无影响”)。 ③量气管中液面不再发生变化,说明反应已经结束。读取读数之前,应对量气管进行的操作为 ______ ;若量气管中的液面高于右侧球形容器中的液面,所测气体的体积_____(填“偏大”、“偏小”或“无影响”)。 ④记录滴定管的读数为b mL(已知:该实验条件下的气体摩尔体积为Vm L· mol-1),则Al4C3的质量分数为___________(用可能含a、b、x、y、Vm的代数式表示)。 ⑤测量AlN质量分数的数据:首先关闭活塞K1,打开活塞K3,通过分液漏斗加入过量NaOH溶液,与装置B瓶内物质充分反应;反应完成后,___________________________(填该步应进行的操作),最后称得装置D的质量为z g。
|
|
| 11. | 详细信息 |
|
硫、铁及其化合物用途非常广泛。回答下列问题: (1)基态S原子价电子排布式为________,基态Fe原子未成对电子数为________个。 (2)团簇 (3)工业上主要通过反应SO3+SCl2=SOCl2+SO2制备SOCl2(氯化亚砜),上述四种分子中,属于非极性分子的是________;SCl2分子空间构型为________形;SOCl2分子中心原子杂化方式是________。 (4)黄铁矿的晶体结构如图所示,已知黄铁矿晶胞参数为a=0.5417nm,阿伏加德罗常数的值为NA。则黄铁矿的密度为________g·cm-3(列出计算式)。
|
|
| 12. | 详细信息 |
|
化合物E(二乙酸-1,4-环己二醇酯)是一种制作建筑材料的原料。其合成路线如下:
完成下列填空: (1)A中含有的官能团是______;E的分子式是______;试剂a是______。 (2)写出反应类型:B→C______。 (3)C与D反应生成E的化学方程式:______。 (4)C的同分异构体,能使石蕊试剂显红色,写出该物质的一种结构简式______。 (5)设计一条以环己醇( (合成路线常用的表示方式为:A
|
|