2019-2020年高二上期第一次月考化学免费试卷(湖南省邵东县第一中学、娄底三中)
| 1. 选择题 | 详细信息 |
|
下列反应既属于氧化还原反应,又是吸热反应的是( ) A. 锌粒与稀硫酸的反应 B. 灼热的木炭与CO2反应 C. 甲烷在氧气中的燃烧反应 D. Ba(OH)2·8H2O晶体与NH4Cl晶体的反应 |
|
| 2. 选择题 | 详细信息 |
|
近年来各大型运动会所用火炬的燃料多采用丙烷,其燃烧时发生反应的化学方程式为C3H8+5O23CO2+4H2O。下列说法中不正确的是( ) A.火炬燃烧时化学能只转化为热能 B.所有的燃烧反应都会释放热量 C.1 mol C3H8和5 mol O2所具有的总能量大于3 mol CO2和4 mol H2O所具有的总能量 D.丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料 |
|
| 3. 选择题 | 详细信息 |
|
下列依据热化学方程式得出的结论正确的是 A.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1,则氢气的燃烧热为241.8kJ·mol-1 B.反应SO2(g)+2H2S(g) C.已知2C(s)+2O2(g)=2CO2(g) ΔH=a、 2C(s)+O2(g)=2CO(g) ΔH=b,则a>b D.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
|
| 4. 选择题 | 详细信息 |
|
对于反应COCl2(g) A.升温 B.增加CO浓度 C.加催化剂 D.恒容下通入惰性气体 |
|
| 5. 选择题 | 详细信息 |
|
在恒温恒容的密闭体系中,可逆反应:A(s)+2B(g) ①v正(B)=v逆(C) ②n(B)∶n(C)=1∶1 ③容器内压强不再改变 ④容器内气体的密度不再改变 ⑤容器内混合气体的平均相对分子质量不再改变 A. ②③④⑤ B. ①③④ C. ②③ D. 全部 |
|
| 6. 选择题 | 详细信息 |
|
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是 A. △H1>△H2>△H3 B. △H1>△H2=△H3 C. △H1<△H2<△H3 D. △H1=△H2<△H3 |
|
| 7. 选择题 | 详细信息 |
|
一定温度下将2mol SO2和1mol 18O2 充入恒容密闭容器中发生反应:2SO2(g)+18O2 (g) A.18O 存在于SO2、O2 和SO3 中 B.容器中所含氧原子总数为6 NA C.反应中转移电子的数目为4 NA D.平衡后再充入一定量Ar,重新平衡后,SO3浓度保持不变 |
|
| 8. 选择题 | 详细信息 |
|
对于可逆反应:A(g)+3B(s) A.v(A)=0.5mol·L-1·min-1 B.v(B)=1.2mol·L-1·s-1 C.v(D)=0.4mol·L-1·min-1 D.v(C)=0.1mol·L-1·s-1 |
|
| 9. 选择题 | 详细信息 |
|
已知NO和O2转化为NO2的反应机理如下: ①2NO(g) ②N2O2(g)+O2(g) 下列说法正确的是 A.2NO(g)+O2(g) B.2NO(g)+O2(g) C.反应过程中的能量变化可用如图表示 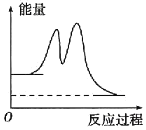 D.反应②的速率大小决定2NO(g)+O2(g) |
|
| 10. 选择题 | 详细信息 |
|
已知:H-H键、O=O键和O-H键的键能分别为436 kJ/mol、496 kJj/mol和462kJ/mol;2C(s)+O2 (g)=2CO(g) ∆H=-220 kJ/mol ;C(s)+H2O(g)=CO(g)+H2 (g) ∆H=a kJ/mol。则a为 A. -332 B. -118 C. +130 D. +350 |
|
| 11. 选择题 | 详细信息 |
|
实验室用下列四种硫酸分别与锌粒制备H2 ,其中反应速率最快的是 A.10℃ 10mL 3mol/L的硫酸 B.10℃ 20mL 1mol/L的硫酸 C.20℃ 10mL 3mol/L的硫酸 D.20℃ 20mL 18.4 mol/L的硫酸 |
|
| 12. 选择题 | 详细信息 |
|
一定条件下,下列不能用勒夏特列原理解释的是 A.H2、I2、HI 混合气体加压后颜色变深 B.合成氨时将氨液化分离,可提高原料的利用率 C.FeCl3溶液中加入KSCN溶液的血红色溶液中,加入铁粉后溶液颜色变浅或消失 D.新制氯水中,滴加硝酸银溶液,溶液颜色变浅 |
|
| 13. 选择题 | 详细信息 |
在密闭容器中进行反应:A(g)+3B(g) A. 依据图A可判断正反应为放热反应 B. 在图B中,虚线可表示使用了催化剂 C. 若正反应的△H<0,图C可表示升高温度使平衡向逆反应方向移动 D. 由图D中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
|
| 14. 选择题 | 详细信息 | |||||||||||||||
某温度下,H2(g)+CO2(g)
|
||||||||||||||||
| 15. 选择题 | 详细信息 |
|
在给定的条件下,下列选项所示的物质间转化均能一步实现的是 A.Na C.SiO2 |
|
| 16. 选择题 | 详细信息 | ||||||||||||||||||||||||||||||||||||||
汽车尾气净化器中发生的反应为2NO(g)+2CO(g)
|
|||||||||||||||||||||||||||||||||||||||
| 17. 选择题 | 详细信息 | |||||||||||||||||||||
利用下图实验装置进行有关实验,下列对结论的叙述正确的是
|
||||||||||||||||||||||
| 18. 选择题 | 详细信息 |
|
在密闭容器中的一定量混合气体发生反应xM (g)+yN(g) A.x + y < z B.平衡向正反应方向移动 C.N的转化率降低 D.混合气体的密度不变 |
|
| 19. 选择题 | 详细信息 |
利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)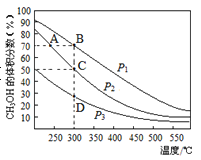 A. 该反应的△H<0,且p1<p2 B. 反应速率:ν逆(状态A)>ν逆(状态B) C. 在C点时,CO转化率为75% D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同 |
|
| 20. 实验题 | 详细信息 |
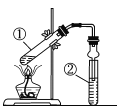
利用如图所示装置测定中和热的实验步骤如下: 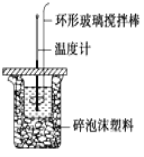 ①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的 酸用水冲洗干净; ②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度; ③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题: (1)实验中NaOH溶液稍稍过量的目的是_________________________________________。 (2)使盐酸与NaOH溶液混合均匀的正确操作是_______(填序号). A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动 (3)实验中改用60mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液进行反应,与上述实验相比,放出的热量______________(填“ 偏多”“偏少”或“相等”,下同),所求得的中和热ΔH ______________。 (4)如果上述实验测得中和热ΔH = -55.6kJ/mol,并已知:Ba2+(aq)+2OH-(aq)+ 2H++SO42- (aq)=BaSO4(s) +2H2O(l) ,ΔH=-1584.2 kJ·mol-1。则生成BaSO4(s)的反应热ΔH=______________。 |
|
| 21. 计算题 | 详细信息 | ||||||||||||
T℃时,在2L的密闭容器中,气体X、Y、Z的物质的量随时间的变化曲线如图所示。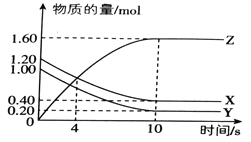 (1)该反应的化学方程式为_________________________. (2)0~10s内,X的化学反应速率为___________________. (3)该反应在不同温度下的平衡常数如表所示:
|
|||||||||||||
| 22. | 详细信息 |
工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O),流程如下: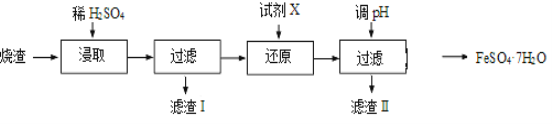 (1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为__________________。能提高烧渣浸取速率的措施有__________________(填字母)。 A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度 (2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是________(填字母)。还原结束时,溶液中的主要阴离子有_____________。 A.Fe粉 B.SO2 C.NaI 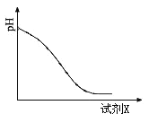 (3)滤渣Ⅱ主要成分的化学式为__________________;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是_______________________________ 、过滤、洗涤、干燥。 |
|
| 23. 综合题 | 详细信息 |
|
二甲醚(DME)被誉为“21世纪的清洁燃料”。合成气(主要成分为CO、CO2和H2)是重要的化工原料,可利用合成气在催化剂存在下直接制备二甲醚(CH3OCH3)。 已知:① CO2(g)+3H2(g) ② CO2(g)+H2(g) ③ 2CH3OH(g) (1)工业上用CO2和H2在一定条件下反应直接制备二甲醚,主反应为:2CO2(g)+6H2(g) ①要使该反应速率和产率都增大,应该采取的措施是__________________________________;。 ②一定条件下,上述主反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是__________(填标号)。 a.逆反应速率先增大后减小 b.H2的转化率增大 c.反应物的体积百分含量减小 d.容器中的 ③在某压强下,制备二甲醚的反应在不同温度、不同投料比时CO2的转化率如图(a)所示。T1温度下,将6molCO2和12molH2充入10L的密闭容器中, 5 min后反应达到平衡状态,则0〜5 min内的平均反应速率υ(CH3OCH3)=__________;KA、 KB、 KC三者之间的大小关系为___________。 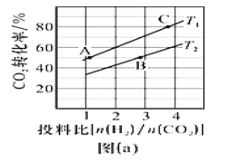  (2)在适当条件下由CO和H2直接制备二甲醚,另一产物为水蒸气。 ①该反应的热化学方程式是_______________________________。 ②CO的转化率、二甲醚的产率与反应温度的关系如图(b)所示,请解释290℃后升高温度,CH3OCH3产率逐渐走低的原因可能是________________________________。 |
|