2018湖北高一下学期人教版高中化学同步练习
| 1. | 详细信息 |
|
有些歌第一句就喜欢上,有些人第一眼就爱上,有些试卷第一题就不想做了。“生物质能”主要是指树木、庄稼、草类等植物直接或间接提供的能量,下列说法不正确的是( ) A.生物质能是可储存和可运输的非可再生能源 B.生物质能和化石燃料一样属于一次能源 C.生物质能是解决农村能源的主要途径 D.利用生物质能就是间接利用太阳能
|
|
| 2. | 详细信息 |
|
化学与生产、生活及社会发展密切相关。下列说法正确的是 A.石墨纤维属于有机高分子化合物 B.“血液透析”和“静电除尘”利用了胶体相同的性质 C.废弃的秸秆可用于生产生物质燃料乙醇 D.过氧化氢、乙醇、过氧乙酸等均可将病毒氧化而达到消毒目的 |
|
| 3. | 详细信息 |
|
下列关于化学反应的速率和限度的说法正确的是( ) A.化学反应速率只能用反应物浓度的减少来表示 B.同一化学反应,相同条件下用不同物质表示反应速率,其数值可能不同,但表示意义相同 C.化学平衡状态指的是反应物和生成物浓度相等时的状态 D.将稀盐酸换成浓硫酸或浓硝酸,可以使反应Fe(s)+2HCl(aq)===FeCl2(aq)+H2(g)生成H2速率增大
|
|
| 4. | 详细信息 |
|
下列有关叙述正确的是( ) A. 元素性质呈周期性变化的根本原因是元素化合价呈周期性变化
|
|
| 5. | 详细信息 |
|
化学反应中必然伴随着物质变化和能量变化,下列说法正确的是( )
B.吸热反应一定要在加热或高温条件下才能进行 C.右图可表示放热反应中的能量变化 D.焰色反应有能量变化,所以焰色反应是化学反应
|
|
| 6. | 详细信息 |
|
设NA代表阿伏伽德罗常数,下列说法正确的是( ) A.在密闭容器中加入0.5 mol N2和1.5 mol H2,充分反应后可得到NH3分子数为NA B.1molC2H6中含有6NA个共价键 C.常温常压下,14.0g由C2H4和C3H6组成的混合气体原子总数为3NA D.标准状况下,11.2L CCl4所含的分子数为0.5NA
|
|
| 7. | 详细信息 |
|
甲烷和氯气按照物质的量之比为1:1混合,在光照条件下,得到的产物是( ) ①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4 A.只有① B.①和③的混合物 C.①②③④的混合物 D.只有②
|
|
| 8. | 详细信息 |
|
25 ℃时,下列各组离子在指定溶液中一定能大量共存的是( ) A.0.1 mol/L-1NH4HCO3溶液:K+、Na+、SO42-、OH- B.能溶解Al2O3的溶液:Ba2+、Na+、NO3-、Cl- C.0.1 mol/L-1CH3COONa的溶液:Mg2+、H+、I-、SO42- D.0.1 mol/L-1KNO3溶液:Fe2+、H+、SO42-、Cl-
|
|
| 9. | 详细信息 |
|
能正确表示下列反应的离子方程式是 A.硫酸铝溶液中加入过量氨水: A13+ +3OH-=Al(OH)3↓ B.冷的氢氧化钠溶液中通入氯气: Cl2+2OH-=ClO-+Cl-+H2O C.NaHSO4溶液与Ba(OH)2溶液混合:SO42-+Ba2+=BaSO4↓ D.Fe(OH)3溶解于氢碘酸中:Fe(OH)3 + 3H+= Fe3++3H2O
|
|
| 10. | 详细信息 | |||||||||||||||
|
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是( )
|
||||||||||||||||
| 11. | 详细信息 |
|
在一定条件下,将3 mol A 和 1 mol B 两种气体混合于固定容积为2 L的密闭容器中,发生如下反应: 3A(g)+B(g) A.x=2 B.2 min 时, A 的浓度为 0.9mol·L-1
|
|
| 12. | 详细信息 |
|
物质的量相同的铜片分别与体积相同且过量的浓硝酸、稀硝酸反应,下列有关二者的比较相等的是( ) ①反应中氧化剂得到的电子总数 ②铜片消耗完所需时间 ③反应后溶液中的铜离子浓度(反应前后溶液体积不变) ④反应生成气体的体积(同温、同压) A.①③ B.②④ C.①④ D.②③
|
|
| 13. | 详细信息 |
|
.下列有关叙述正确的是( ) A.某有机物的结构简式为CH3CH2C(CH3)3,该有机物的名称为2-二甲基丁烷 B.有机物CH3(CH2)2CH(CH3)2的一氯代物有四种 C.CH3-CH=CH-CH3分子中4个碳原子都在同一平面上 D.0.1mol分子式为C4H4O的有机物完全燃烧,耗氧气的体积为11. 2L(标准状况下)
|
|
| 14. | 详细信息 |
|
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是( ) A.原子半径的大小顺序: r(Y)>r(Z)>r(W) B.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 C.元素Y 的简单气态氢化物的热稳定性比Z 的强 D.元素Z、W 的简单离子的电子层结构不同
|
|
| 15. | 详细信息 |
|
小明上次化学考试没考好,很沮丧。班主任杜老师开导他说:学习化学一是要有兴趣;二是要做好归纳总结、发现规律,同时还要对特殊情况适当记忆;三是要重视基础,抓住问题的本质。听了老师的话,小明总结了刚学习过的内容,你认为正确的是( ) ① 由非金属元素组成的化合物一定是共价化合物 ② 非极性键既可能存在于单质和共价化合物中,也可能存在于离子化合物中 ③ 冰可以浮在水面上以及氨气易溶于水都跟氢键有关 ④ 无论吸热反应还是放热反应,升高温度,就一定可以使化学反应速率加快 ⑤ 氢气在空气中燃烧与电解水的反应互为可逆反应 ⑥ 在原电池内部,阴离子向正极移动,阳离子向负极移动 A.①②④ B.②③④ C.③④⑤ D.①⑤⑥
|
|
| 16. | 详细信息 |
|
四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是( ) A.a-c=m+n B.最高价氧化物对应水化物的碱性X>Y C.HnZ 的还原性强于HmR D.原子半径大小R>Z>Y>X
|
|
| 17. | 详细信息 |
|
做到这里,我明白你们内心的崩溃,再牛掰的肖邦,也弹不出你们此刻的忧桑。在一定温度下的定容容器中,能说明反应:NH2COONH4(s) ①混合气体的压强不再发生变化 ②混合气体的密度不再发生变化 ③混合气体的总物质的量不再发生变化 ④混合气体的平均相对分子质量不再发生变化 ⑤混合气体的颜色不再发生变化 ⑥某种气体的百分含量不再发生变化 ⑦各反应物或生成物的浓度之比等于化学计量数之比 A.2种 B.3种 C.4种 D.5种
|
|
| 18. | 详细信息 |
|
某原电池装置如图所示,电池总反应为2Ag+Cl2 A.正极反应为AgCl + e− B.放电时,交换膜右侧溶液中有大量白色沉淀生成 C.当电路中转移0.01 mol e−时,交换膜左侧溶液中 约减少0.02 mol离子 D.若用NaCl溶液代替盐酸,则电池总反应随之改变
|
|
| 19. | 详细信息 |
|
将适量的CH4、O2、Na2O2密封于一密闭容器中,在150℃时,不断地用电火花引燃混合气体,反应彻底结束后,容器内压强为0,且残留固体溶于水无气体产生。则CH4、O2、Na2O2三种物质的物质的量之比为( ) A.2:1:3 B.2:3:1 C.2:6:1 D.2:1:6
|
|
| 20. | 详细信息 | ||||||
|
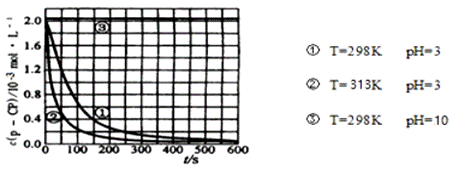
在调节好pH和Fe2+浓度的废水中加H2O2,能氧化降解污染物。现在用该方法来降解污染物 p-CP,控制H2O2、Fe2+和p-CP的初始浓度相同,设计如下对比实验探究温度、pH对该降 ①T=298K pH=3 ②T=313K pH=3 ③T=298K pH=10 t/s A.实验①、②表明适当升高温度,降解反应速率增大 B.根据反应原理推断,温度过高,反而会使降解速率变慢 C.313K、pH=3时,在0~100s内,p-CP的分解平均速率约为1.8×10-2mol·L-1·s-1 D.室温下,实验过程中需在不同时间从反应器中取样分析浓度,可以采用迅速加碱调节溶液pH的方法使所取样品中的反应立即停止下来
|
|||||||
| 21. | 详细信息 |
|
Ⅰ.下面是同学们熟悉的物质,答题请填入序号: ①O2 ②NaBr ③HCl ④NaOH ⑤Na2O2 ⑥Ne (1)这些物质中,只含有共价键的是________;只含有离子键的是________;既含有非极性共价键又含有离子键的是________;不存在化学键的是________。 (2)属于共价化合物的是________;属于离子化合物的是________。 Ⅱ.(1)同温同压下,某烷烃的蒸气密度是H2的43倍,该烷烃的同分异构体有_______种。 (2)某有机物的产量可以用来衡量一个国家的石油化工发展水平,该有机物的结构式为______。若将该气体通入溴的四氯化碳溶液中,反应的化学方程式为 __________________________,其反应类型是 ______________ 反应(填“取代”或“加成”)。
|
|
| 22. | 详细信息 |
|
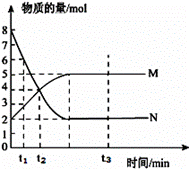
Ⅰ.一定温度下,在2L的密闭容器中,M、N 两种气体的物质的量随时间变化曲线如图所示:
(2)反应达到平衡状态时,放出 6Q kJ的热量,当容器中起始充入l mol N,反应放出的热量__________(填序号)。 ①等于Q kJ ②小于Q kJ ③大于Q kJ ④等于2Q kJ (3)判断该反应达到平衡状态的依据是__________(填序号)。 ①该条件下,正逆反应速率都为零 ②该条件下,混合气体的密度不再发生变化 ③该条件下,混合气体的压强不再发生变化 ④该条件下,单位时间内消耗2 mol N的同时,生成1 mol M (4)能加快反应速率的措施是_________(填序号)。 ①升高温度 ②容器体积不变,充入隋性气体Ar
Ⅱ.将CH4设计成燃料电池,其利用率更高,装置如图所示 (A、B为多孔碳棒)。 ①实验测得OH-定向移向B 电极,则_____处电极入口通 甲烷(填A或B),其电极反应式为___________。 ②当消耗甲烷的体积为33.6L(标准状况下)时,假设电池 的能量转化率为80%,则导线中转移电子的物质的量为________。
|
|
| 23. | 详细信息 | ||
|
如图是一些重要工业生产的转化关系(反应条件略去):
请完成下列问题. (1)若D为固体单质,与A属于同一主族短周期元素,则: ①反应的化学方程式是________________; ②D的原子结构示意图是__________; ③D单质的一种重要用途是____________。 (2)若A为黑色固体,D为可燃性气体单质,则该反应的化学方程式_________。 (3)若B是一种能使湿润的红色石蕊试纸变蓝的气体,则: ①B分子的电子式是_____________; ②B在一定条件下可与C反应生成无毒无害的物质,则该反应的化学方程式为______。
|
|||
| 24. | 详细信息 | |||
|
Ⅰ.高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的处理。某工厂欲以工业废料(金属铝、铁及其氧化物)为原料制取PAFC,设计如下流程:
(1)PAFC中铁元素的化合价为_________。 (2)废料与稀盐酸混合后发生了多个化学反应,在发生的这些反应中,请写出一个是氧化还原反应但不属于四大基本反应类型的反应的离子方程式 。 (3)所得酸性溶液中,不能确定是否一定存在的阳离子是___________,欲确认该离子是否存在最常用的试剂名称为 。 (4)试剂X最好是下列中的__________(填字母序号)。 A.Fe B.HNO3 C.氯水 D.高锰酸钾溶液 (5)水解形成的聚合物分散在水中的粒子直径在1nm~100nm之间,请用简单的实验操作和现象验证该分散系 。 Ⅱ.为检测PAFC中Al和Fe含量,采用如图所示流程进行。
|
||||