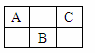2020人教版(2019)高中化学单元测试
| 1. | 详细信息 |
|
元素R可形成化学式为Na2RO4的一种盐,则R是( ) A.F B.N C.S D.Cl
|
|
| 2. | 详细信息 |
|
元素A的原子最外层有6个电子,元素B的原子最外层有3个电子,则A与B形成的化合物可能的化学式是 A.B2A3 B.B2A C.BA2 D.BA
|
|
| 3. | 详细信息 |
|
下列微粒中,中子数和质子数相等的是( ) ①18O;②12C;③26Mg;④40K;⑤40Ca A.①② B.②⑤ C.只有④ D.③④
|
|
| 4. | 详细信息 |
|
某元素的原子核外有三个电子层,其最外层电子数是次外层电子数的一半,则此元素是 A.C B.Si C.S D.C1
|
|
| 5. | 详细信息 |
|
同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,下列说法正确的是( ) A.所含分子数和质量均不相同 B.含有相同的分子数和电子数 C.含有相同的质子数和中子数 D.含有相同数目的中子、原子和分子
|
|
| 6. | 详细信息 |
|
下列各组微粒具有相同的质子数和电子数的是( ) A.OH-、H2O、F- B.NH3、NH4+、NH2- C.H3O+、NH4+、NH2- D.HCl、F2、H2S
|
|
| 7. | 详细信息 |
|
下列各组元素中,原子半径依次增大的是( ) A.Li、Na、K B.I、Br、F C.O、Al、S D.Li、F、Cl
|
|
| 8. | 详细信息 |
|
下列关于原子的认识正确的是( ) A.原子是构成一切物质的最小微粒 B.原子是不可再分的一种微粒 C.原子是化学变化中的最小微粒 D.所有原子的原子核内均有质子和中子
|
|
| 9. | 详细信息 |
|
从某微粒的原子结构示意图反映出 A.质子数和中子数 B.中子数和电子数 C.核电荷数和核外电子层排布的电子数 D.质量数和核外电子层排布的电子数
|
|
| 10. | 详细信息 |
|
已知A的原子序数是x,B2-与A3+具有相同的电子层结构,则B元素的原子序数为( ) A.x-5 B.x+5 C.x+1 D.x-1
|
|
| 11. | 详细信息 |
|
下列各组物质中化学键的类型相同的是( ) A.HCl、MgCl2、NH4Cl B.NH3、H2O、CO2 C.H2O、Na2O、CO2 D.CaCl2、NaOH、H2O
|
|
| 12. | 详细信息 |
|
下列变化过程中,共价键被破坏的是 A.烧碱固体溶于水 B.氯化氢气体溶于水 C.二氧化碳变成干冰 D.碘溶于酒精
|
|
| 13. | 详细信息 |
|
不同元素的原子(包括离子) A.质子数一定不等 B.中子数一定不等 C.质量数一定不等 D.核外电子数一定不等
|
|
| 14. | 详细信息 |
|
元素X的原子,其M层与K层电子数相同;元素Y的原子,其L层上有5个电子。X和Y所形成的稳定化合物的式量为( ) A.100 B.90 C.88 D.80
|
|
| 15. | 详细信息 |
|
下列叙述中,正确的是( ) A.在多电子的原子里,能量高的电子通常在离核近的区域内活动 B.核外电子总是先排在能量低的电子层上,例如只有排满了L层后才排M层 C.两种微粒,若核外电子排布完全相同,则其化学性质一定相同 D.微粒的最外层只能是8个电子才稳定
|
|
| 16. | 详细信息 |
|
某元素的最高价氧化物的分子式RO2,其中含R 27.27% 。对此元素的叙述不正确的是( ) A.该元素为碳 B.该元素的气态氢化物含H 25% C.RO2为极性分子 D.RO2与水反应能生成酸
|
|
| 17. | 详细信息 |
|
电子数相等的微粒叫做等电子体,下列各组微粒属于等电子体是 A.CO和CO2 B.NO和NO2 C.CH4和NH3 D.CO2和SO2
|
|
| 18. | 详细信息 |
|
下列叙述不正确的是( ) A.化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 B.由极性键组成的分子是否有极性决定与分子中各键的空间排列能否使键的极性相互抵消 C.原子中核外电子排布的周期性变化是产生元素周期律的根本原因 D.核素就是同位素
|
|
| 19. | 详细信息 |
|
已知A、B、C三种短周期元素可以形成化合物AB2、CA2,则A一定为( ) A.金属元素 B.非金属元素 C.IA族元素 D.IVA族元素
|
|
| 20. | 详细信息 |
|
下图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数等于B的质量数,B元素的原子核内质子数等于中子数,下列叙述正确的是
A.B为第二周期的元素 B.C为VA族元素 C.三种元素都为非金属元素 D.C是化学性质最活泼的非金属
|
|
| 21. | 详细信息 |
|
X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是 ( ) A.R 一定是共价化合物 B.R一定是离子化合物 C.R可能是共价化合物,也可能是离子化合物 D.R可能是气态物质,也可能是固态物质
|
|
| 22. | 详细信息 |
|
X、Y、Z三种元素的原子,其核外电子排布分别为:X最外层有一个电子,Y有三个电子 层,最外层电子数比次外层的少3,Z的最外层电子数是次外层的3倍。由这三种元素组成的 化合物的化学式可能是( ) A.XYZ2 B.XYZ3 C.X2YZ2 D.X3YZ3
|
|
| 23. | 详细信息 |
|
用电子式表示下列化合物的形成过程 (1)H2S: ; (2)MgF2: 。
|
|
| 24. | 详细信息 |
|
请写出五种化学性质不同的物质的化学式,这些物质的原子核外都具有10个电子,它们的化学式分别为______、_____、_____、_____、_____。
|
|
| 25. | 详细信息 |
|
1~20号元素(稀有气体元素除外)中: (1)原子半径最小的________ ,是原子半径最大的是________ 。 (2)与水反应最剧烈的金属单质是________ ,非金属单质是________ 。 (3)既能与酸反应,又能与碱反应的金属单质是_______。 (4)硬度最大的单质是_______。 (5)气态氢化物的水溶液酸性最强的是_______。 (6)最高价氧化物对应的水化物碱性最强的是______。
|
|
| 26. | 详细信息 |
|
质量相同的H2O和D2O所含质子数之比为______,中子数之比为___,分别与足量的金属钠反应生成气体在同温同压下体积之比为______。
|
|
| 27. | 详细信息 |
|
已知硼有两种同位素原子10B和11B,若硼的相对原子质量为10.8,则10B的质量百分含量为____。
|
|
| 28. | 详细信息 |
|
向100ml 0.5mol/L AlCl3 中逐渐加入0.5mol/L的NaOH 溶液,最后得到白色沉淀2.65克。求用去的NaOH 溶液的体积___。
|
|
| 29. | 详细信息 |
|
A、B、C、D四种元素,A单质在B单质中燃烧发出苍白色火焰,C单质跟A、D形成的化合物的水溶液反应生成A单质,C原子与B原子的电子层相同,且最外层电子数之差为奇数,D原子最外层电子数为K层电子数的3倍,其单质为淡黄色固体。 (1)四种元素符号为A_________,B_________,C_________,D_________; (2)离子的电子层结构相同的二种元素是_________,离子的结构示意图分别为_________、_________; (3)四种元素中能形成AB型共价化合物的元素是__,由它们的同位素原子形成的AB型分子共有___,其中质量数最小的一种分子可用同位 素符号表示为_____。
|
|
| 30. | 详细信息 |
|
W、X、Y、Z为短周期内除稀有气体元素外的四种元素。它们的原子序数依次增大,其中只有Y是金属元素,Y的最外层电子数和W最外层电子数相等,Y、Z两元素的质子数之和为W、X两元素的质子数之和的3倍。由此可知元素W为___;X为______;Y 为______;Z为_____。上述元素中任意三种可组成盐,写出这些盐的化学式_________。四种元素中两两组合,能生成共价化合物的化学式有(至少写四种)______ 、______ 、_____ 、______。
|
|
| 31. | 详细信息 |
|
有A、B、C、D、E五种微粒:①A微粒核内有14个中子,核外M电子层上有2个电子;②B微粒得到2个电子后,其电子层结构与Ne相同;③C微粒带有一个单位的正电荷,核电荷数为11;④D微粒核外有18个电子,当失去1个电子时呈电中性;⑤E微粒不带电,其质数量为1。依次写出A、B、C、D、E各微粒的符号____、____、___、_____、______。
|
|