2018辽宁高二上学期人教版高中化学期末考试
| 1. | 详细信息 |
|
化学与科技生产、生活环境等密切相关,下列说法不正确的是 A.“一带一路”是“现代丝绸之路”,丝绸的主要成分是蛋白质,属于天然高分子化合物 B.使用可降解的聚碳酸酯塑料和向燃煤中加入生石灰,都能减轻环境污染 C.石墨烯是一种从石墨材料中用“撕裂”方法“剥离”出的单层碳原子面材料,石墨烯和乙烯都属于烯烃 D.用浸泡过酸性高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 |
|
| 2. | 详细信息 |
|
室温下,将0.05 mol Na2CO3 固体溶于水配成100mL 溶液,向溶液中分别加入下列物质。有关结论正确的是 A.加入0.05molCaO,溶液中c(OH-)/c (HCO3-)增大 B.加入50mL 1mol/LH2SO4,反应结束后,c(Na+)=c(SO42-) C.加入50mL H2O,由水电离出的c(H+)·c(OH-)不变 D.加入0.1molNaHSO4固体,反应完全后,溶液pH 减小,c(Na+)不变 |
|
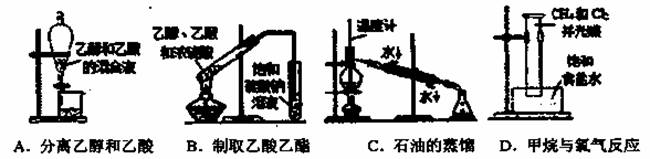
| 3. | 详细信息 |
|
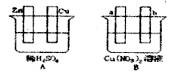
下列实验装置或操作能达到实验目的的是
|
|
| 4. | 详细信息 |
|
下列关于糖类、脂肪和蛋白质的说法不正确的是 A.淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体 B.葡萄糖可以发生氧化反应和银镜反应,说明葡萄糖具有还原性 C.通过盐析从溶液中析出的蛋白质仍能溶解于水 D.脂肪能发生皂化反应,生成甘油和高级脂肪酸钠 |
|
| 5. | 详细信息 |
|
下图甲是一种利用微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成对环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是
A.铁电极应与Y 相连接 B.H+透过质子交换膜由右向左移动 C.当N 电极消耗0.25mol 气体时,则铁电极增重16g D.M 电极反应式:H2NCONH2+H2O-6e-=CO2↑+N2+6H+ |
|
| 6. | 详细信息 |
|
下列涉及有机物的性质或应用的说法不正确的是 A.淀粉、纤维素、蛋白质都是天然高分子化合物 B.酶是一类特殊的蛋白质,是生物体内重要的催化剂 C.从牛奶中提取的酪素,可以用来制作食品和塑料 D.纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
|
| 7. | 详细信息 |
|
下列说法中正确的是 A.丙烯分子所有原子均在同一平面上 B.向溴水中分别通入乙烯加入苯,都能观察到溴水褪色现象,但原因不同 C.C4H4 只有 D.芳香烃 |
|
| 8. | 详细信息 |
|
将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是 A.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收 B.产物的平均摩尔质量为24g/mol C.若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则压强变为原来的1/3 D.反应中消耗的氧气为56g |
|
| 9. | 详细信息 |
|
ClO2 是一种高效安全的杀菌消毒剂。用氯化钠电解法生成ClO2 的工艺原理示意图如下图,发生器内电解生成ClO2。下列说法正确的是
A.a气体是氯气,b 气体是氢气 B.氯化钠电解槽内每生成2 mol a 气体,转移2mol e- C. ClO2发生器中阴极的电极反应式为: 2ClO3-+ 12H++ 10e-==Cl2↑+ 6H2O D.为使a、b 气体恰好完全反应,理论上每生产1mol ClO2需要补充56L(标准状况)b气体 |
|
| 10. | 详细信息 |
|
常温下,电解质溶液中的下列关系式不正确的是 A.已知A-+H2B(少量)==HA+HB-,则结合H+的能力: HB-<A-<B2- B.在0.1mol/L的氨水中滴加0.1mol/L盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=10a-l4mol/L C.将cmol/L的醋酸溶液与0.02 mol/LNaOH 溶液等体积混合后溶液恰好呈中性,用含c 的代数式表示CH3COOH 的电离常数Ka=(2×10-9)/(c-0.02) D.将0.2 mol/L盐酸与0.1mol/L的KAlO2溶液等体积混合,溶液中离子浓度由大到小的顺序: c(Cl-)>c(K+)>c(Al3+ )>c(H+)>c(OH-) |
|
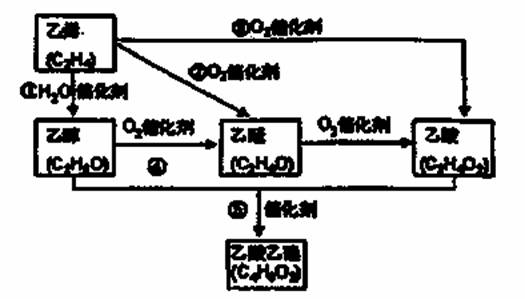
| 11. | 详细信息 |
|
乙烯产量是衡量一个国家石油化工水平的主耍标志。下图是由乙烯合成乙酸乙酯可能的合成路线:
请回答下列问题: (1) 反应①的化学方程式为___________________。 (2) 乙醇的同分异构体的结构简式为_____________;若实验证明乙醇分子有一个特殊氢原子的反应的化学方程式为____________________。 (3) 若C4H8O2 是一种由甲酸形成的酯,写出其中一种与氢氧化钠溶液反应的化学方程式为_________ |
|
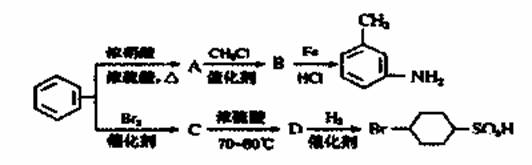
| 12. | 详细信息 |
|
已知:①R—NO2 ③苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。以下是用苯为原料制备某些化合物的转化关系图:
(1)A转化为B的化学方程式是_________________________。 (2) 在“ |
|
| 13. | 详细信息 | ||||||||||||||||||||||||||||||||||||||||||||
|
某些物质的有关数据如下表,回答以下问题:
实验一 乙醇 在 铜 的 催 化下转化为乙醛 将一束质量为w 的铜丝灼烧变黑后,迅速插入装有乙醇的试管a 中。 (1)铜丝上可观察到的现象是______________,解释该现象的化学反应方程式为____________; 实验二 乙醛的提纯 上述实验获得的乙醛含有较多乙醇,可以通过以下操作提纯。
已知:CH3CHO+NaHSO3 (2) 写出Na2CO3溶液参与反应的化学方程式:________________; (3) 某同学设计操作B的装置(夹持和加热装置已略去) 如图所示。
①冷凝管中的液体应从_____口进。(填“D”或“E”) ②下列有关操作与装置的分析,正确的是_____。(填字母) a.烧杯中应装冰水 b.冷凝管应通温水 c.图示装置可用于除去乙酸乙酯中混有的乙醇 实验三 乙醛溶液浓度的测定 室温下利用反应Na2SO3+CH3CHO+H2O→CH3CH(OH)SO3Na↓+NaOH 可以测定“实验一”中试管a内乙醛溶液浓度,操作如下: 取试管a 中溶液4mL,加入1mL 饱和Na2SO3溶液(过量),再加入5mL 水,充分振荡后用pH 计测定溶液pH;另取试管b,加入4mL 乙醇做空白试验,实验结果如右表:
(4) 试管a 中乙醛溶液的物质的量浓度为___mol/L。(列出计算式即可) |
|||||||||||||||||||||||||||||||||||||||||||||
| 14. | 详细信息 |
|
已知: 乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3) 的电离平衡常数为K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。 回答下列问题: (1) 写出水溶液中草酸的第一步电离方程式________________________。 (2) 相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH 比Na2CO3溶液的pH_____(填“大”、“小”或“相等”)。 (3) 常温下将0.4mol/L 的KOH 溶液20mL 与0.2mol/L 的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为___________________________。 (4) 往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为_______________________。 (5) 25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmolL的草酸钾溶液20mL后,有草酸钙沉淀生成,则c 的最小值为____________。 |
|
| 15. | 详细信息 |
|
按要求对下图中两极进行必要的联接并填空:
(1) 在A 图中,使铜片上冒H2气泡。请加以必要联接①______(在答题卡的图中画线),则联接后的装置叫②______。电极反应式: 锌板:③_______; 铜板:④_______。 |
|
| 16. | 详细信息 |
|
化学学科中的平衡理论主要包括: 化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1) 在体积为3L 的密闭容器中,CO 与H2 在一定条件下反应生成甲醇(左图):CO(g)+2H2(g) (3) 生活中明矾常作净水剂,其净水的原理是_______ (用离子方程式表示)。 常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=_______。{Ksp[Cr(OH) 3] =6.0×10-31} |
|