2017四川高二下学期人教版高中化学期中考试
| 1. | 详细信息 |
|
下列关于化学与生活的说法正确的是 ( ) A.由SiO2构成的晶体有:水晶、玛瑙、石英晶体 B.胶体的电泳现象的产生,是由于胶体带电,胶体在外加电场下可以定向流动 C.明矾可用于自来水的净化和杀菌消毒 D.Fe3+与SCN-形成的配合物,常用于电影特技和魔术表演
|
|
| 2. | 详细信息 |
|
下列有关物质性质的比较顺序中,不正确的是 ( ) A.热稳定性:HF<HCl<HBr<HI B.微粒半径:K+>Na+ >Mg2+>Al3+ C.酸性:HClO4>H2SO4>H3PO4>H2SiO3 D.第一电离能:Cl>P>S>Si
|
|
| 3. | 详细信息 |
|
铝、铍及其化合物具有相似的化学性质,已知:BeCl2+Na2BeO2+2H2O═2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是( ) A.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 B.BeCl2水溶液的导电性强,故BeCl2是离子化合物 C.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO D.BeCl2溶液的pH>7,将其蒸干并灼烧后得到的残留物可能是BeCl2
|
|
| 4. | 详细信息 |
|
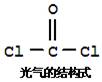
氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2 → 2HCl +2COCl2。下列说法不正确的有 ( )
A.CHCl3分子为含极性键的非极性分子 B.COCl2分子中含有3个σ键、一个π键,中心C原子采用sp2杂化 C.COCl2分子中所有原子的最外层电子都满足8电子稳定结构 D.使用前可用硝酸银稀溶液检验氯仿是否变质
|
|
| 5. | 详细信息 |
|
下列有关说法不正确的是 ( )
A.水合铜离子的模型如图甲所示,1个水合铜离子中有4个配位键 B.CaF2晶体的晶胞如图乙所示,每个CaF2晶胞平均占有4个Ca2+ C.H原子的电子云图如图丙所示,H原子核外的大多数电子在原子核附近运动 D.金属Ag的原子堆积模型如图丁所示,该金属晶体为最密堆积,每个Ag原子的配位数均为12
|
|
| 6. | 详细信息 |
|
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是 ( ) A.元素的非金属性由大到小的顺序为c>b>a B.a和其他3种元素均能形成共价化合物 C.d和其他3种元素均能形成离子晶体 D.元素a 、b、c各自最高和最低化合价的代数和分别为0、4、6
|
|
| 7. | 详细信息 |
|
下列说法错误的是( ) A.常温下,pH相等的①NaHCO3、②Na2CO3、③NaOH溶液的物质的量浓度大小为③<②<① B.25℃时,PH=10的NaOH溶液和PH=10的Na2CO3溶液中水的电离程度相同 C.常温下,若测得NaHA溶液的PH>7,则该溶液中一定有c(H2A)> c(A2-) D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合,该溶液中的各离子浓度符合此关系:3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+)
|
|
| 8. | 详细信息 |
|
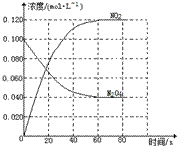
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)
请回答下列问题: (1)该反应的△H_______0(填“<”或“>”);100℃时,体系中各物质浓度随时间变化如右图所示。在0~60s时段,反应速率v(N2O4)为_______mol·L-1·s-1 ,该反应的平衡常数K为__________。 (2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。T_______100℃(填“<”或“>”),判断理由是_____________________________。 (3)恒温恒容条件下向上述平衡体系中通入氦气,平衡_____移动(填“向左”、“向右”或“不”);
|
|
| 9. | 详细信息 |
|
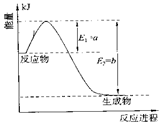
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用。
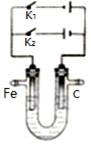
①右图是一定的温度和压强下N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: __________________。(△H的数值用含字母a、b的代数式表示) ②在25°C时,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液显中性,则反应后的溶液中:c(NH4+)_______c(Cl-)(填“>”、“<”或“=”) (2)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C时,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1的硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是________________,产生该现象的原因是(用离子方程式表示)_______________________________________________________。 (3)下图为一电化学装置,电极分别为铁棒和碳棒。U形管中盛有电解质溶液。
①若U形管中盛有饱和食盐水,打开K2,闭合K1, 铁棒为_______ 极,碳棒上的电极反应式为_____________________________________________。 ②若U形管中是含Cr2O72-的酸性废水,通过该装置可以除去Cr2O72-离子。闭合K2,打开K1,阳极区所发生的反应有:Fe-2e- =Fe2+和___________________________ (写离子反应方程式)
|
|
| 10. | 详细信息 |
|
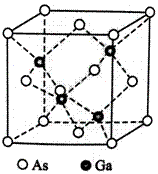
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答列问题: (1)写出基态As原子的核外电子排布式_____________________________________________ (2)根据元素周期律,原子半径Ga_______As,第一电离能Ga_________As。(填“>”或“<”) (3)AsCl3分子的立体构型为______________,其中As的杂化轨道类型为____________________。
(5)GaAs的熔点为1238℃,密度为ρ g/cm3,其晶胞结构如图所示。该晶体类型为______________,Ga与As以______________键键合。 Ga和As的摩尔质量分别为
|
|