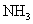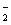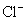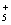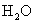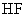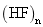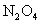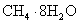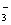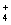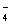山东省泰安市2020-2021学年高二下学期3月月考化学试题含解析
| 1. | 详细信息 |
|
A . NaCl 、 HCl B . CO 2 、 SiO 2 C . SO 2 、 H 2 O D . NH 4 Cl 、 CCl 4 |
|
| 2. | 详细信息 |
|
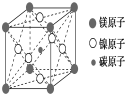
A . Mg 2 CNi 3 B . MgCNi 2 C . MgCNi 3 D . MgC 2 Ni |
|
| 3. | 详细信息 |
|
A . CO 2 与 NO 2 B . AlCl 3 与 C 2 H 2 C . H 2 O 与 BF 3 D . CH 4 与 NH 3 |
|
| 4. | 详细信息 |
|
A . BF 3 与 PCl 3 为三角锥形 B . SO 3 与 CO 3 2- 为平面三角形 C . SO 2 键角大于 120 o D . BF 3 是三角锥形分子 |
|
| 5. | 详细信息 |
|
A . B . C . D . |
|
| 6. | 详细信息 |
|
A . 该分子有 8个σ键,5个π键 B . 该分子中碳原子有 sp 和 sp 2 杂化 C . 该分子存在非极性键 D . 该分子中有 8个碳原子在同一平面上 |
|
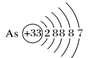
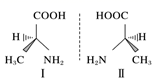
| 7. | 详细信息 |
|
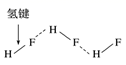
A . 砷原子的结构示意图 C . HF 分子间的氢键 |
|
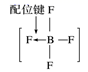
| 8. | 详细信息 |
|
A . X 原子一定是 sp 2 杂化 B . X 原子一定为 sp 3 杂化 C . X 原子上一定存在孤电子对 D . VSEPR 模型一定是平面三角形 |
|
| 9. | 详细信息 |
|
A . AB 2 分子的空间构型为 “V” 形 B . A---B 键为极性共价键, AB 2 分子为非极性分子 C . AB 2 与 H 2 O 相比, AB 2 的熔点、沸点比 H 2 O 的低 D . AB 2 分子中无氢原子,分子间不能形成氢键,而 H 2 O 分子间能形成氢键 |
|
| 10. | 详细信息 |
|
A . H 2 O 分子中氧原子为 sp 2 杂化,其分子几何构型为 V 形 B . 配合物中,中心离子与配体间、配离子与酸根离子间都是以配位键结合 C . 配离子中,中心离子提供空轨道,配体提供孤对电子对 D . NH 4 + 是平面四边形结构 |
|
| 11. | 详细信息 | |||
|
| 分子 | 立体结构 | 原因 | |
| A | 氨基负离子 (NH | 直线型 | N 原子采用 sp 杂化 | |
| B | 二氧化硫 (SO 2 ) | V 型 | S 原子采用 sp 2 杂化 | |
| C | 碳酸根离子 (CO | 三角锥型 | C 原子采用 sp 3 杂化 | |
| D | 乙炔 (C 2 H 2 ) | 直线型 | C 原子采用 sp 杂化且 C 原子的价电子均参与成键 | |
| 12. | 详细信息 | ||
|
选项 | 实验事实 | 理论解释 | |
| A | SO 2 、 H 2 O 空间构型为 V 形 | SO 2 、 H 2 O 中心原子均为 sp 3 杂化 | |
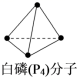
| B | 白磷为正四面体分子 | 白磷分子中 P-P 键间的夹角是 109.5 | |
| C | 1 体积水可溶 700 体积氨气 | 氨是极性分子,有氢键的影响 | |
| D | HF 的沸点高于 HCl | H—F 的键长比 H—Cl 的键长短 | |
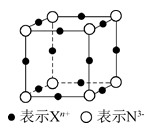
| 13. | 详细信息 |
|
A . X 元素的原子序数是 19 B . 该晶体中阳离子与阴离子个数比为 3 ∶ 1 C . X n+ 中 n=1 D . 晶体中每个 X n+ 周围有 2 个等距离且最近的 N 3- |
|
| 14. | 详细信息 |
|
A . 配合物中中心离子的电荷数和配位数均为 6 B . 该配合物可能是平面正方形结构 C . D . |
|
| 15. | 详细信息 |
|
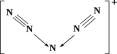
A . N 5 AsF 6 中 F 的化合价为 -1 价, As 的化合价为 +5 价 B . N C . N D . N 5 AsF 6 为离子化合物 |
|
| 16. | 详细信息 |
|
A . 元素 X 与氢形成的原子比为 1 : 1 的化合物有很多种 B . 元素 W 、 X 的氯化物中,各原子均满足 8 电子的稳定结构 C . 元素 Y 的单质与氢氧化钠溶液或盐酸反应均有氢气生成 D . 元素 Z 可与元素 X 形成共价化合物 XZ 2 |
|
| 17. | 详细信息 |
|
A . H 2 O 分子 VSEPR 模型为 V 形 B . CH 3 CH 2 OH 分子中亚甲基 (-CH 2 -) 上的 C 原子的杂化形式为 sp 3 C . 在上述涉及的 4 种物质中,沸点从低到高的顺序为 H 2 <CO< H 2 O<CH 3 CH 2 OH D . CO(NH 2 ) 2 分子中含有的 σ 键与 π 键的数目之比为 7 : 1 |
|
| 18. | 详细信息 |
|
A . B . 液态氟化氢中氟化氢分子之间形成氢键,可写为 C . 氨气极易溶于水,原因之一是氨分子与水分子之间形成了氢键 D . 可燃冰( |
|
| 19. | 详细信息 |
|
A . CS 2 为 V 形的极性分子 B . ClO C . SF 6 中有 6 对完全相同的成键电子 D . SiF 4 和 SO |
|
| 20. | 详细信息 |
|
A . B 的最高价氧化物对应的水化物的酸性比 E 强 B . B 的氢化物分子中 B 采用 sp 3 杂化 C . 向 D 单质与沸水反应后的溶液中滴加酚酞,溶液变红 D . B 的氢化物的沸点一定高于 A 的氢化物 |
|
| 21. | 详细信息 |
|
(1) 基态钴原子价电子排布式为 _______ 。 (2)Co 3+ 在水中易被还原成 Co 2+ ,而在氨水中可稳定存在,其原因为 _______ 。 (3)[Co(NO (4) 八面体 CoCl 3 ·3NH 3 结构有 _______ 种,其中极性分子有 _______ 种。 (5) 配合物 Co 2 (CO) 8 的结构如下图,该配合物物质中存在的作用力类型有 _______ ( 填字母 ) 。 A. 金属键 B. 离子键 C. 共价键 D. 配位键 E. 氢键 F. 范德华力 |
|
| 22. | 详细信息 |
|
(1) 碳元素有 12 C 、 13 C 和 14 C 等同位素, 14 C 原子核外存在 _______ 对自旋相反的电子。 B 、 C 、 N 三种元素的电负性由大到小的顺序是 _______ 。 (2) 硼酸 (H 3 BO 3 ) 能够吸收中子,屏蔽核辐射。 ①硼酸晶体中, B 的杂化轨道类型是 _______ 。 ②硼酸是一元弱酸,其呈酸性的机理是:硼酸与水作用时,硼原子与水电离产生的 OH - 以配位键结合成 Y - ,导致溶液中 c(H + )>c(OH - ) 。 Y - 的结构简式是 _______ ;硼酸与水作用时,每生成一个 Y - ,断裂 _______ 个 σ 键。 (3)NH 3 可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为 N 4 H 4 (SO 4 ) 2 的物质。该物质在水溶液中以 SO |
|
| 23. | 详细信息 |
|
(2) 甲醇 (CH 3 OH) 在 Cu 催化作用下被氧化成甲醛 (HCHO) 。甲醛分子内 σ 键与 π 键个数之比为 _______ 。甲醇分子内的 O—C—H 键角 _______ ( 填 “ 大于 ”“ 等于 ” 或 “ 小于 ”) 甲醛分子内的 O-C-H键角; (3) 根据等电子体原理判断 N (4) 氯气与熟石灰反应制漂白粉时会生成副产物 Ca(ClO 3 ) 2 , ClO |
|
| 24. | 详细信息 |
|
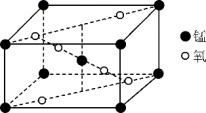
(1) 天冬酰胺中 _______ ( 名称 ) 元素基态原子核外未成对电子数最多。 (2) 天冬酰胺中碳原子的杂化轨道类型有 _______ 种。 (3) 画出基态 O 原子的价电子排布图 _______ 。 (4) 写出 BH (5) 某锰氧化物的晶胞结构如图所示,该氧化物的化学式为 _______ 。 |
|
| 25. | 详细信息 |
|
(1) 氨硼烷的晶体类型为 _______ 。 (2) 氨硼烷分子中氮原子、硼原子的杂化轨道类型分别为 _______ , _______ (3) 氨硼烷晶体中存在的作用力有 _______ ( 填序号 ) A 离子键 B 极性键 C 非极性键 D 配位键 E 金属键 F 氢键 G 范德华力 (4) 以 NaBH 4 为硼源、某配合物为氨源可用于制备氨硼烷 . 为测定该配合物的结构,取 2.32g 配合物进行如下实验:用重量法分析金属元素,测得镍元素的质量为 0.59g ;在碱性条件下加热蒸出 NH 3 ,用滴定法测出其物质的量为 0.06mol ;滴加过量硝酸银溶液,有白色沉淀生成,加热,沉淀没有增加;用摩尔法分析含量,测得氯元素质量为 0.71g 。 ①该配合物中镍离子的基态电子排布式为 _______ 。 ②该配合物的结构简式为 _______ 。 |
|